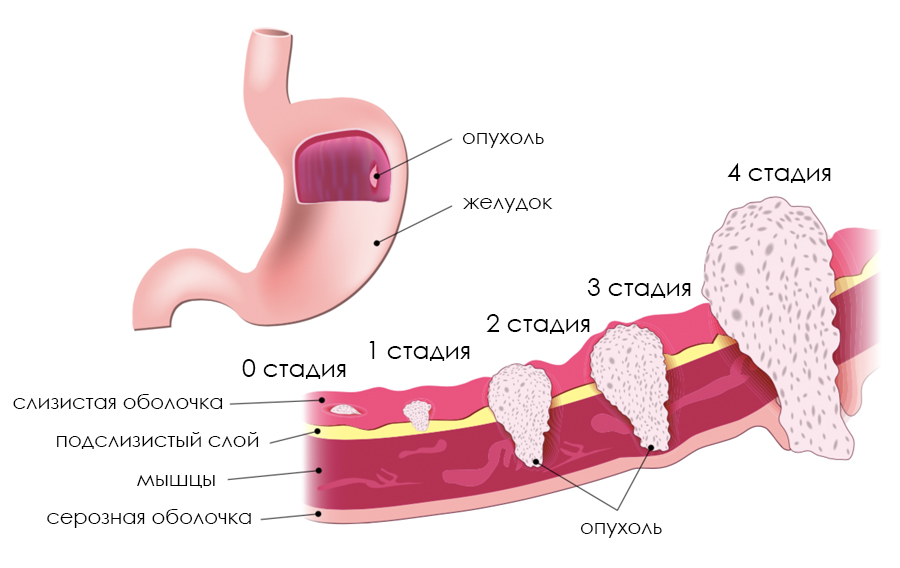
Спленэктомия при раке желудка

Рак желудка (РЖ) устойчиво занимает одно из лидирующих положений в структуре злокачественных опухолей, 8—12% общего количества злокачественных новообразований, а среди новообразований пищеварительного тракта ему принадлежит первое место [8]. В мире ежегодно регистрируется около 850 тысяч новых случаев РЖ, в России — более 37 тыс., и более 15 тыс. больных умирают от этого заболевания [7]. В структуре онкологической заболеваемости в России Р.Ж. занимает четвертое место у мужчин (31,8 на 100 000 населения) и пятое место у женщин (20,9), в структуре смертности от онкологических заболеваний РЖ находится на втором месте в обеих группах. Несмотря на то что заболеваемость РЖ за последние годы снизилась с 31,4 (2003 г.) до25,9 (2013 г.) на 100 000 населения, остается высокой (53,5%) одногодичная летальность после радикального лечения [3]. Основной причиной смерти от РЖ является генерализация злокачественного процесса. Отдаленные результаты лечения РЖ коррелируют с глубиной инвазии опухоли и наличием метастазов в регионарных лимфоузлах [10].
При успехах в химиотерапии злокачественных опухолей хирургический метод лечения остается основным в лечении РЖ, позволяющим надеяться на увеличение выживаемости [1]. Частота диагностики РЖ в I—II стадиях снизилась с 39,3 до 36,3%, среди впервые выявленных больных РЖ, не менее чем у 70% больных диагностируется местно-распространенное поражение желудка в стадии рТ3-рТ4, вследствие этого достаточный радикализм оперативного вмешательства может быть достигнут при выполнении гастрэктомии, нередко в комбинации с резекцией соседних органов [3]. Общепризнанным постулатом в хирургическом лечении РЖ стало понимание необходимости выполнения лимфодиссекции [11, 12].
Долгое время при выполнении радикального хирургического вмешательства при РЖ лимфодиссекция подразумевала удаление большого и малого сальника, т. е. перигастральных лимфоузлов и лимфоузлов в области чревного ствола. В сегодняшнем понимании этот объем лимфодиссекции, соответствующий объему D1, не может быть признан полным. РЖ отличается высоким потенциалом лимфогенного метастазирования, поэтому в стандартную методику радикальной операции должно быть включено удаление лимфоузлов первого и второго этапов метастазирования [15].
Во многих странах мира, включая страны СНГ, при выполнении субтотальной резекции желудка и гастрэктомии стандартным объемом лимфодиссекции считается моноблочное удаление клетчатки с перигастральными и паравазальными лимфоузлами вдоль чревного ствола, общей печеночной артерии, печеночно-двенадцатиперстной связки, селезеночной артерии вплоть до ворот селезенки [1, 5, 14].
В последние годы на страницах отечественных и зарубежных изданий неоднократно обсуждался вопрос об эффективности расширенной лимфодиссекции, предусматривающей удаление забрюшинных и парааортальных лимфоузлов, соответствующее объему D3-D4 [6, 11, 12]. Вместе с тем расширенные лимфодиссекции D3 и D4 не могут быть стандартом хирургического лечения РЖ, как это предлагает японская ассоциация (JCOG-9501), эффективность расширенной лимфодиссекции подтверждена результатами рандомизированных исследований [1, 11, 12].
Учитывая, что большинству больных в разных странах всего мира, включая страны СНГ, операция производится при местно-распространенном РЖ, целесообразность выполнения лимфодиссекции в объеме D3-D4 вообще является предметом дискуссии, поскольку при этом более высока вероятность развития имплантационных и гематогенных метастазов [7, 8].
Международная ассоциация по исследованию РЖ (IGCA) в качестве стандартного объема лимфодиссекции при раке признала только лимфодиссекцию в объеме D2 [1, 7].
Вдоль селезеночных сосудов и в проекции ворот селезенки располагаются регионарные лимфоузлы 10-й и 11-й групп (согласно классификации JGCA). Морфологическими исследованиями установлено, что не менее чем у 30% больных РЖ эти группы лимфоузлов содержат опухолевые эмболы, 45% случаев регионарного метастазирования в лимфоузлы 10-й и 11-й групп лимфоузлов связано с локализацией опухоли в проксимальном отделе желудка, 22% случаев — с локализацией опухоли в теле желудка, 32% — с тотальным поражением желудка. Только у 4,5% больных раком антрального отдела желудка наблюдается регионарное метастазирование в лимфоузлы 10-й и 11-й групп лимфоузлов [2]. Одним из факторов, который, по мнению ряда исследователей, может оказать благоприятное влияние на увеличение продолжительности жизни больных РЖ, прошедших хирургическое лечение в объеме гастрэктомии, является спленэктомия, поскольку последняя облегчает более полное удаление лимфоузлов 10-й и 11-й групп. Этот объем радикального хирургического вмешательства в ряде клиник был признан стандартным [9, 14]. Другие исследователи считают, что удаление значительной части лимфоидной ткани и селезенки ведет к развитию вторичных иммунодефицитных состояний, отрицательно влияющих не только на послеоперационное течение, увеличивая риск осложнений, но и на отдаленные результаты, сокращая продолжительность безрецидивного периода жизни, увеличивая риск метастазирования [4].
Гастрэктомия с лимфодиссекцией в объеме D2, удалением лимфоузлов вдоль селезеночных сосудов, включая ворота селезенки, с сохранением самой селезенки позволило бы снизить риск иммунодефицитных осложнений и увеличить выживаемость больных в отдаленные сроки. Противоречивость сведений, касающихся органосохранной гастрэктомии, не позволяет дать окончательного ответа на вопрос о преимуществах или недостатках такого вида хирургического вмешательства при РЖ, поэтому нельзя рекомендовать ее широкое практическое применение.
Цель настоящего исследования — оценить непосредственные и отдаленные результаты спленосохранной лимфодиссекции D2 при гастрэктомии у больных РЖ.
Материал исследования базируется на анализе результатов лечения 480 больных РЖ, которые прошли хирургическое лечение в объеме гастрэктомии в Крымском республиканском онкологическом клиническом диспансере им. В.М. Ефетова за период с 1999 по 2012 г. Все больные были разделены на две группы — основную (n=371) и контрольную (n=109). Распределение больных на группы осуществляли в соответствии с методикой выполнения мобилизационного этапа гастрэктомии. У больных основной группы лимфодиссекцию в объеме D2 осуществляли без лигирования сосудов селезенки с сохранением последней. Суть спленосохранной методики лимфодиссекции D2 при гастрэктомии заключалась в последовательном удалении парапанкреатической клетчатки и лимфоузлов вдоль селезеночной артерии и вены (11-я группа лимфоузлов) вплоть до ворот селезенки (10-я группа лимфоузлов). У больных контрольной группы лимфодиссекция в объеме D2 предусматривала удаление парапанкреатической клетчатки и лимфоузлов вдоль селезеночной артерии и вены до ворот селезенки, с мобилизацией последней, лигированием селезеночных сосудов в области хвоста поджелудочной железы и удалением селезенки единым блоком с желудком. Все удаленные лимфоузлы вдоль селезеночных сосудов и ворот селезенки маркировали.
Из рассматриваемой группы (спленэктомия при гастрэктомии) исключены больные, у которых удаление селезенки выполняли по ятрогенным показаниям, при врастании опухоли желудка в селезенку, инфильтрации желудочно-селезеночной связки или метастатически измененных лимфоузлах, расположенных по ходу селезеночных сосудов и в воротах селезенки. В такой ситуации спленэктомию производили по абсолютным показаниям как неотъемлемую часть комбинированного хирургического вмешательства, эта категория пациентов в исследование не включена.
В основной группе мужчин было 217 (58,5%), женщин — 154 (41,5%), средний возраст пациентов 60,9±10,2 года, в контрольной группе — 69 (63,3%) и 40 (36,7%) соответственно (p=0,43), средний возраст пациентов 61,7±10,8 года (р=0,84). Достоверных различий по полу (p=0,43) и возрасту (p=0,84) не обнаружено.
В проксимальном отделе желудка опухоль локализовалась у 99 (26,7±2,3%) больных основной и у 30 (27,5±4,3%) больных контрольной группы (р=0,90), в теле желудка — у 272 (73,3±2,3%) и 79 (72,5±4,3%) больных соответственно. У 287 (77,4±2,1%) больных основной и у 89 (81,7±3,7%) больных контрольной группы (р=0,20) опухоль имела эндофитный или смешанный характер роста, экзофитная форма роста диагностирована у 84 (22,6±2,1%) больных основной и у 20 (18,3±3,7%) больных контрольной группы.
Гистологическая характеристика РЖ у пациентов исследуемых групп представлена в табл. 1.
 Таблица 1. Гистологическая структура РЖ у больных исследуемых групп
Таблица 1. Гистологическая структура РЖ у больных исследуемых групп
В табл. 2 представлено распределение больных в соответствии с Международной системой стадирования злокачественных опухолей ТNM (2007 г.).
 Таблица 2. Распределение больных исследуемых групп в зависимости от стадии РЖ (классификация TNM, редакция 2007 г.)
Таблица 2. Распределение больных исследуемых групп в зависимости от стадии РЖ (классификация TNM, редакция 2007 г.)
Установлена сопоставимость групп накануне хирургического лечения, полученные данные рассматривали как исходные. Всем больным основной и контрольной групп проведено комбинированное лечение, первичным этапом которого было хирургическое лечение, в дальнейшем пациенты получали химиотерапию согласно стандартам лечения.
Статистический анализ проводили с помощью программ статистических расчетов Excel 2007, Statistica for Windows v.6.0. Непосредственные результаты лечения исследовали на основании использования U-критерия Mann—Whitney, χ2 с поправкой Йетса на непрерывность («Yates corrected Chi-square»), точного критерия Fisher, two-tailed. В качестве меры центральной тенденции для оценки продолжительности жизни после операции в исследованных выборках использовали среднюю продолжительность, медиану и квартили (25 и 75 процентили). Основным статистическим методом исследования явился анализ выживаемости. Функцию выживания оценивали с помощью метода Каплана—Майера. При попарном сравнении выборок был использован тест Log-Rank, а также непараметрический однофакторный дисперсионный анализ Краскала—Уоллиса. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий) принимали равным 0,05. Статистически значимым для всех показателей считали критерий достоверности p<0,05.
Выполнение спленосохранной лимфодиссекции D2 при гастрэктомии не привело к ухудшению основных показателей, отражающих ход хирургического вмешательства. Несмотря на тот факт, что прецизионная диссекция вдоль селезеночных сосудов и ворот селезенки увеличивала общее время, затраченное на лимфодиссекцию, на 17,2±2,1 мин, в целом увеличения продолжительности всей операции в основной группе не отмечено. При этом объем кровопотери статистически значимо отличался от такового в группе больных, которым производили удаление селезенки, не в пользу последней (табл. 3).
 Таблица 3. Особенности операции и послеоперационного периода
Таблица 3. Особенности операции и послеоперационного периода
Статистически значимой разницы в частоте послеоперационных осложнений и в показателях послеоперационной летальности в основной и контрольной группах не было. В основной группе обращают на себя внимание осложнения, имевшие специфический характер и связанные с особенностями выполненной лимфодиссекции. Так, у 4 (1,1%) больных в разные сроки послеоперационного периода диагностирован панкреонекроз, развитие которого можно объяснить широкой мобилизацией частично тела и хвоста поджелудочной железы, интраоперационной травмой, микроциркуляторными нарушениями и ишемизацией паренхимы (табл. 4).
 Таблица 4. Характер послеоперационных осложнений и причины летального исхода
Таблица 4. Характер послеоперационных осложнений и причины летального исхода
Среднее количество удаленных лимфоузлов после спленосохранной лимфодиссекции было 27,2, после спленэктомии — 25,4. Среднее количество удаленных лимфоузлов 10-й и 11-й групп в основной группе составило 5,8 (21,3%), в контрольной — 5,5 (21,6%) (р=0,92), при этом среднее количество лимфоузлов 10-й группы — 2,2 (8,1%) и 2,0 (8,8%) соответственно (р=0,75), 11-й группы — 3,6 (13,2%) и 3,5 (13,8%) соответственно (р=0,84), т. е. количество удаляемых регионарных лимфоузлов вдоль селезеночных сосудов и лимфоузлов в воротах селезенки при спленосохранной лимфодиссекции D2 было у большего числа больных.
Из 480 больных у 68 (14,1%) диагностированы метастазы в лимфоузлы 10-й и 11-й групп, в том числе у 54 (14,5%) больных основной и у 14 (12,8%) больных контрольной группы (р=0,76). Метастазы в воротах селезенки диагностированы у 28 (7,5%) больных основной и у 9 (8,2%) больных контрольной группы (р=0,30), метастазы вдоль селезеночных сосудов — у 24 (6,5%) и у 7 (6,4%) больных соответственно (р=0,90).
Изолированное метастазирование только в лимфоузлы ворот селезенки выявлено у 19 (5,1%) больных основной и у 5 (4,6%) больных контрольной группы (р=0,82), изолированное метастазирование в лимфоузлы вдоль селезеночных сосудов — у 16 (4,3%) и 4 (3,6%) больных соответственно (р=0,55). Следовательно, спленосохранная лимфодиссекция D2 ни по количеству удаляемых лимфоузлов, ни по частоте диагностируемых регионарных метастазов не уступает лимфодиссекции D2, предусматривающей выполнение спленэктомии.
Установлена наиболее высокая частота метастазирования РЖ в лимфоузлы селезеночных сосудов и ворот селезенки при прорастании опухоли всех слоев стенки желудка и выходе на серозный покров (рТ3) — 14,5 и 12,8% соответственно 10-й и 11-й группы, при локализации в теле желудка — 11,3 и 9,2%, инфильтративной форме роста — 13,2 и 11,0%, низкодифференцированном раке — 5,7 и 4,6% и перстневидноклеточном раке желудка — 5,1 и 4,6%. При раннем раке желудка (рТ1-рТ2) случаев метастазирования в указанные группы лимфоузлов диагностировано не было.
Проведен анализ частоты метастазирования в регионарные лимфоузлы 10-й и 11-й групп в зависимости от глубины инвазии опухоли, ее локализации, формы роста и морфологического строения (табл. 5).
 Таблица 5. Частота метастазирования в регионарные лимфоузлы 10-й и 11-й групп
Таблица 5. Частота метастазирования в регионарные лимфоузлы 10-й и 11-й групп
Статистически значимой разницы в показателях, отражающих частоту метастазирования в регионарных лимфоузлах в проекции ворот селезенки и селезеночных сосудов, в зависимости от особенностей лимфодиссекции не установлено.
Из 480 больных отдаленные результаты изучены у 431 больного, отдаленные результаты в 5-летний период прослежены у 89,8% (табл. 6, 7).
 Таблица 6. Данные описательной статистики выживаемости (показатели в годах)
Таблица 6. Данные описательной статистики выживаемости (показатели в годах)
 Таблица 7. Пятилетняя выживаемость (в %) в зависимости от характеристики опухоли и особенностей выполненной лимфодиссекции
Таблица 7. Пятилетняя выживаемость (в %) в зависимости от характеристики опухоли и особенностей выполненной лимфодиссекции
Детальный анализ показателей, отражающих отдаленные результаты лечения, свидетельствует, что выживаемость в разные сроки отдаленного периода наблюдения была выше у больных после спленосохранной лимфодиссекции D2 по сравнению с пациентами, которым лимфодиссекция предусматривала удаление селезенки, хотя статистически значимых различий в сравниваемых группах во все сроки наблюдения получено не было.
Детальный анализ 5-летней выживаемости в исследуемых группах в зависимости от особенностей развития РЖ показал, что при стадии рТ1-рТ2, экзофитной форме роста, высокодифференцированной аденокарциноме статистически значимой разницы в выживаемости больных в отдаленные сроки наблюдений нет (р>0,05). С увеличением глубины инвазии опухоли, особенно с выходом на серозный покров стенки желудка, при инфильтративной форме роста, низкодифференцированной аденокарциноме, перстневидноклеточном раке прослежены изменения в выживаемости, не имеющие статистической значимости. При этом спленосохранная лимфодиссекция D2 у больных с наихудшими показателями выживаемости не являлась фактором, способствующим ухудшению отдаленных результатов хирургического лечения больных этой категории (см. табл. 7).
Сравнив среднюю продолжительность жизни пациентов, перенесших спленосохранную лимфодиссекцию D2 (3,4±3,3 года) и лимфодиссекцию D2 со спленэктомией (2,7±2,5 года), установили, что выполнение принципиальной спленэктомии не улучшает отдаленные результаты лечения больных РЖ.
Выживаемость больных основной и контрольной групп не различалась (см. рисунок).
 Выживаемость при РЖ после разных типов хирургических вмешательств.
Выживаемость при РЖ после разных типов хирургических вмешательств.
Таким образом, спленосохранная лимфодиссекция D2 статистически значимо не ассоциирована с увеличением послеоперационных осложнений. При выполнении спленосохранной лимфодиссекции количество удаляемых регионарных лимфоузлов в воротах селезенки и вдоль селезеночных сосудов не уменьшается, что соответствует лимфодиссекции в объеме D2. При локализации опухоли в проксимальном отделе и теле желудка спленосохранная лимфодиссекция D2 является оптимальной и достаточной по объему, не уступая в радикальности лимфодиссекции, предусматривающей спленэктомию, а выполнение принципиальной спленэктомии не способствует достоверному улучшению отдаленных результатов хирургического лечения больных раком желудка.
При диагностировании у пациента онкологической патологии применяются различные методы лечения тяжёлой и опасной для жизни болезни. Первоначально проводится полная, всесторонняя диагностика патологического состояния. При формировании способа стараются применять лечение неинвазивными и малоинвазивными способами. К таковым относятся химиотерапия (остановка жизнедеятельности онкологических клеток с помощью применения фармакологических препаратов, вводимых через вену в организм больного) или радиотерапия (применение радиационных импульсов для разрушения мутировавших клеток, из которых формируется опухоль в желудке).
Если вышеприведённые методы не обеспечили необходимый результат, применяется хирургический (оперативный) метод вмешательства в лечение пациента. Удаление желудка при раке позволяет максимально сократить развитие онкологии и при благоприятных факторах полностью победить болезнь. Но подобный метод не проходит без последствий для пациента. И до конца жизни человек будет вынужден соблюдать свод строгих правил по питанию, чтобы избежать интоксикации или переедания, которые при отсутствии органа желудка грозят риском летального исхода.
В редких случаях осуществляется трансплантология (пересадка) желудка. Это тоже сложнейшая операция, способная привести к отторжению пересаженного органа.
В настоящее время проводятся исследования по созданию искусственного желудочно-кишечного тракта. Больному раком порой устанавливают искусственный желудок, полностью функциональный.
Противопоказания к применению хирургического вмешательства
В ряде случаев, применение операции не позволяет добиться желаемых результатов. Вмешательство не проводят в связи с отсутствием шансов на значительное улучшение состояния пациента.
Гастрэктомия желудка
Подобная ситуация может сложиться в результате распространения опухоли по отдалённым органам через систему метастазов. В данном случае удаление первоисточника онкологического процесса не даст требуемого улучшения в связи с тем, что заболевание будет распространяться из других очагов патологии. Операция производится только при опухоли без метастазов. В излишней травматизации организма смысла нет.
Дополнительными противопоказаниями к проведению хирургического вмешательства будут:
- пониженная свёртываемость крови;
- тяжёлая почечная недостаточность;
- тяжёлая недостаточность сердца и сосудов;
- увеличение желудка в размерах;
- злокачественный перитонит.
При подобных состояниях удаление желудка принесёт больше вреда, чем пользы либо окажется бесполезным. Для пациента подбираются иные виды лечения онкологии, не связанные с полостными видами оперативного вмешательства.
Варианты оперативного вмешательства
В зависимости от показаний возможно оперативное вмешательство в трёх вариантах:
- Резекция желудка.
- Гастрэктомия.
- Лимфодиссекция.
Резекция желудка
Операция по удалению подразумевает ампутацию повреждённой части органа. При малой распространённости по органу опухоли применяется только удаление части желудка, где происходит непосредственное развитие онкологического процесса.
При проведении частичной ампутации оставшиеся отделы сшиваются и соединяются с кишечником. Сохраняется частичная функциональность желудка, что позволяет обеспечить пациенту возможность полного восстановления нормального образа жизни после операции.
При тотальной ампутации желудка производится формирование культи из тканей кишечника, принимающей на себя функции желудка. Функционал крайне ограничен. Желудочный сок вырабатываться не будет. Поэтому система пищеварения представлена в усечённом варианте.
Существует вариант резекции с применением специального оборудования – эндоскопа. Такой вид называется эндоскопической резекцией.
Гастрэктомия
Данный вид оперативного вмешательства представляет собой соединение пищевода и двенадцатиперстной кишки через тонкий кишечник. Продолжительность операции длительна по времени (не менее 5 часов) и чревата осложнениями.
После операции пациента держат в стационаре в течение 2-3 недель, после чего его допустимо выписать под диспансерное наблюдение. В течение первых 24-48 часов пациента не кормят перорально. Внутривенно вводится поддерживающий раствор.
Если место соединения пищевода и прямой кишки недостаточно хорошо закреплено, присутствует вероятность осложнений, приводящих к смерти пациента. Чтобы убедиться в крепости соединения, перед первым приёмом питьевой воды проводится рентгеновское исследование. В течение первого месяца после проведённой гастрэктомии вероятны болевые ощущения и сложности при употреблении пищевых продуктов.
К сожалению, устранить эти негативные последствия невозможно. По истечении месяца после удаления желудка организм максимально восстановит функции по перевариванию пищи с учётом новых обстоятельств.
Лимфодиссекция
При лимфодиссекции происходит ампутация не только части желудка, поражённого опухолью, но и ближайшие лимфатические узлы, если при визуальном осмотре в них обнаружены следы жизнедеятельности опухолевых клеток (метастазы).
Во время операции хирург определяет пострадавшие лимфатические узлы с помощью визуального осмотра. Благодаря их иссечению значительно снижается риск распространения онкологических очагов.
Распространение метастазов в лимфоузлы
Подготовительный этап к проведению операции
Подготовка пациента к проведению оперативного вмешательства – залог успешного выполнения процедуры по удалению пострадавшего от рака органа. Процесс подготовки может занять до месяца.
Пациент обязан строго соблюдать предписания врачей относительно диеты в подготовительный период. Обязателен отказ от употребления алкоголя и табака. Запрещено употребление тяжёлой, острой пищи.
Больной проходит исследования с целью определить состояние здоровья, стадию развития онкологической патологии.
На анализ берут биоматериалы крови, мочи и кала. Кровь проверяется в двух анализах – общий клинический и биохимический. Дополнительно проводится проверка на наличие соответствующих онкомаркеров. Моча проходит клинический анализ, кал проверяют на присутствие скрытой крови.
Проводится электрокардиография сердечных показателей. Грудная клетка подвергается рентгенологическому исследованию в двух проекциях.
Для выявления точного места локализации новообразования производятся следующие исследования:
- Ультразвуковое исследование брюшной полости (кишечника, селезёнки, органов малого таза).
- Компьютерная томография.
- Магнитно-резонансная томография.
Пищевод и двенадцатиперстная кишка исследуются при помощи гастроскопа. Производится визуальный осмотр и сбор материала для гистологического исследования. Эта процедура носит название гастроскопия.
Процедура гастроскопии
Производится визуальное исследование толстого кишечника с применением эндоскопа (колоноскопия).
При наличии показаний производится диагностическая операция с целью проверить наличие метастазов и иных поражений органов брюшной полости, которые являются противопоказанием к проведению оперативного вмешательства для лечения онкологии.
Для устранения риска развития инфекционных патологий назначается курс антибиотиков. Пациент проходит дополнительные консультации и исследования в соответствии с показаниями. Подбираются соответствующий режим питания и дозировка разового приёма пищи. Питание должно осуществляться 5-6 раз в течения дня небольшими порциями.
За 10 дней до оперативного вмешательства отменяется приём антикоагулянтов и противовоспалительных препаратов нестероидного вида.
Важным моментом подготовки является психологическая поддержка родных и друзей пациента. Положительные эмоции в борьбе с такой болезнью, как онкология, играют заметную роль.
Лучевая (радиотерапия) и химиотерапия назначаются до операции с целью облегчить проведение самой процедуры. В день самой операции проводится промывание желудка и внутривенное вливание плазмы крови в случае выявления анемии у пациента.
Вероятные осложнения после удаления желудка
Оперативное вмешательство такого рода, как удаление важного органа пищеварительной системы, сложно и опасно. Вероятны многочисленные осложнения после удаления желудка. К таковым относятся:
- появление внутреннего кровотечения;
- резкая потеря в весе тела;
- вероятность рецидива злокачественной опухоли;
- воспалительные процессы в брюшине;
- падение уровня железа в крови (анемия);
- воспалительный процесс на слизистой оболочке пищевода;
- ускорение процесса вывода каловых масс из организма без переваривания поступившей пищи.
Остаётся вероятность появления и других осложнений, исходя из индивидуальных особенностей организма пациента, перенёсшего операцию по удалению желудка.
Реабилитация
Реабилитация после рака займет длительный период времени. Но точный срок восстановления зависит от многих факторов, большая часть которых относится к особенностям строения организма больного. Сюда относят:
- возраст пациента;
- пол пациента;
- наличие сопутствующих патологических процессов в организме;
- психологическое состояние больного.
Непосредственное влияние оказывает и вид проведённой операции, качество оказания медицинской услуги, объём удалённого желудка.
В среднем реабилитационный период составляет не менее трёх месяцев. Но часто достигает временного интервала в 2 года. В течение этого периода необходимо строго соблюдать все предписания лечащего врача относительно приёма медикаментозных препаратов, соблюдение диеты.
Физические нагрузки под запретом, особенно тяжёлые виды спорта. Необходимо следить за температурным режимом и не допускать перегрева или переохлаждения организма.
Выживаемость
Выживаемость после проведённой операции зависит от того, насколько вовремя оперативное вмешательство было произведено. При осуществлении процедуры на первой и второй стадиях развития патологии смертность в течение 5 лет не превышает 20%.
Также выполнение операции на первых стадиях снижает риск повторного возникновения онкологии. Наличие своевременного вмешательства напрямую влияет на продолжительность жизни после проведённой операции. Упомянутый фактор гарантирует благоприятный прогноз на полное избавление от патологии. Большинство больных живут долго и пересекают рубеж 10-летней выживаемости.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди: