Парижская классификация ранний рака желудка

Классификация
капиллярного рельефа (Capillary
pattern
– CP)
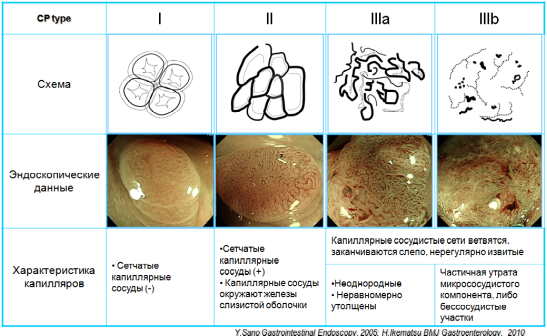
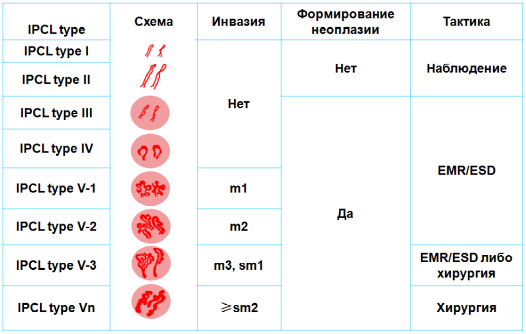
Классификация
интраэпителиальных папиллярных
капиллярных петель IPCL (J.Cohen, 2007)
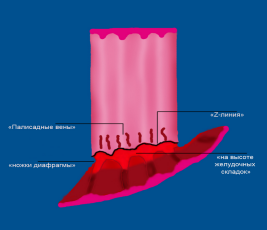
Схематическое
изображение анатомии дистального отдела
пищевода

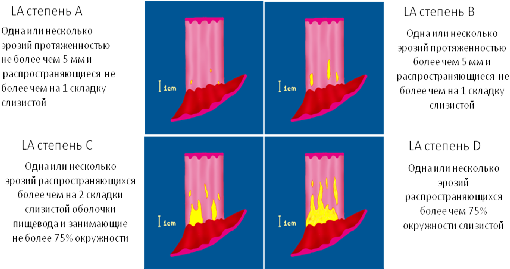
Лос-Aнжелесская
классификация эрозивных эзофагитов
(1994 год)
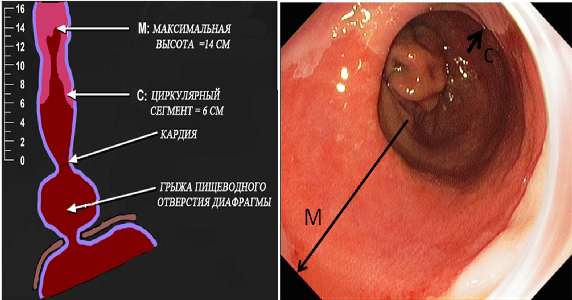
ПРАЖСКИЕ
С&M
КРИТЕРИИ ПРИ ПИЩЕВОДЕ БАРРЕТА 2004 год
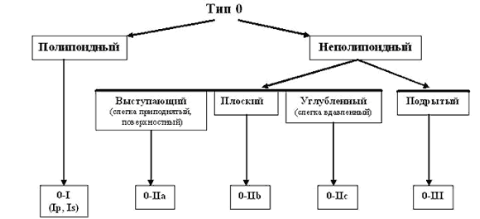
Парижская
эндоскопическая классификация опухолевых
поражений пищевода, желудка и толстой
кишки (2002).
The
Paris endoscopic classification of superficial neoplastic lesions:
esophagus, stomach and colon
Gastrointestinal
Endoscopy, Volume 58, No 6 (Suppl.), 2003
тип
– поверхностные
полипоидные или неполипоидный опухоли;
тип 1
– полипоидные опухоли, обычно на широком
основании;
тип
2 – язвенные
опухоли с четко отграниченными и
поднятыми краями;
тип
3 –
инфильтративно–язвенные опухоли без
четких границ;
тип
4
–диффузно–инфильтративные (неизъязвленные)
опухоли;
тип
5 –
неклассифицируемые (неподдающиеся
классификации) запущенные опухоли.
Эндоскопические
классификации варикозно-расширенных
вен пищевода
1.
N.Soehendra,
K.
Binmoeller
(1997)
ВРВ
пищевода:
1
степень – диаметр вен не превышает 5
мм, вытянутые, располагаются только в
нижней трети пищевода;
2
степень – диаметр вен 5 -10 мм, извитые,
распространяются в средней трети
пищевода;
3
степень – размер вен более 10 мм,
напряженные с тонкой стенкой, расположены
вплотную друг к другу, на поверхности
вен «красные маркеры».
ВРВ
желудка:
1
степень – диаметр вен не более 5 мм, едва
различимы над слизистой желудка;
2
степень – вены размером 5-10 мм,
солитарно-полипоидного характера;
3
степень – вены диаметром более 10 мм,
представляют обширный конгломерат
узлов.
2.
К.-J.
Paquet
(1983) (рис.1А):
I
– единичные эктазии вен (рентгенологически
не определяются).
II
– единичные хорошо отграниченные стволы
вен, которые при попытке инсуффляции
остаются отчётливо выраженными, нет
истончения эпителия на венах.
III
— отчётливое сужение просвета пищевода
стволами ВРВ, расположенными в нижней
и средней трети пищевода, которые
частично уменьшаются только при сильной
инсуффляции воздуха. На верхушках ВРВ
единичные красные маркеры или ангиэктазии.
IV
— просвет пищевода полностью выполнен
варикозными узлами даже при максимальной
инсуффляции. Эпителий над венами
истончён. На верхушках вариксов
определяются эрозии и/или ангиэктазии.
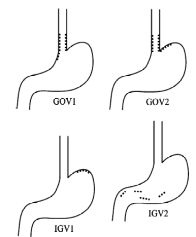
3.
Sarin
(1992)
в
зависимости от локализации выделил 4
подтипа желудочных вариксов, отмечая
их более частое появление при
нецирротической портальной гипертензии
и внепеченочной обструкции портальной
вены (рис 1Б.):
GOV1
– гастроэзофагеальные вариксы,
соединенные с пищеводными венами вдоль
малой кривизны желудка;
GOV2
– гастроэзофагеальные вариксы,
соединенные с пищеводными венами вдоль
свода желудка.
IGV1
– изолированные желудочные вариксы
свода желудка.
IGV2
– изолированные вариксы в теле или
антральном отделе желудка или в первой
части 12–перстной кишки.
5.
Японское
научное общество по изучению портальной
гипертензии в 1991 году опубликовало
основные правила для описания и
регистрации эндоскопических признаков
ВРВ пищевода и желудка. Правила содержат
6 основных критериев, согласно которым
оценивается состояние варикозно
измененных вен как до, так и после
лечебных воздействий.
Локализация
– эта характеристика требует определения
распространённости ВРВ вдоль пищевода,
а при выявлении вен желудка, оценивается
их расположение относительно кардии:
нижняя
треть пищевода –Li;средняя
треть – Lm;верхняя
треть – Ls;ВРВ
желудка – Lg:
—
располагающиеся в кардии – Lg-c;
—
отдалённые от кардии – Lg-f.
2.
Форма
(вид и размер) – данным показателем
оценивается внешний вид и размер ВРВ,
при этом обнаруживают:
отсутствие
вен – F0;короткие,
малого калибра ВРВ – F1;умеренно
расширенные, извитые ВРВ – F2;значительно
расширенные, узловатые ВРВ – F3.
3.
Цвет
– этой категорией отражается толщина
стенки ВРВ. Синий цвет указывает на
значительное её истончение
белый
– Cw;cиний
– Cb.
4.
“Красные
маркёры” стенки
– среди них выделяют:
пятна
“красной вишни”- CRS;гематоцистные
пятна – HCS;телеангиэктазии
– TE.
5.
Признаки кровотечения – при остром
кровотечении требуется установить его
интенсивность, а в случае гемостаза
оценить характер тромба.
—
в период кровотечения:
—
струйное;
—
в виде просачивания;
—
после достижения гемостаза:
—
красный тромб;
— белый тромб.
6.
Изменения слизистой пищевода – они
могут быть как проявлением рефлюксной
болезни, нередко сочетающейся с
заболеваниями, протекающими с синдромом
портальной гипертензии, так и следствием
лечебного эндоскопического воздействия.
эрозия
– E;язва
– U;рубец
– S.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #


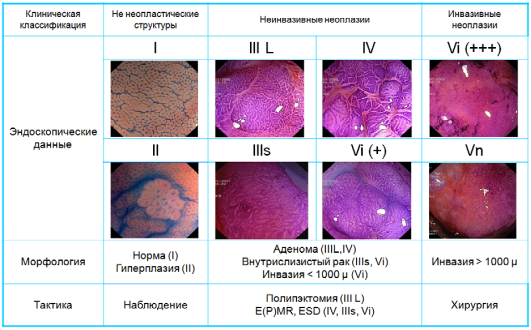
Тип I
Выступающий тип

Тип II
Поверхностный тип

А. Поверхностный
приподнятый


В. Поверхностный
плоский




С. Поверхностный
углубленный

Тип III
Подрытый









Эндоскопическая
дифференциальная диагностика.
Трудности возникают при дифференциальной
диагностике ранних форм РЖ и
доброкачественных новообразований –
полипов.
Внешне они очень похожи и определить
характер полипоидного образования без
гистологического исследования невозможно.
Но дело в том, что биопсия, выплненная
с поверхности полипа не отражает
изменений в его теле и основании. Поэтому
все полипоидные (полиповидные) образования
подлежат удалению с помощью
электрокоагуляционной петли и тока
высокой частоты и тотальному
морфологическому изучению. При
множественных полипах электроэксцизию
начинают с наиболее крупных, в которых
вероятность развития рака максимальна.
Ещё сложнее
дифференциальная диагностика изъязвленного
рака и язвы
желудка.
Сказать «на глаз» в каком участке стенки
язвы могут быть злокачественные клетки
практически невозможно. Поэтому
рекомендуют выполнять множественные
биопсии из разных участков по краю язвы
(биопсия в области дна язвы малоинформативна
из-за наличия некротического детрита
и опасна из-за возможности кровотечения).
Таких биопсий нужно выполнить не менее
пяти. Только тогда можно быть более или
менее уверенным в доброкачественности
изязвления. Существует четкая
закономерность: чем выше по желудку
находится язва, тем больше вероятность
её злокачественного характера. Даже
рубец на месте зажившей язвы желудка
не исключает наличия рака и требует
обязательной биопсии, ибо первично
изъязвленные раки могут рубцеваться
под влиянием противоязвенной терапии.
Весьма непросто
отличить диффузно растущий рак антрального
отдела от т.н. ригидного
антрального гастрита.
В обоих случаях обращает на себя внимание
отсутствие перистальтики в антральном
отделе желудка, изменение его складчатости,
инфильтративное утолщение слизистой.
Решают вопрос повторные биопсии,
выполненные ступенчатым образом (каждая
последующая биопсия выполняется в месте
предыдущей, углубляясь в толщу стенки
желудка). Такие биопсии позволяют
верифицировать рак даже в случае его
подслизистого роста.
Дополнительные
методы исследования.
После установления диагноза РЖ необходимо
определить его операбельность. Истинные
границы опухоли и распространение рака
по лимфатической системе не всегда
возможно уточнить не только в
предоперационном периоде, но даже во
время операции. Ответ на этот вопрос
может дать только морфолог, производящий
исследование резецированного желудка,
удаленных вместе с ним тканей и
регионарных лимфатических узлов. Однако
и до операции можно выявить признаки
неоперабельности. При общеклиническом
обследовании
можно выявить отдаленные метастазы
(метастаз Вирхова, метастаз в область
пупка, метастаз Шницлера, метастаз
Крукенберга у женщин, увеличенную печень
с плотным бугристым краем, асцит,
плевральный выпот. Признаки метастазов
в печень и поджелудочную железу помогает
выявить ультразвуковое
сканирование и КТ,
а для определения перехода РЖ на соседние
органы и распространение его по брюшине
можно перед операцей выполнить
диагностическую
лапароскопию.
Лечение РЖ.
В настоящее время основным методом
лечения РЖ, как раннего, так и далеко
зашедшего, является хирургическая
операция.
Первым успешную
резекцию желудка по поводу рака выполнил
профессор хирургической клиники в Вене
Теодор Бильрот в 1881 году (рис 18). С этой
даты началось быстрое развитие желудочной
хирургии. Бильрот предложил два способа
резекции желудка: наложение анастомоза
между остающимися отделами конец-в-конец
(Бильрот I)
и ушивание культей желудка и
двенадцатиперстной кишки с наложением
анастомоза между желудком и начальной
петлей тощей кишки бок-в-бок (Бильрот
II).
Дальнейшие модификации этих операций
связаны с именами таких известных
хирургов первой половины 20 века, как
Кохер, Гофмейстер, Финстерер, Ру, Хаберер
и др.
Вопрос об объеме
операции при РЖ до настоящего времени
однозначно не решен (рис 19). По мнению
одних хирургов, методом выбора является
субтотальная резекция желудка с
обязательным удалением регионарных
лимфатических узлов единым блоком.
Другие считают возможным выполнение
экономных резекций, но с лимфоаденодиссекцией
в максимальном объеме, третьи допускают
возможность обширных комбинированных
операций с удалением соседних с желудком
органов при распространении на них
рака. Трудность в выработке рациональной
хирургической тактики у каждого
конкретного больного заключаются в
том, что до настоящего времени нет
точного метода интраоперационного
определения распространенности опухоли
как по желудку, так и по лимфатическим
путям. Экспресс-методы исследования
биоптатов, взятых во время операции, не
всегда точны и значительно увеличивают
продолжительность операции. Размеры
опухоли не могут считаться критерием,
так как даже при малых раках встречаются
не только регионарные, но и отдалённые
метастазы.
Наиболее часто
выполняемыми при РЖ радикальными
операциями являются: 1) Дистальная
субтотальная резекция желудка
– удаление большей части желудка с
большим и малым сальником и оставлением
кардиальной части и купола с небольшим
участком большой кривизны (при раке
выходного отдела желудка); анастомоз
между культей желудка и двенадцатиперстной
кишкой;
2) Проксимальная
субтотальная резекция желудка
– то же, но с оставлением части
пилорического отдела (при раке
проксимальной части желудка); анастомоз
между пищеводом и культей желудка);
3) Тотальная
гастрэктомия
– удаление всего желудка с большим и
малым сальником, желудочными связками
и прилегающими к желудку участками
двенадцатиперстной кишки и пищевода,
(при поражении большей части желудка и
высокой локализации рака, а так же при
диффузном росте раковых опухолей);
эзофагоеюноанастомоз.
При любой из
этих операций с онкологической точки
зрения целесообразно выполнение
лимфоаденодиссекции
– максимально
возможное удаление регионарных
лимфатических узлов по ходу левой
желудочной, селезёночной, кишечной
(a.celiaca)
и общей печёночной артерий
Объем операции
при ранних РЖ определяется в зависимости
от локализации опухоли и опыта хирурга.
Противопоказаниями
к радикальной операции при РЖ по мнению
большинства хирургов и онкологов,
являются: чрезмерное распространение
опухоли за пределами желудка (переход
на поджелудочную железу, печень,
забрюшинную клетчатку), метастазы в
отдаленные органы, диссеминация рака
по брюшине или тяжелое состояние
больного, вызванное серьёзными
сопутствующими заболеваниями или
преклонным возрастом. В этих случаях
возможно выполнение той или иной
паллиативной операции, направленной
на сохранение нарушенного пассажа пищи
по пораженному желудку или предупреждении
осложнений: кровотечения, перфорации,
непроходимости.
Самым частым
паллиативным вмешательством является
гастроэнтеростомия,
предпринимаемая для ликвидации или
предупреждения непроходимости выходного
отдела желудка. При сужении или закрытии
входа в желудок накладывают
эзофагогастростомию
или вводят трубку для питания
непосредственно в желудок через
гастростому.
При тотальном поражении желудка
приходится прибегать к еюностомии.
При кровотечении из распадающейся
опухоли или опастности перфорации
возможно выполнение паллиативной
резекции желудка.
В послеоперационном
периоде у больных РЖ возможно проведение
химиотерапии
современными противоопухолевыми
препаратами, что наиболее показано при
низкодифференцированных опухолях.
Отдаленные
результаты хирургического лечения.
По данным
G.Davis
(1983), подвергшего анализу результаты
нескольких крупных серий наблюдений
в США, хирургическое вмешательство
выполняется у 86 из каждых 100 человек с
диагностированным РЖ (рис 20). Из них у
41 пациента операция оказывается
паллиативной или носит диагностический
характер. 10 человек из этой группы
погибают в послеоперационном периоде
от различных осложнений. Из 31 больного,
перенесшего вмешательство, через 5 лет
в живых не остается никого. У 45 из 86
оперированных больных (чуть больше
половины) удается выполнить радикальную
операцию. Из них 5 человек погибают от
послеоперационных осложнений. Из 40
пациентов, перенесших операцию, спустя
пять лет продолжают жить 10 человек.
Таким образом, 5-летняя выживаемость
при хирургическом лечении РЖ составляет
лишь 10%.
А каковы результаты
хирургического лечения раннего РЖ? В
1976 году Т.Takasugi
с оавт. были опубликованы результаты
хирургического лечения 732 больных с
гистологически доказанным ранним раком
желудка (рис 21). В течение 5 лет после
операции прожили 715 человек (97,7%), а
спустя 10 и 15 лет — 705 человек (96.4%). Несколько
менее впечатляющими, но всё же очень
высокими являются результаты другой
серии наблюдений японских авторов
(T.Iwanaga
et
al.,1979):
из 510 оперированных больных ранним РЖ
5-летний барьер выживаемости преодолели
457 человек (89,6%), а 10-летний – 370 больных
(72,6%).
Таким образом,
раннее выявление опухоли служит ключом
к улучшению результатов лечения РЖ.
Методы раннего
выявления РЖ.
Опыт последних десятилетий показывает,
что наиболее эффективным средством
диагностики РЖ на начальных стадиях
является выявление среди условно
здорового населения «групп риска» по
РЖ (путём анкетирования и опроса) и
обследование их с помощью современных
рентгенологических и эндоскопических
методов, а так же активное выявление,
обследование и лечение больных
предраковыми заболеваниями желудка
(рис 22). Существенную помощь в раннем
выявлении онкологических заболеваний
могли бы оказать т.н. скрининговые методы
исследования (screening
– просеивание, отсев, отбор), которые
можно выполнять массово, среди широких
контингентов населения или в больших
по объему группах риска. В настоящее
время к скрининговым методикам по РЖ
можно отнести только крупнокадровую
флюорографию желудка, да и то лишь
условно, в связи с высокой её стоимостью.
В последние
десятилетия активно ведутся поиски
специфических раковых маркеров. Маркеры
– гликопротеиды с антигенными свойствами
часто обнаруживаются в тканях и жидкостях
плодов, но потом они исчезают и появляются
лишь при развитии опухолевых процессов.
Они являются признаком дедифференциации
тканей с возвратом к эмбриональному
состоянию, что особенно характерно при
низкодифференцированных опухолях.
Онкофетальные антигены могут служить
признаком появления злокачественной
опухоли и ранних предраковых изменений.
К ним относится
карциноэмбриональный
антиген (КЭА).
Его обнаруживают в крови у 4-5% и в
желудочном соке у 50% больных ранним
раком желудка. Однако его нельзя считать
строго специфическим для РЖ, т.к. он
определяется и у больных раком толстой
кишки. Для массового скрининга используют
фетальный
сульфогликопротеиновый антиген (ФСА).
При РЖ его обнаруживают в 90-95% наблюдений.
При обследовании группы в 30.000 человек
в США у 22 из 23 с положительным ФСА в
содержимом желудка был обнаружен рак,
а у 8 с отрицательной реакцией в дальнейшем
так же была выявлена карцинома желудка.
Чувствительность метода составила 92%,
а специфичность – 73%. Трудности скрининга
заключались в необходимости получения
у обследуемых порции желудочного сока,
для чего требовалось зондирование
желудка.
К сожалению в
нашей стране широкомасштабные
профилактические обследования на
предмет выявления раннего рака в
настоящее время вряд ли возможны из-за
определенных социальных и экономических
причин.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Классификация рака желудка. Ранний рак желудка.
В 1926 году Borrmann предложил макроскопическую классификацию рака желудка. Она очень удобна, поэтому до сих пор используется не только патологоанатомами, но и рентгенологами, гастроэнтерологами и хирургами. Классификация Borrmann следующая:
I. Полиповидный рак. II. Язвенный рак с приподнятыми краями. III. Язвенный рак с частичной или полной инфильтрацией его краев. IV. Частичный или полный инфильтративный рак (linitis plastica).
Японские ученые рассматривают классификацию рака желудка Borrmann как передовую. В последние годы к данной классификации добавлено 5 новых групп, отражающих ранние стадии рака.
Можно сделать заключение, что I и II группы классификации Borrmann соответствуют микроскопическому кишечному типу, согласно классификации Lauren, и экспансивному типу — согласно классификации Ming. Вместе с тем, группы III и IV отражают диффузный тип по классификации Lauren и инфильтративный тип — по классификации Ming.
Как будет показано далее, хотя гистологическая характеристика рака желудка важна для установления прогноза заболевания, она не входит в классификацию по TNM. В 1965 г. Lauren предложил гистологическую классификацию, выделив даа типа рака желудка — (а) кишечный и (b) диффузный. Кишечный тип формируется железистыми структурами, имеет сходство с раком толстой кишки и обычно сосуществует с метаплазией слизистой оболочки желудка по кишечному типу. Опухоли кишечного типа имеют лучший прогноз, чем опухоли диффузного типа. Они чаще встречаются в странах с повышенной заболеваемостью раком желудка — Японии, Чили, Коста-Рике и Колумбии.
В странах, где заболеваемость раком желудка в последние годы снизилась, например, в США и некоторых европейских странах, наблюдается уменьшение количества опухолей кишечного типа. Диффузный тип по классификации Lauren образуется отдельными клетками или группами клеток с незначительной воспалительной реакцией без формирования железистых структур. Рак диффузного типа является более злокачественным, может распространяться на весь желудок, как при linitis plastica (скирр).
При этом типе рака, отличие от кишечного типа, значительно чаще поражаются лимфатические узлы желудка.
В 1977 г. Ming также предложил гистологическую классификацию рака желудка, несколько похожую на классификацию Lauren. Ming разделил раковые опухоли на даа типа: (а) экспансивный и (b) инфильтративный. Экспансивный рак образуется связанными между собой группами клеток, вызывающими образование узлов, которые смещают нормальные структуры. Рак инфильтративного типа характеризуется наличием очагов клеточной инфильтрации, плохо связанных между собой. Кишечный тип по классификации Lauren похож на экспансивный классификации Ming, и оба типа имеют лучший прогноз, чем диффузный или инфильтративный типы.
Кишечный и экспансивный типы в основном образуют полиповидную опухоль с изъязвлением или без такового (группы I и II по макроскопической классификации Borrmann). Диффузный и инфильтративный типы пенетрпруют стенку желудка, образуя ограниченные или распространенные инфильтраты, которые соответствуют группам III и IV макроскопической классификации Borrmann.
В 1962 г. Японское обшество эндоскопистов и гастроэнтерологов разработало и предложило макроскопическую классификацию раннего рака желудка. Возникновение этой классификации обусловлено необходимостью диагностики рака желудка на ранних стадиях для более эффективного использования хирургического лечения.
Общество эндоскопистов определило ранний рак как поражение, ограниченное слизистой оболочкой и подслизистым слоем, без его дальнейшего распространения и без вовлечения в процесс лимфатических узлов. В Японии ранний рак желудка диагностируется в 30—40% случаев. В странах Запада ранний рак желудка выявляется в 10% случаев, а то и реже. В недавней публикации Wanebo и соавт., в которой представлен анализ 19000 случаев рака желудка по данным различных медипинских учреждений. ранний рак был диагностирован в 17% случаев, что является необычайно высоким показателем для Европы и США.
В Японии у больных, оперированных по поводу ранних форм рака, 5-летняя выживаемость составляет 80-90%. В Европе и США 5-летняя выживаемость составляет 50—60%. В Японии частота выявления пораженных лимфатических узлов при раннем раке желудка составляет от 5 до 20%. Чаще вовлекаются лимфатические узлы группы N, хотя встречается и поражение лимфатических узлов группы N2.
Ранний рак желудка обычно бывает бессимптомным. Когда появляются симптомы, они легкие и неспецифичные, за исключением язвенного рака, при котором возможны периодические боли или кровотечения. Некоторые авторы считают, что термин «ранний рак желудка» не является правильным, и что более правильно называть эту опухоль «поверхностным раком». В 1939 году Rene Gutmann, Bertrand и Peristiany в своей книге «Le Cancer de L’estomac au Debut» постоянно использовали термин «поверхностный рак», хотя вто время единственным доступным методом диагностики было рентгенологическое исследование. Stout из США при описании этого типа рака также использовал термин «поверхностный рак».
— Также рекомендуем «Международная классификация рака желудка. Лимфатическая система желудка.»
Оглавление темы «Лечение рака желудка. Операции при раке желудка.»:
1. Классификация рака желудка. Ранний рак желудка.
2. Международная классификация рака желудка. Лимфатическая система желудка.
3. Объем резекции желудка. Стадия опухоли желудка и объем резекции.
4. Распространенность рака желудка. Определение объема поражения при раке желудка.
5. Радикальная субтотальная резекция желудка. Техника субтотальной резекции желудка.
6. Создание анастомоза при субтотальной резекции желудка. Методика анастомозирования культи желудка.
7. Тотальная радикальная гастрэктомия. Ключевые моменты тотальной гастрэктомии.
8. Восстановление пищеварительного тракта после гастрэктомии. Эзофагоеюностомия.
9. Эзофагоеюностомия по Roux-en-Yc использованием ручных швов. Техника эзофагоеюностомии после резекции желудка.
10. Терминолатеральный эзофагоеюноанастомоз. Техника наложения терминального эзофагоеюноанастомоза.


