Лучевая терапия при раке желудка с переходом в пищевод
Методы лечения рака пищевода и их эффективность
Общепризнано, что хирургическое лечение лучше всего подходит для лечения аденокарциномы пищевода (почти всегда это поражения нижней трети), в случае если повреждения операбельны. В большинстве других случаев, особенно для поражений в верхней трети и шейной части пищевода, лучшим выбором лечения является сочетание химиотерапии и лучевой терапии. Хирург или радиотерапевт должен определить тип лечения (радикальное или паллиативное) до начала местной терапии.
Радикальное лечение рака пищевода
При продумывании радикальной хирургической операции для пациентов, которые в целом подходят для нее и не имеют признаков отдаленного метастазирования, важно определить степень поражения до проведения окончательной резекции. Для этого рекомендуется пробная лапаротомия, ставшая обычной частью многих операций, когда восстановление достигается путем перемещения (транспозиции) ободочной кишки и создания тем самым жизнеспособного канала между глоткой и желудком.
Радикальное удаление пищевода, проведенное Черни (Czerny) впервые более 100 лет назад, проводится в настоящее время в одну стадию с желудочно-пищеводным анастомозом или перемещением (транспозицией) ободочной кишки. Раньше при проведении операций оставляли постоянную гастростому для обеспечения питания.
Только меньшая часть больных раком пищевода могут быть радикально оперированы, самое частое показание к такой операции — поражения средней или нижней трети пищевода, особенно если по гистологии это поражение представляет собой аденокарциному, при этом подходят больные без явных признаков наличия метастазов. До недавнего времени практически не было указаний на то, что предоперационная лучевая терапия или химиотерапия оказывает влияние на степень радикальности резекции, коэффициенты смертности при операции или суммарного выживания.
Но в недавнем крупномасштабном исследовании в Великобритании показано поразительное улучшение при применении предоперационного сочетания химиотерапии (цисплатином и фторурацилом) с лучевой терапией. Коэффициенты выживаемости за 2 года составили 43% и 34% (с использованием химиотерапии и без нее); медиана коэффициентов выживаемости (с применением химиотерапии) равнялась 16,8 месяца по сравнению с 13,3 месяца (без нее). Данные предыдущих исследований были неутешительны.

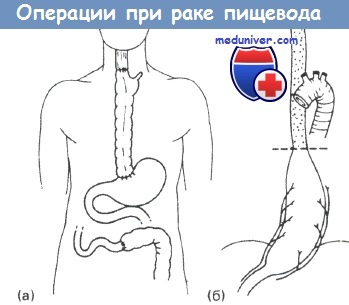
Операция при раке пищевода:
(а) полное удаление пищевода с замещением ободочной кишкой;
(б) мобилизация желудка и низведение в случае карциномы нижней трети пищевода.
Для больных карциномой верхней трети пищевода в качестве лечения обычно выбирают лучевую терапию, однако некоторые врачи склоняются в этом случае к хирургическому лечению. Рандомизированного сравнения этих типов лечения не проводилось. Сочетания химиорадиотерапии сейчас считаются гораздо более эффективными, чем только лучевая терапия.
Лучевая терапия (с сопутствующей химиотерапией или без нее) по сравнению с операцией обладает рядом преимуществ, в том числе более широкой применимостью (ведь большинство больных находятся в пожилом возрасте и плохо питаются), возможностью избежать ларингэктомии, а также значительным облегчением дисфагии для большинства пациентов, с излечиванием, как минимум, 10% пациентов из способных перенести высокие дозы: всего 60 Гр ежедневными порциями в течение 6 недель. К тому же хирургическое лечение характеризуется смертностью приблизительно на уровне 10% (рис. 14.6), оно в отличие от лучевой терапии не подходит для больных с региональным распространением болезни.
И действительно, в классическом обзоре приводится коэффициент смертности, равный 29% по больным во всем мире, получавшим лечение в 1970-е годы, правда, смертность при операциях снизилась с улучшением подбора больных, хирургической техники и поддерживающего лечения. Несмотря на плохие общие результаты, при операции есть преимущество — временное облегчение может быть очень хорошим, а также, как и при лучевой терапии, в некоторых случаях это может привести к излечиванию.
Верхнюю треть пищевода технически сложно подвергнуть облучению из-за длины области обработки и близости спинного мозга. Зоны облучения в идеальном случае должны простираться, как минимум, на 5 см выше и ниже от известных пределов распространения болезни, чтобы адекватно обработать возможное распространение поражения в подслизистом слое стенки. Как и при постперстневидных карциномах, здесь нередко требуется применение сложных технических приемов, с использованием переплетенных, заклиненных, наклонных, множественных полей облучения, часто с компенсаторами (трансформаторами).
Также необходимо тщательное планирование облучения на двух или трех уровнях, чтобы ткань цилиндрической формы получила одинаковую высокую дозу радиации, но при этом чтобы не произошло сверхоблучения прилегающего спинного мозга.
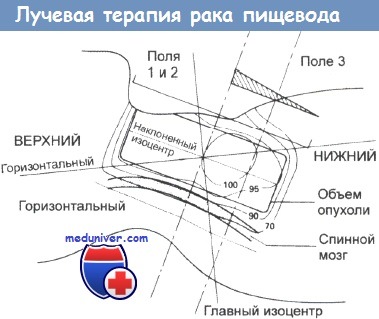
Радикальная лучевая терапия в случае карциномы шейного отдела пищевода.
В связи с несимметричной анатомией необходим план сложного многопольного облучения.
При опухолях средней трети пищевода в качестве основного лечения все больше и больше применяется лучевая терапия, иногда в сочетании с операцией. Некоторые хирурги полагают, что операция протекает легче, и долговременные ее результаты лучше при проведении предоперационного облучения. В техническом плане предоперационную и радикальную лучевую терапию опухолей средней трети пищевода проводить легче, чем опухолей верхней трети пищевода. Как и в отношении опухолей верхней трети пищевода, в настоящее время синхронная химио- и лучевая терапия широко применяются для средней трети пищевода; в нашем центре стандартом лечения является сейчас комбинация митомицина С и 5-ФУ.
В случае рака нижней трети пищевода часто предпочтительна операция, при этом реконструкция, обычно проводимая с мобилизованным желудком, менее сложна.
При раке нижней трети пищевода существует риск того, что желудок будет затронут опухолью и окажется не подходящим для проведения реконструкции. Для неоперабельных опухолей полезной может быть лучевая терапия.
Осложнения при лечении опухолей всех отделов могут быть непростыми или даже тяжелыми как в случае лучевой терапии, так и при операции. Радикальная лучевая терапия часто сопровождается радиационным воспалением пищевода (эзофагитом), требующим лечения щелочными или аспирин-содержащими суспензиями для местного воздействия на воспаленную слизистую пищевода.
Возможные более поздние осложнения включают радиационное повреждение спинного мозга и легких, что ведет к радиационному пульмониту и иногда одышке, кашлю и уменьшению дыхательной емкости, но в повседневной практике такие явления редки. Фиброз и рубцевание пищевода приводят к его стриктуре, из-за чего может потребоваться расширение для сохранения раскрытого состояния пищевода. Несмотря на вышеизложенные факты, большинство больных переносят такое лечение на удивление хорошо, даже при применении химиотерапии.
К хирургическим осложнениям относятся стриктура пищевода и несостоятельность анастомоза, в результате этого — медиастинит, пульмонит и сепсис, иногда приводящие к смерти больного.
У больных с дисплазией высокой степени в пищеводе Барретта многообещающим оказалось использование фотодинамической терапии. Пока еще данные собраны по небольшому числу больных, но такой способ лечения уже признан Национальным институтом клинического искусства (NICE) подходящим в некоторых случаях.
Паллиативное лечение рака пищевода
Паллиативное лечение при раке пищевода может быть очень полезным с применением Целестинского или другого постоянного протеза, лучевой терапии или лазерного лечения (а также их обоих), или иногда при обходной операции, без попытки удалить место первичной опухоли, но с созданием альтернативного канала. Для пациентов, которых нельзя подвергать радикальной операции и лучевой терапии, нужно всегда рассматривать возможность паллиативного лечения, особенно в случаях тяжелой дисфагии. Умеренные дозы облучения могут приводить к выраженным клиническиим улучшениям.
В опытных руках проведение Целестинской или растяжимой пищеводной трубки с металлической сеткой является относительно безопасной и эффективной процедурой, которую можно сочетать с лучевой терапией. Распространенные проблемы при введении трубки включают ее перемещение, желудочно-пищеводный свищ (иногда связанный с попаданием в легкие содержимого желудка), загрудинные боли и дискомфорт. Осложнения при паллиативном облучении минимальны, так как используются низкие дозы: обычно благотворно влияет лечение дозой 30 Гр на протяжении 2-недельного периода, если дисфагия не тотальная, и высокие дозы редко бывают нужны. В нашем центре широко используется внутрипищеводная брахитерапия, предлагающая простую и быструю альтернативу.
С начала 1990-х годов все больше возрастает роль лазерной терапии, которую можно применять в сочетании с лучевой терапией. При этом сразу восстанавливается способность глотать, иногда даже после первого сеанса, и процедуру легко можно повторять. Для больных с нерезектабельной опухолью такое лечение бывает наилучшим и наименее травматичным способом для временного облегчения.
Интересным дополнением к применению лазерной терапии стала идея фототерапии. При этом до начала лазерной терапии больной получает производные фталоциамина, которые захватываются преимущественно опухолью, что повышает избирательность лечения.
— Также рекомендуем «Прогноз рака пищевода»
Оглавление темы «Опухоли желудочно-кишечного тракта»:
- Рак пищевода — частота, причины, механизмы развития
- Клиника и диагностика рака пищевода
- Методы лечения рака пищевода и их эффективность
- Прогноз рака пищевода
- Рак желудка — частота, причины, механизмы развития
- Клиника и диагностика рака желудка
- Хирургическое лечение рака желудка — эффективность операций
- Лучевая и химиотерапия рака желудка — эффективность
- Прогноз рака желудка
- Гепатоцеллюлярный рак печени (гепатома) — частота, причины, механизмы развития
Лечение рака пищевода проводится хирургическим и лучевым методами, которые имеют свои показания. При опухоли нижнегрудного отдела применяется преимущественно хирургический метод. Лучевая терапия в таком случае проводится при противопоказаниях к хирургической операции. Операции при опухоли среднегрудного и особенно верхнегрудного отделов пищевода сложны и сопровождаются высоким риском, давая до 30% послеоперационной летальности. Поэтому шире стали применяться лучевые методы лечения. В случае отсутствия эффекта при облучении травматичные рискованные операции более оправданы. Лечение рака пищевода среднегрудного отдела, сопровождающееся высоким операционным риском, может быть проведено небольшому числу лиц с начальными стадиями заболевания. Лучевая терапия имеет более широкое применения, так как может применяться при отягчающих обстоятельствах у пожилых людей, и при сопутствующих заболеваниях. Хирургическое лечение рака пищевода обеспечивает примерно 10% больным выживание в течение 5 лет после операции. Лучевые методы лечения дают более низкий процент 5-летней выживаемости больных.
Хирургическое лечение рака пищевода
Операции при раке пищевода должны проводиться под интубационным наркозом. В ранних стадиях показано полное удаление опухоли с частью пищевода или грудного отдела пищевода. При опухолях брюшного и нижнегрудного отделов пищевода производится левосторонняя торакотомия с резекцией пищевода и пищеводно-желудочным анастомозом. При раке среднегрудного и верхнегрудного отделов показана операция Торека.
Резекция нижнегрудного отдела пищевода. Больного укладывают на правый бок и делают разрез в седьмом или шестом межреберье слева в зависимости от уровня поражения пищевода. После торакотомии по межреберью от паравертебральной линии до реберной дуги, а иногда при узкой грудной клетке с рассечением ее хрящевой части вскрывают средостение от дуги аорты до пищеводного отверстия в диафрагме. Выделяют пищевод и оценивают возможность резекции. Далее рассекают диафрагму от пищеводного отверстия до переднего угла раны грудной стенки и производят ревизию брюшной полости. При отсутствии метастазов в забрюшинных лимфоузлах, в области кардии, в печени и других отдаленных метастазов производят мобилизацию желудка. Рассекают все связки желудка, перевязывают левую желудочную артерию, как можно дальше от желудка перевязывают и пересекают короткие желудочные артерии и сохраняют правую желудочно-сальниковую артерию, которая в основном и осуществляет кровоснабжение перемещенного в грудную полость желудка. Желудок перемещают в плевральную полость. При резекции нижнегрудного отдела пищевода необходимо резецировать кардию и дно желудка с лимфатическими узлами, расположенными у кардии. Резецировать пищевод нужно как можно выше от опухоли, на расстоянии не менее 5 см выше края отчетливо прощупываемой экзофитной опухоли, а при инфильтративной форме целесообразно удалять весь грудной отдел пищевода и выполнять операцию Торека левосторонним доступом. При резекции пищевода нужно стараться сохранить основные стволы блуждающих нервов. Если опухоль распространяется по пищеводу высоко, пищевод выделяют из-за дуги аорты и перемещают его слева от нее. Анастомоз между пищеводом и желудком накладывают по одному из принятых методов. Желудок подшивают к краям отверстия в диафрагме, ушивают ее, в плевральную полость к анастомозу подводят дренаж. При раке среднегрудного отдела тоже можно применять одномоментную резекцию с наложением внутригрудного анастомоза, но эта операция показана крепким людям не в пожилом возрасте. Такая операция дает большую летальность, поэтому большинство хирургов отдают предпочтение двухмоментному вмешательству типа операции Торека.
Операция Торека при лечении рака пищевода
Эта операция производится в основном при лечении рака пищевода среднегрудного и верхнегрудного отдела, а также при инфильтративно растущей опухоли нижнегрудного отдела. Операция состоит из двух моментов — лапаротомии и торакотомии. Последовательность их может быть разная, но наиболее правильно начинать с лапаротомии, ревизии органов брюшной полости, исключения метастазов и наложения гастростомы. При выявлении отдаленных метастазов торакотомия и резекция пищевода становятся бессмысленными. После лапаротомии больного укладывают на левый бок. Торакотомию производят в седьмом или шестом межреберье оправа. Рассекают средостение и выделяют пищевод с опухолью. Пищевод резецируют на всем протяжении в грудной полости и концы его ушивают. Рану грудной стенки ушивают и вводят дренаж. Больного повертывают на спину, делают разрез на шее параллельно и впереди кивательной мышцы, выделяют пищевод, его конец вшивают в нижний угол рапы па шее и формируют пищеводный свищ. Больной питается через гастростому.
Пластику пищевода после его экстирпации по поводу рака следует делать в исключительных случаях в самых ранних стадиях заболевания через 2—3 недели, не выписывая больного из стационара. Большинство больных должны находиться 4—6 месяцев под наблюдением, чтобы исключить рецидивы и метастазы. Пластику пищевода можно производить больным, поправившимся после его экстирпации. Среди разных методов пластики при раке пищевода наибольшее распространение получили пластика толстой и тонкой кишкой. Наиболее выгодный путь проведения кишки — переднее средостение или предгрудинно под кожей.
Гастростома при лечении рака пищевода
В третьей и четвертой стадиях, когда радикальное лечение рака пищевода невозможно и у больного выражена дисфагия, истощение, показано наложение гастростомы для питания. Наибольшее распространение получили методы Топровера и Витцеля. Истощенному и ослабленному больному операцию лучше производить под местным обезболиванием. Делают разрез брюшной стенки по средней линии или параректальный слева. В рану выводят переднюю стенку желудка и на расстоянии 10 см от привратника, ближе к большой кривизне, формируют желудочный свищ. По способу Витцеля на стенку желудка укладывают желудочный зонд диаметром 1 см и обшивают его желудочной стенкой 6—7 узловыми швами, у нижнего последнего шва рассекают желудок и помещают в него конец зонда. Рану в стенке желудка ушивают двухрядными швами. Желудочную стенку у зонда подшивают к париетальной брюшине н ране и зашивают брюшную стенку. По методу Топровера на передней стенке желудка накладывают два, а иногда три кисетных шва на протяжении 2 см один от другого. Через разрез в центре внутреннего кисета в желудок вводят зонд и оба кисетных шва затягивают. Желудочный зонд на протяжении 4 см оказывается окутанным желудком.
Лучевая терапия рака пищевода
Лучевая терапия в настоящее время является методом выбора лечения рака пищевода при опухоли в верхней и средней третях и может быть проведена у неоперабельных больных с опухолью нижней трети.
Лучшие результаты достигаются при облучении опухоли среднегрудного отдела пищевода. Длительность жизни больных свыше 5 лет составляет 2,5—6%. При выборе метода облучения учитываются локализация процесса, ее протяженность, характер роста опухоли и общее состояние. Существующие методы лучевого лечения рака пищевода можно делят на две группы:наружное облучение и сочетанная лучевая терапия. Наружное облучение проводится в статическом или ротационном режиме. Последний имеет ряд преимуществ. При статическом облучении в качестве источника излучения используются гамма-установки «Луч», «Рокус», «Вольфрам», «Рад», линейные ускорители, бетатроны. Применяются обычно три поля: два паравертебральных и одно расположенное либо справа от грудины, либо переднее. Размеры полей определяются протяженностью поражения, причем они должны превышать рентгенологические границы опухоли, так как микроскопические диссеминаты новообразования распространяются выше и ниже визуально определяемого новообразования. Разовая очаговая доза 180—220 рад, суммарная — 6000—7000 рад. При подвижном облучении используются дистанционные гамма-установки «Рокус», «Вольфрам», иногда при сравнительно небольших поражениях проводится ортовольтная рентгенотерапия (напряжение трубки 250 кв). При подвижных методах облучения применяется секторное и собственно ротационное облучение. Очаговые дозы аналогичны таковым при статическом облучении. В случае сочетанной лучевой терапии наряду с наружным облучением производится внутриполостное введения радиоактивных препаратов непосредственно к опухоли пищевода. При этом очаговая доза суммируется от обоих использованных источников. В случае распространенных поражений можно в качестве паллиативного воздействия применять неравномерное облучение опухоли через свинцовую диафрагму.
Эти методы могут использоваться при первой, второй и третьей стадиях рака пищевода. Противопоказаниями считают перфорацию или преперфоративное состояние пищевода, метастазы и кахексию. На протяжении лучевого лечения рака пищевода больной получает высококалорийную жидкую пищу, витамины, медикаментозные препараты для профилактики эзофагита (рыбий жир, метациловая эмульсия). В случае развития эзофагита назначаются антибиотики. преднизолон, метациловая эмульсия, облепиховое масло. При необходимости делают перерыв в лечении рака пищевода. У больных со стойко выраженным стенозом пищевода за счет циркулярного роста опухоли перед лечением накладывают гастростому.
Симптоматическое лечение рака пищевода
В запущенных случаях неоперабельные больные раком пищевода 3 и 4 стадий или больные с наложенной гастростомой и неудаленной опухолью должны получать медикаментозное лечение рака пищевода. Для уменьшения сопутствующих воспалительных явлений вводят внутримышечно антибиотики. Для уменьшения гнилостных явлений в распадающейся опухоли назначают раствор перманганата калия цвета густого красного вина и соляную кислоту (по 1 чайной ложке 10% раствора на пол-стакана воды три раза в день). При возникновении болей следует давать наркотики вплоть до раствора морфина.
Тщательный уход необходим за гастростомой. Удалять желудочный зонд на длительное время не рекомендуют, так как это может повести к сужению свища и затруднить впоследствии введение в него трубки. Трубку следует удалять на время между кормлениями. Если желудочное содержимое подтекает, кожу вокруг свища следует смазывать индифферентной цинковой пастой и присыпать толстым слоем гипса. У некоторых больных с гастростомой возникает стойкий пилороспазм. В этих случаях может усилиться выделение желудочного содержимого, помимо свища. Введение 1 мл 0,1% атропина под кожу за 15 минут до приема пищи снимает пилороспазм. Желательно, чтобы больной пережевывал полноценную пищу и через воронку вводил ее в желудок.
Лечение рака пищевода после операции
После радикального хирургического лечения рака пищевода за оперированным человеком необходимо постоянно наблюдать не только как за онкологическим больным, но и как за больным, перенесшим тяжелое вмешательство, вызвавшее сложную перестройку в организме. После операции Торека у больного остаются два свища, за которыми нужны постоянный уход и периодическое наблюдение врача. После резекции пищевода с одномоментным наложением пищеводно-желудочного анастомоза у больного могут длительное время наблюдаться пилороспазм (при большой культе желудка) и ряд расстройств, связанных с пересечением блуждающих нервов (понос, запоры). В первые месяцы после операции с загрудинной или предгрудинной пластикой пищевода могут возникнуть затруднения в прохождении пищи по искусственному пищеводу. Таким больным необходимо принимать измельченную пищу и применять антиспастические средства (атропин).