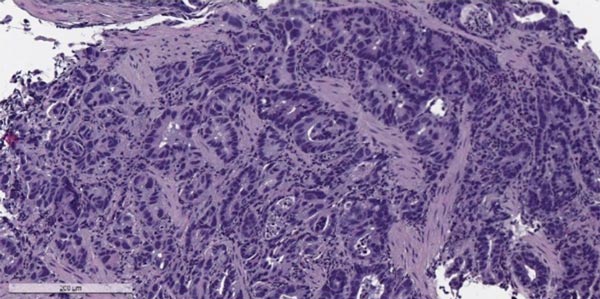
Что такое канцероматоз брюшины при раке желудка
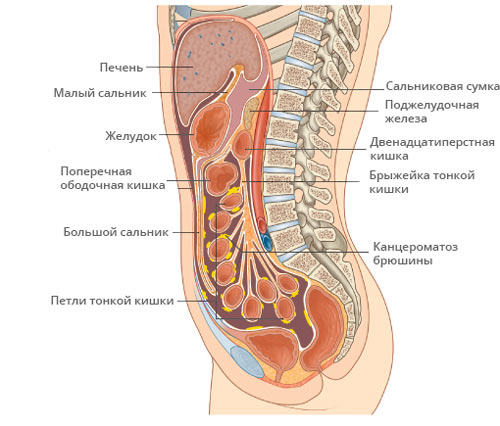
Канцероматоз брюшины – это вторичные метастазы, поражающие плевру с брюшиной. Вторичный очаг считается опасным проявлением злокачественной патологии, снижающим шанс на выздоровление больному. Канцероматоз не относят к отдельному заболеванию. Болезнь является серьезным последствием злокачественного новообразования в печени, поджелудочной железе либо матке. Проявляется выраженными признаками онкологической интоксикации, потерей веса и асцитом.
Характеристика заболевания
Канцероматоз брюшной полости – это вторичный онкологический очаг, возникающий как следствие злокачественного процесса органов брюшины. Вторичный злокачественный процесс провоцирует метастазирование опухоли, развивающейся в органе малого таза или другого участка. Первичный очаг патологии при разрастании выпускает множественные метастазы в отдаленные участки организма.
Лимфогенный перенос аномальных клеток провоцирует развитие канцероматоза в брюшной полости и плевры с выраженными признаками интоксикации. Новообразование прорастает в эпителиальный слой брюшины.
Раковый патоген проникает в серозный слой и закрепляется на стенках полости. Диссеминация сопровождается последующим формированием злокачественных узелков, напоминающих зерно. Узелки увеличиваются в размерах и постепенно сливаются, образуя опухоль большого размера.
Внутрибрюшная оболочка, пораженная злокачественным новообразованием, не способна выполнять экссудативную и резорбтивную функции. В связи с этим в полости накапливается жидкость, развивается асцит.
Чаще всего патология развивается у людей с наличием раковой опухоли органов пищеварительного тракта – желудка, толстой кишки, кишечника, поджелудочной железы. Кишечный и желудочный недуг развивается стремительно, вовлекая в процесс жизненно важные системы организма. Спровоцировать заболевание у женщин может рак матки или яичников.
Рак в яичнике
Поражение брюшной полости злокачественным процессом вторичного характера считается врачами неблагоприятным прогнозом течения. Болезнь плохо поддаётся терапии, что значительно усложняет жизнь пациента.
Карцинома в ткани лёгкого может спровоцировать вторичный очаг – канцероматоз лёгких. Встречаются единичные образования и множественные. Может формироваться в одном органе или сразу в обоих. Развитие протекает стремительно, что негативно сказывается на лечении и выздоровлении больного. Курсы химиотерапии останавливают увеличение опухоли на короткий период времени. Но после курса химиотерапии злокачественная клетка увеличивается в размерах ещё быстрее.
Заболевание встречается у 35% больных раком. Из этого количества у 40% первичный очаг присутствовал в органах пищеварительного тракта – желудка и поджелудочной железы. Но в медицинской практике есть примеры развития патологии из-за злокачественного процесса совершенно другого участка.
Код по МКБ-10 болезнь имеет С78.6 «Вторичное злокачественное новообразование брюшины и забрюшинного пространства. Злокачественный асцит».
Причины развития заболевания
Главной причиной развития канцероматоза считается первичный очаг злокачественного процесса. Раковая опухоль способна формировать метастазные ростки, которые проникают в ближайшие и отдалённые участки человеческого тела. Происходит это обычно на последней стадии болезни.
Распространение метастазов по организму происходит:
- С кровью либо лимфой.
- Первичный раковый очаг проникает в брюшную полость с последующим закреплением на стенках полости.
- После хирургического удаления первой раковой опухоли.
Внутрибрюшная полость совместно с серозной оболочкой имеет площадь равную 2 м2. Раковые ростки, проникая в данную область, способны сформироваться на огромном участке. Стенки и складки органа соприкасаются друг с другом, что увеличивает скорость развития патологии.
Стремительное формирование патологии провоцирует наличие сопутствующих факторов:
- Брюшная полость находится в опасной близости с органами желудочно-кишечного тракта.
- Внутренние складки постоянно соприкасаются друг с другом.
- Присутствует огромное количество кровеносных и лимфатических сосудов.
Формирование новообразований происходит на участках, не подверженных перистальтике кишечника. Размер первичного очага влияет на риск развития канцероматоза. Чем крупнее опухоль, тем быстрее и глубже происходит проникание метастазов в ткани брюшины.
Недифференцированный рак желудка всегда сопровождается формированием канцероматоза.
Признаки патологии
При раке первичного очага у больного присутствуют выраженные симптомы поражения конкретного органа. Но в некоторых ситуациях первые признаки опасного заболевания появляются при канцероматозе. Именно это позволяет заподозрить болезнь и поставить правильный диагноз.
Патология обнаруживает следующие признаки:
- Появляются приступообразные болевые спазмы в области живота – постоянные или периодические, с ноющим характером.
- У больного резко увеличивается живот при заметной общей потере веса – в брюшной полости происходит накопление жидкости.
- Наблюдаются приступы тошноты с ротными позывами.
- Болевые ощущения с коликами в области живота.
- Сбой в работе кишечника – длительный запор сменяет диарея.
- Отмечается выраженная мышечная слабость.
- Температура тела принимает термальные показатели на фоне яркого озноба.
- Усиленное потоотделение.
- Сильные головные боли и боли в мышцах.
Болезнь протекает на фоне стремительного ухудшения самочувствия больного. Человек доставляется по скорой в отделение хирургии или гастроэнтерологии. В стационаре после диагностирования ставится правильный и точный диагноз.
Классификация болезни
Канцероматоз брюшной полости классифицируют согласно расположению метастазных отростков и их количеству:
- Стадия Р1 характеризуется локальным расположением узла с одним злокачественным поражением.
- На стадии Р2 присутствует несколько раковых участков, подтверждающих болезнь. Между пораженными очагами выявляются участки здоровых тканей.
- Стадия Р3 соответствует 4 степени злокачественности. Выявляется множество злокачественных новообразований с признаками слияния в единый очаг.
Диагностика заболевания
Выявить болезнь без проведения обследования врач может у пациента онкологического центра с терапией раковой болезни. В остальных случаях требуется проведение расширенного обследования организма больного. Диагностика включает следующие процедуры:
- На УЗИ исследуют органы брюшины с малым тазом. Здесь же выявляется первичный очаг с признаками внутренних изменений в ткани органа. Врач определяет размер, форму и точную локализацию образования.
- При помощи компьютерной томографии изучают орган структурно. По КТ определяются все злокачественные участки, структура с локализацией.
- МРТ и МСКТ проводят с использованием контраста – это позволяет обнаружить отдаленные метастазы и степень поражения лимфатических узлов.
- Лапароскопия требуется для внутреннего изучения поражённых стенок брюшины и получения биологического образца. Образец исследуется в лаборатории биопсическим методом.
- Кровь изучается анализом ОТ-ПЦР. Врачи на основе данного анализа точно выясняет место первичного очага болезни.
Порой установить первичный участок развития патологии не удаётся. В остальных случаях методы диагностики дают подробную информацию о заболевании. Обследование позволяет установить степень поражения организма и назначить адекватное лечение.
Лечение заболевания
Процесс лечения пациента с диагнозом канцероматоза брюшины долгий и сложный. Результат может быть положительным и отрицательным. Неблагоприятный результат терапии случается чаще. Болезнь можно вылечить на ранних сроках развития и с применением новейших методик и аппаратуры в медицине. В основном применяется хирургическое иссечение злокачественного уплотнения с курсами химиотерапии. В последние годы разработано много новых эффективных методов борьбы с онкологией. Медицина не останавливается на этом и ищет новые варианты лечения.
Удаление опухоли хирургическим методом проводится с иссечением первичного очага, больных лимфатических узлов. Также возможно удаление органов, поражённых раковыми клетками – матки, желчного пузыря, участка толстого или тонкого кишечника и сигмовидной кишки.
Химиотерапия применяется как отдельное лечение, так и совместное с оперативным методом. В последнее время врачи предпочитают использовать перитонеальный гипертермический способ химиотерапии. Основа метода характеризуется вводом лекарственных препаратов в брюшную полость при помощи горячего воздуха. Иногда это делают сразу после операции или в период проведения операции.
Противоопухолевый раствор держат в полости 60 мин. Затем выводят. За это время происходит непрерывная циркуляция лечебного раствора, который уничтожает злокачественные патогены.
Выявление первичного очага патологии считается первоочередной задачей врачей. Обнаружение болезни с точными размерами и степенью развития позволяет провести полное лечение. Это повышает шанс пациента на выздоровление.
Локализация патологии в доступном и операбельном месте позволяет провести хирургическое иссечение узла. После операции назначаются курсы химиотерапии и облучения гамма-лучами. Дозировки и курсы подбираются индивидуально согласно физическим показателям и медицинским исследованиям пациента.
Параллельно основным способам лечения используется симптоматическое купирование негативных симптомов болезни:
- Делается специальный прокол для вывода лишней жидкости из брюшины.
- Болевой синдром блокируется приемом обезболивающих препаратов.
- Назначаются пробиотики для улучшения перистальтики органов пищеварения.
- Вводятся капельницы с физрастворами для восполнения витаминного и минерального дефицита.
- Мочегонные средства способствуют выводу лишней жидкости.
- Корректируется питание – назначается специальная диета.
Пациент постоянно находится под наблюдением лечащего врача. После курса терапии проводится повторное диагностирование организма. Требуется это для корректировки терапии.
Прогноз лечения
Срок жизни больного зависит от степени поражения организма онкологическим процессом. Сколько проживёт человек, врач сказать не сможет точно. Зависит это от физических показателей и психологического настроя больного.
Поражение незначительного участка брюшины – процент выживаемости выше у пациентов. Продолжительность жизни составляет до 3 лет и более. Если первичный очаг поддаётся лечению, шансы увеличиваются.
При поражении большей площади органа прогноз для пациента неблагоприятный. Летальный исход диагностируется через несколько месяцев. Применяется паллиативная терапия для купирования болевых синдромов и психологического дискомфорта.
При данном заболевании всё зависит от срока выявления и психологического настроя пациента. Доказано учёными, что позитивный настрой на выздоровление значительно увеличивал шансы на выздоровление и долгую жизнь.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди:
Рак желудка – это четвертое по частоте онкологическое
заболевание в мире с общей пятилетней выживаемостью 25%. Из-за высокой агрессивности
опухоли, большая доля пациентов сталкивается с перитонеальным канцероматозом.
Он развивается у 40% пациентов – практически у каждого второго, и связан с
плохим прогнозом – пятилетняя выживаемость составляет не более 5%. Средняя
продолжительность жизни при этом составляет около 6 месяцев.
При выявлении рака желудка, канцероматоз брюшины
обнаруживается у 5-20% пациентов. И хотя хирургия является стандартом лечения
пациентов с раком желудка, выявление опухолевых очагов на брюшине ставит под
сомнение целесообразность операции.
Для улучшения результатов лечения были предложены несколько
опций – циторедуктивная хирургия + HIPEC, неоадъювантная химиотерапия (до операции),
интраперитонеальная химиотерапия.
Прежде чем перейти к возможностям лечения, я хочу остановиться на причинах
развития канцероматоза брюшины при раке желудка.
Для объяснения распространения опухолевых клеток по брюшине
и их разрастании в перитонеальные метастазы, была предложена следующая теория.
Существует 3 основных пути:
- Опухоль распространяется на серозную (внешнюю) оболочку желудка. В таких случаях раковые клетки могут отделяться спонтанно, либо в результате хирургической травмы. Японскими исследователями было показано, что при изначально отрицательных результатам, опухолевые клетки появляются в брюшной полости после операции примерно в половине случаев.
- Во многих случаях рак желудка распространяется по лимфатическим путям. Именно поэтому во время операции обязательно выполняется лимфодиссекция – удаляются лимфоузлы, потенциально содержащие метастазы. Пересечение лимфатических сосудов может приводить к излитию лимфы и опухолевых клеток в брюшную полость
- Другой путь распространения рака желудка – через кровь. Большая кровопотеря во время операции ухудшает отдаленные результаты
Циторедуктивная хирургия и HIPEC при канцероматозе рака желудка
На сегодняшний день существует несколько исследований и
центров, в котором практикуется подобная стратегия лечения. К сожалению, эти
данные получены у пациентов с небольшим распространением опухоли и заведомо
более благоприятным прогнозом. Поэтому они не могут быть применены ко всем
пациентам с раком желудка, страдающим канцероматозом брюшины.
Но положительный момент в том, что отобранные пациенты могут
получить преимущества от такого подхода. В исследованиях показано, что в
среднем пациенты живут дольше – 15 месяцев. При этом каждый пятый пациент живет
5 лет и дольше. Основными условиями успешного лечения является низкий индекс
перитонеального канцероматоза – опухолевые импланты обнаруживаются только в
небольшом количестве участков брюшной полости, и выполненная полная
циторедукция – опухолевые очаги отсутствуют после проведенной операции не
обнаруживаются. Остаточная опухоль в брюшной полости резко ухудшает прогноз –
пациенты живут 6-8 месяцев, поэтому операция не приносит эффекта.
 Сколько живут пациенты с канцероматозом при раке желудка в случае полной циторедукции (синяя линия), остаточных опухолях менее 2.5 мм (желтая), более 2.5 мм — красная линия. По горизонтальной оси — продолжитьельность жизни в годах. По вертикальной — доля пациентов, которые живы в определенный момент времени
Сколько живут пациенты с канцероматозом при раке желудка в случае полной циторедукции (синяя линия), остаточных опухолях менее 2.5 мм (желтая), более 2.5 мм — красная линия. По горизонтальной оси — продолжитьельность жизни в годах. По вертикальной — доля пациентов, которые живы в определенный момент времени
Внутрибрюшная химиотерапия при раке желудка
Большинство исследований в этой области были проведены в странах Азии. В них сравнивались эффективность добавления внутрибрюшной химиотерапии после операции и HIPEC по сравнению только с операцией и HIPEC. Анализ этих исследований не показывает улучшения общей выживаемости у пациентов, которым добавлялась интраперитонеальная химиотерапия. При этом чаще возникают осложнения – нейтропения (снижение количества лейкоцитов) и абсцессы в брюшной полости (отграниченные скопления гноя, требующие активного лечения и потенциально угрожающие жизни).
Рак желудка с позитивными смывами из брюшной полости
Во многих ведущих центрах в России и в мире обязательным
этапом перед операцией при раке желудка является взятие смывов из брюшной
полости. Этот анализ проводится во время лапароскопии и под наркозом. Бывает,
что опухолевые клетки обнаруживаются при отсутствии канцероматоза брюшины. Этот
факт говорит о плохом прогнозе – такие пациенты живут в среднем столько же,
сколько пациенты с канцероматозом брюшины. Из-за этого тактика лечения таких
пациентов может отличаться – в некоторых центрах не рассматривают операцию,
т.к. удаление желудка ухудшает качество жизни и переносимость химиотерапии. В
других клиниках проводят предоперационную химиотерапию, а затем операцию –
удаление желудка и HIPEC.
Существующие на сегодня данные говорят в пользу операции и HIPEC – такие пациенты живут дольше.
В заключение хотелось бы сказать, что стандартом лечения при
канцероматозе рака желудка остается системная химиотерапия. Операции,
внутрибрюшная химиотерапия и HIPEC остаются экспериментальными опциями, которые могут помочь
только некоторым пациентам. Окончательно решение о выборе той или иной
стратегии лечения должен принять пациент совместно с докторам, взвесив все «за»
и «против».
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.

Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Запись
на консультацию
круглосуточно
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.