Вторая линия рак желудка

Новости онкологии
02.12.2014
 Тюляндин Сергей Алексеевич
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Метастатический рак желудка остается неприступной крепостью для современной лекарственной терапии. Стандартные комбинации, к коим относятся платиносодержащие CF (цисплатин и 5-фторурацил) или ECF (эпирубицин, цисплатин, длительные постоянные инфузии 5-фторурацила), способны продлить жизнь больных на срок 8-10 месяцев. Только у больных раком желудка с гиперэкспрессией HER-2, встречаемой у 10-15% пациентов, добавление трастузумаба позволило увеличить продолжительность жизни более года [1]. В последнее время были предприняты попытки улучшить результаты лечения за счет включения оксалиплатина вместо цисплатина, капецитабина вместо 5-фторурацила или добавления доцетаксела. Комбинации ECX (эпирубицин, цисплатина и капецитабина), EOX (эпирубицин, оксалиплатин и капецитабин), FOLFOX (оксалиплатин, лейковорин, 5-фторурацил струйно и инфузионно) продемонстрировали равную эффективность с СF или ECF, комбинация DCF (доцетаксел, цисплатин и 5-фторурацил инфузионно) была более эффективной, но и более токсичной по сравнению с CF [2-4]. Несмотря на все усилия, продолжительность жизни больных метастатическим раком желудка не превышала 10 месяцев.
Другой причиной разработки новых комбинаций является плохая переносимость цисплатина больными раком желудка. Поэтому комбинации с включением оксалиплатина при равной эффективности, но лучшей переносимости постепенно вытесняют цисплатин-содержащие комбинации. Еще одним препаратом, продемонстрировавшим свою активность при раке желудка, является иринотекан. Иринотекан – препарат, который широко применяется для проведения второй линии химиотерапии рака желудка. В рандомизированном исследовании комбинация иринотекана и еженедельного введения 5-фторурацила продемонстрировала равную эффективность и меньшую токсичность по сравнению с СF в первой линии [5]. Однако эта комбинация с включением иринотекана так и не была признана стандартной для проведения первой линии.
В рандомизированном исследовании III фазы проведено сравнение комбинации ECX и популярной иринотекан-содержащей комбинации FOLFIRI, используемой в терапии колоректального рака, при проведении первой линии химиотерапии больным метастатическим раком желудка [6].
В исследование включались больные с морфологически подтвержденным местно-распространенным неоперабельным или метастатическим раком желудка, не получавшие ранее паллиативной химиотерапии (разрешалась адъювантная химиотерапия, которая закончилась не менее 6 мес. тому назад). Больные рандомизировались в две группы, одна из которых получала ECX (эпирубицин 50 мг/м2 в/в 15 минут и цисплатин 60 мг/м2 в/в 1 час в 1 день с последующим приемом капецитабина в дозе 1 г/м2 2 раза в день внутрь ежедневно со 2 по 15 дни каждые 3 недели), другая – комбинацию FOLFIRI (иринотекан 180 мг/м2 в/в инфузия 90 минут с последующим введением лейковорина в дозе 400 мг/м2 в/в 2 часа, после чего вводится 5-фторурацил струйно в дозе 400 мг/м2 с последующей инфузией в дозе 2400 мг/м2 в течение 46 часов каждые 2 недели). Лечение проводили до признаков прогрессирования заболевания или серьезной токсичности, максимальная кумулятивная доза эпирубицина при использовании комбинации ECX не могла превышать 900 мг/м2. Оценку лечения проводили каждые 8 недель. При возникновении прогрессирования больные из группы ECX получали в качестве химиотерапии второй линии комбинацию FOLFIRI и наоборот.
Основным критерием эффективности была медиана времени до неудачи лечения (time to treatment failure-TTF), которая определялась как интервал между рандомизацией и прогрессированием заболевания или отменой лечения или смертью пациента.
В течение 2005-2008 годов в исследование было включено 415 больных, средний возраст которых составил 61 год, 74% были мужчинами, у 84% был метастатический процесс, у 24% операция гастрэктомия в анамнезе и у 10% адъювантная химио- или химиолучевая терапия. При медиане наблюдения 31 мес. медиана TTF составила 5,1 мес. для FOLFIRI и 4,2 мес. для ECX (HR=0,77 p=0.008). Медиана времен до прогрессирования и частота объективного эффекта были 5,75 мес. и 38% у пациентов, получавших FOLFIRI, и 5,29 мес. и 39% у тех, кто получал ECX. Вторую линию химиотерапии получили 39% больных в группе FOLFIRI и 48% в группе ECX. Медиана общей продолжительности жизни составила 9,72 мес. и 9,49 мес. соответственно.
Частота побочных эффектов 3-4 степени была достоверно выше в группе ECX (84% и 69%), включая гематологическую (64,5% и 38%). Частота негематологических осложнений была одинаковой и составила 53% для FOLFIRI и 53,5% для ЕСХ, лечение было прекращено по причине токсичности у 3,9% и 14,5% больных соответственно. Авторы не приводят частоту тошноты и рвоты, характерного осложнения для цисплатина, и диареи, которая может наблюдаться при назначении обеих комбинаций.
Таким образом, данное исследование является хорошей новостью для наших больных метастатическим раком желудка. В нашем арсенале появился хорошо знакомый, умеренно токсичный и сравнимый по эффективности режим FOLFIRI. Плохая новость состоит в том, что, несмотря на применение самых лучших комбинаций в первой линии химиотерапии, большинство больных метастатическим раком желудка умирает в течение первого года после постановки диагноза.
Ключевые слова: рак желудка, первая линия химиотерапии, FOLFIRI, иринотекан.
Литература:
- Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2- positive advanced gastric or gastro-oesophageal junction cancer (ToGA): A phase 3, open-label, ran- domised controlled trial. Lancet 2010, 376:687-697.
- Cunningham D, Starling N, Rao S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N. Engl. J. Med. 2008, 358:36-46.
- Al-Batran SE, Hartmann JT, Probst S, et al. Phase III trial in metastatic gastroesophagealadeno-carcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: A study of the ArbeitsgemeinschaftInternistischeOnkologie. J.Clin. Oncol. 2008 26: 1435-1442.
- Van Cutsem E, Moiseyenko VM, Tjulandin S, et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: A report of the V325 Study Group. J. Clin. Oncol. 2006, 24:4991-4997.
- Dank M, Zaluski J, Barone C, et al: Randomized phase III study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction. Ann. Oncol. 2008, 19:1450-1457.
- Guimbaud R, Louvet C, Ries P, et al. Prospective, randomized, multicenter, phase III study of fluorouracil, leucovorin, and irinotecan versus epirubicin, cisplatin, and capecitabine in advanced gastric fdenocarcinoma: a French Intergroup (Fédération Francophone de Cancérologie Digestive, FédérationNationale des Centres de LutteContre le Cancer, and GroupeCoopérateurMultidisciplinaire en Oncologie) Study. J.Clin. Oncol. 2014. Published Ahead of Print on October 6, 2014
![]()
![]()
![]()
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Библиографическое описание:
Бондарь В. Г., Ищенко Р. В., Гасми М. М. Сравнительный анализ схем химиотерапии у больных распространенным раком желудка // Молодой ученый. 2014. №4. С. 318-322. URL https://moluch.ru/archive/63/9901/ (дата обращения: 06.02.2020).
В большинстве случаев рак желудка диагностируется уже в поздних стадиях. В Украине в 2006г лишь у 23,3 % больных заболевание было выявлено на I-II стадиях, 5-летняя популяционная выживаемость не превысила 13 % (Давыдов М. И., Аксель Е. М., 2008).
Без лечения медиана выживаемости больных диссеминированным раком желудка составляет всего 3–4 месяца. Четыре рандомизированных исследования, в которых сравнивались результаты химиотерапии и симптоматической терапии, убедительно продемонстрировали, что лекарственная терапия позволяет увеличить продолжительность жизни этих больных с 3 до 10 месяцев. Одними из наиболее эффективных режимов первой линии являются комбинации ECF (эпирубицин + цисплатин + 5- фторурацил) и DCF (доцетаксел + цисплатин + 5-фторурацил), непосредственная эффективность которых в исследованиях III фазы составляла 42 % и 37 % соответственно (Ross Р et al, 2002; Van Custem E, et al, 2006). Однако, если больные не отвечают или прогрессируют после первой линии лекарственной терапии, не существует стандартов второй линии химиотерапии.
Материал и методы: Исследование проведено на базе Донецкого областного противоопухолевого центра. Изучены истории болезни и амбулаторные карты.
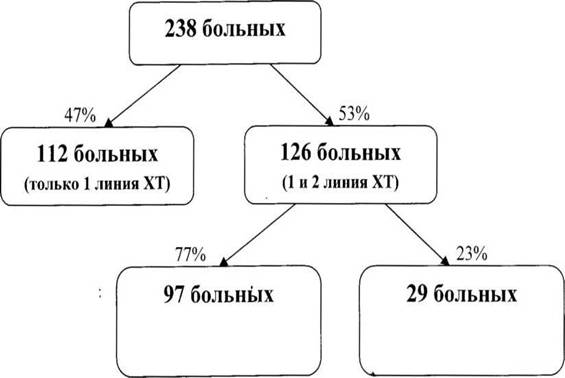
238 больным проведена химиотерапия первой линии. 126 (53 %) из них получили химиотерапию первой и второй линии. В нашей работе проведен анализ всех больных, которые получали химиотерапию второй линии. В анализ включались больные, отвечающие следующим критериям:
1. Морфологически верифицированный диагноз рак желудка.
2. Пациенты, получавшие химиотерапию первой линии.
3. Наличие оцениваемого заболевания.
4. Продолжительность химиотерапии второй линии более 6 недель.
Общая выживаемость и время до прогрессирования были оценены с помощью метода Каплан-Мейера. Сравнение кривых выживаемости проведено с помощью Лог-ранг тест. Все статистические анализы были проведены с помощью программы STATISTICA 6 (StatSoft Inc, СА).
Все 238 больных были разделены на две группы. 1 группа — 112 пациентов, которым проводилась только химиотерапия первой линии; 2 группа — 126 больных, получавших химиотерапию первой и второй линии.
Вначале была оценена общая выживаемость для обеих групп. Далее проведен сравнительный анализ между этими группами больных. Сравнительный анализ проводился с помощью метода х2 с поправкой Йейтса.. Следующие показатели, которые были взяты для сравнения: возраст, пол, статус ECOG (приложение 1) в момент начала химиотерапии первой линии, анемия, локализация первичной опухоли, гистологический тип опухоли, степень дифференцировки опухоли, наличие метастазов в печень, по брюшине, в лимфатических узлах, время до прогрессирования с момента начала первой линии химиотерапии, исходный уровень опухолевых маркеров РЭА и СА 19,9, потеря веса, наличие асцита и проведение паллиативных хирургических вмешательств. Проведенный анализ позволил нам судить о различии характеристик двух групп больных, не зависимо от лечения.
По статусу ECOG, больные распределены на 0–1 и 2. По степени анемии: уровень гемоглобина <10 г/дл и ≥10 г/дл. Локализация первичной опухоли: проксимальный (кардио-эзофегеальный отдел, дно), тело и антральный отделы желудка.
По степени дифференцировки, опухоли распределялись как высоко- и умеренно дифференцированные (G1 + G2) и низко- и недифференцированные (GЗ + G4).По времени до прогрессирования с момента первой линии химиотерапии больные были распределены на группы <5 месяцев и ≥5 месяцев. По исходному уровню опухолевых маркеров (до лечения) — РЭА (<2,5 и ≥2,5 нг/мл) и СА 19,9 (<37 и ≥37 мЕд/мл). Потеря веса за последние 3 месяца — <10 % или >10 %.
Оценено время до прогрессирования с момента начала первой линии химиотерапии и объективный ответ на первую линию химиотерапии между двумя группами больных. Данная работа проводилась с целью изучения влияния этих показателей на общую выживаемость.
Было изучено время до прогрессирования с момента начала первой линии химиотерапии и оценены объективные ответы на первую линию химиотерапии в соответствии с использованными режимами в первой линии, между подгруппами, с целью изучения преимуществ данного режима при оценке выживаемости.
Оценка эффективности лечения проводилась каждые 6 недель с помощью ультразвукового исследования, эзофагогастродуоденоскопии, рентгенографического исследования органов грудной клетки. Компьютерная томография не была использована в рутинной практике.
Токсичность была оценена с помощью, критериев токсичности Национального Института Рака, США (версия 3.0).
В первой линии химиотерапии, были использованы следующие режимы:
— режим ELF
Этопозид 120 мг/м2 в/в кап. 1–3 дни
Лейковорин 50 мг/м2 в/в стр. 1–3 дни
5-фторурацил 500 мг/м2 в/в стр. 1–3 дни
курс повторяют каждые 3 недели
— режим FLEP
Цисплатин 75 мг/м2 в/в кап. 1 день
Этопозид 120 мг/м2 в/в кап. 2–4 дни
Лейковорин 50 мг/м2 в/в стр. 2–4 дни
5-фторурацил 500 мг/м2 в/в стр. 2–4 дни
курс повторяют каждые 4 недели
— режим PF
Цисплатин 75 мг/м2 в/в кап 1 день
5-фторурацил 1000 мг/м2 в день в/в инф 1–5 дни
курс повторяют каждые 4 недели
— режим DCF
Цисплатин 75 мг/м2 в/в кап. 1 день
Доцетаксел 75 мг/м2 в/в кап. 1 день
Капецитабин 750 мг/м2 х 2 раза в день, внутрь 1–14 дни
курс повторяют каждые 3 недели
Во второй линии химиотерапии были использованы следующие режимы:
— режим с пероральными фторпиримидинами
—Фторафур 400 мг х 2 раза в день, внутрь в течение 3 недели, затем двух недельный перерыв и возобновление подобных курсов.
—капецитабин 1000 мг/м2 х 2 раза в день, внутрь 1–14 дни.
курс повторяют каждые 3 недели.
— режим ELF
‘Этопозид 120 мг/м2 в/в кап. 1–3 дни
Лейковорин 50 мг/м2 в/в стр. 1–3 дни
5-фторурацил 500 мг/м2 в/в стр. 1–3 дни
курс повторяют каждые 3 недели
— режим PF
Цисплатин 75 мг/м2 в/в кап 1 день
5-фторурацил 1000 мг/м2 в день в/в инф 1–5 дни
курс повторяют каждые 4 недели
— режим DCF
Цисплатин 75 мг/м2 в/в кап. 1 день
Доцетаксел 75 мг/м2 в/в кап. 1 день
Капецитабин 750 мг/м2 х 2 раза в день, внутрь 1–14 дни
курс повторяют каждые 3 недели
Далее отдельно изучена группа больных (п=126), которым проводилась вторая линия химиотерапии. Проведен однофакторный анализ выживаемости по следующим показателям: возраст, пол, статус ECOG на момент начала второй линии, анемия на момент начала второй линии, локализация первичной опухоли, гистологический тип опухоли, степень дифференцировки опухоли, наличие метастазов в печень, по брюшине, режимы использованные в первой линии ‘химиотерапии, применение фторпиримидинов, митомицина С, таксанов и препаратов платины в первой линии химиотерапии, время до прогрессирования с момента начала первой линии химиотерапии, объективный ответ на первой линии химиотерапии, потеря веса и асцит. Данный анализ позволил нам выделить отдельные факторы, достоверно влияющие на общую выживаемость.
Проведен многофакторный регрессионный анализ Кокса, с целью выделения факторов, имеющих достоверное влияние на общую выживаемость больных. В этот анализ включены факторы, показавшие достоверное влияние на выживаемость при однофакторном анализе.
Результаты исследования.
Характеристика больных, в зависимости от числа проведенных им линий химиотерапии, представлена в таблице 1.
Таблица 1
Характеристика больных, получивших одну или две линии химиотерапии (в обеих группах представлена по состоянию перед началом первой линии химиотерапии)
Показатель | одна линия химиотерапии (п = 112) | две линии химиотерапии (п = 126) | Р | ||
Кол-во, % | Кол-во, % | ||||
Возраст | |||||
<50 | 49 (43,8 %) | 40 (31,7 %) | 0,07 | ||
≥50 | 63 (56,2 %) | 86 (68,3 %) | |||
Пол | |||||
муж | 79 (70,5 %) | 76 (60,3 %) | 0,12 | ||
жен | 33 (29,5 %) | 50 (39,7 %) | |||
Статус ЕСОС | |||||
0–1 | 93 (83,0 %) | 115 (91,3 %) | 0,08 | ||
2 | 19(17,0 %) | 11 (8,7 %) | |||
Локализация первичной опухоли | 0,34 | ||||
Проксимальный отдел Тело желудка Антральный отдел Тотальное поражение | 35 (31,2 %) 41 (36,6 %) 19 (17,0 %) 17 (15,2 %) | 50 (39,7 %) 38 (30,1 %) 15 (11,9 %) 23 (18,3 %) | |||
Гистологический тип опухоли аденокарцинома перстневидноклеточный рак недифференцированный рак | 75 (67,0 %) 30 (26,8 %) 7 (6,2 %) | 100 (79,4 %) 26 (20,6 %) | 0,02 | ||
Степень дифференцировки G1-G2 G3-G4 нет данных | 16 (14,3 %) 39 (34,8 %) 57 (50,9 %) | 30 (23,8 %) 42 (33,3 %) 54 (42,9 %) | 0,20 | ||
Наличие метастазов в печень есть нет | 48 (42,9 %) 64 (57,1 %) | 57 (45,2 %) 69 (54,8 %) | 0,81 | ||
Наличие метастазов по брюшине есть нет | 40 (35,7 %) 72 (64,3 %) | 43 (34,1 %) 83 (65,1 %) | 0,71 | ||
Наличие метастазов в регионарные лимфатические узлы есть нет | 32 (28,6 %) 80 (71,4 %) | 35 (27,8 %) 91 (72,2 %) | 0,98 | ||
Наличие метастазов в лимфатические узлы брюшной полости есть нет | 20(17,9 %) 92 (82,1 %) | 92 (82,1 %) 97 (77,0 %) | 0,41 | ||
Наличие асцита есть нет | 76 (67,9 %) 36 (32,1 %) | 85 (67,5 %) (41 (32,5 %) | 0,94 | ||
Наличие метастазов в надключичные лимфатические узлы есть нет | 20 (17,9 %) 92 (82,1 %) | 19 (15,1 %) 107 (84,9 %) | 0,68 | ||
уровень РЭА, нг/мл <2,5 ≥2,5 нет данных | 22 (19,7 %) 24 (21,4 %) 66 (58,9 %) | 22 (17,5 %) 49 (38,9 %) 55 (43,7 %) | 0,10 | ||
уровень СА19–9, мЕД/мл <37 ≥37 нет данных | 30 (26,8 %) 16 (14,3 %) 66 (58,9 %) | 36 (28,6 %) 37 (29,4 %) 53 (43,7 %) | 0,13 | ||
Гемоглобин, г/дл ≥10 <10 | 78 (69,6 %) 32 (28,6 %) | 102 (81,0 %) 24 (19,0 %) | 0,06 | ||
Наличие асцита есть нет | 36 (32,1 %) 76 (67,9 %) | 41 (32,5 %) 85 (67,5 %) | 0,94 | ||
Потеря веса (за 3 мес. до начала химиотерапии) <10 % ≥10 % | 102 (91,1 %) 10 (8,9 %) | 92 (73,0 %) 34 (27,0 %) | 0,0006 | ||
Режимы I линии химиотерапии ELF PF PELF MVP DCF PSI | 27 (24,1 %) 28 (25,0 %) 4 (3,6 %) 14 (12,5 %) 24 (21,4 %) 15 (13,4 %) | 33 (26,2 %) 21 (16,7 %) 17 (13,5 %) 12 (9,5 %) 30 (23,8 %) 13 (10,3 %) | 0,0001 | ||
G1-G2 — высоко- и умереннодифференцированная опухоль; G3-G4- низко- и недифференцированная опухоль; РЭА — раковоэмбриональный антиген; СА 19,9 — раковый антиген 19,9; ELF — 5-фторурацил струйно + этопозид + лейковорин; PF — 5-фторурацил инфузия + цисплатин; МУР — митомицин С + тенипозид + цисплатин; DCF — доцетаксел + цисплатин + капецитабин; PS 1 — цисплатин + S-1.
112 больных получили только одну линию химиотерапии, тогда как 126 больных — две линии. Обе группы оказались достаточно сбаланисированными по основным прогностическим признакам, за исключением потери веса, гистологического типа опухоли и режимов первой линии химиотерапии. Все эти отличия между группами можно объяснить ретроспективным характером нашей работы.
В таблице 2 представлены непосредственные и отдаленные результаты лечения больных, получивших одну или две линии химиотерапии.
Таблица 2
I линия ХТ (п=112) | 11 линии ХТ (п=126) | Р | |
Объективный ответ на первую линию ХТ | 23,2 % | 27,0 % | 0,88 |
Стабилизация болезни | 52,7 % | 49,2 % | 0,68 |
Медиана времени до прогрессирования*. | 5,7 мес. | 5,7 мес. | 0,55 |
1-летняя безрецидивная выживаемость* | 10,6 % | 18,4 % | |
Медиана продолжительности жизни | 8,5 мес. | 11,1 мес. | 0,0018 |
1-летняя общая выживаемость | 31,0 % | 46,1 % |
*В обеих группах рассчитывались от начала первой линии химиотерапии до прогрессирования. XT — химиотерапия.
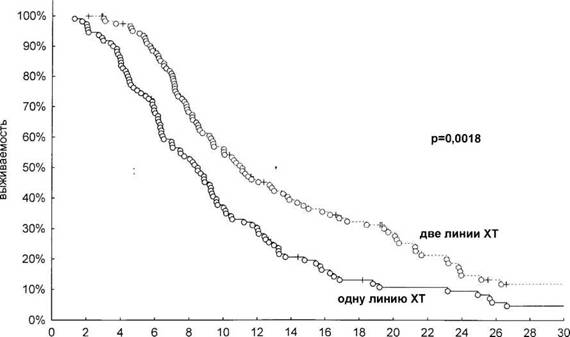
время, мес
Рис. 1. Продолжительность жизни больных, получивших только одну или две линии химиотерапии.
Из представленных данных видно, что эффективность первой линии химиотерапии в обеих группах не различалась как по частоте объективных эффектов (49–52 %), так и по медиане времени до прогрессирования (5,7 мес.). При этом медиана продолжительности жизни у больных, получивших вторую линию химиотерапии, была достоверно выше (11,1 мес. и 8,5 мес., р=0,0018) (рисунок 1). Таким образом, увеличение продолжительности жизни больных может быть объяснено фактом проведения химиотерапии второй линии.
ВЫВОДЫ
Химиотерапия II линии увеличивает медиану продолжительности жизни больных метастатическим раком желудка на 2,6 мес. (11,1 мес. и 8,5 мес. у больных, получавших и не получавших химиотерапию II линии соответственно; р=0,0018). Ее проведение целесообразно у больных в хорошем общем состоянии с длительностью безрецидивного периода >5 мес. с момента начала I линии химиотерапии.
Основные термины (генерируются автоматически): линия химиотерапии, DCF, день, ELF, линия, больной, Наличие метастазов, режим, группа больных, общая выживаемость.