Удаление миомы и желчного пузыря
Доброкачественные опухоли желчного пузыряК доброкачественным опухолям желчного пузыря, встречающимся редко, относятся папилломы, аденомы, аденомиомы, фиброаденомы, цистаденомы, миомы, миксомы и др. Среди них более часто встречаются папилломы. Они бывают множественными и образуют даже диффузный папнлломатоэ желчного пузыря. Доброкачественные опухоли желчного пузыря могут сочетаться с конкрементами. Клинически они ничем себя не проявляют либо наблюдаются симптомы, характерные для хронического холецистита. При холецистографии мелкие опухоли обычно не выявляются, а более крупные принимают за конкремент, поэтому в большинстве случаев их диагностируют уже во время операции или случайно обнаруживают при патологическом исследовании. Лечение состоит в удалении опухоли. Однако в большинстве случаев производят типичную холецистэктомию, учитывая, что во время операции исключить злокачественное перерождение опухоли не всегда возможно даже при срочном гистологическом исследовании се. При сочетании опухоли с конкрементами или хроническим холециститом удаление желчного пузыря тем более необходимо. Опухоли внепеченочных желчных протоков встречаются еще более редко. К доброкачественным опухолям желчных протоков относят: фибромы, аденомы, нейрофибромы, липомы, миксомы, папилломы, миомы и др. Вначале они не вызывают каких-либо клинических проявлений, но по мере роста, обычно медленного, приводят к сужению просвета протока вплоть до полной закупорки его. При этом возникают боли в правом подреберье, иногда по типу печеночной колики, и обтурационная желтуха, крайне напоминающие клиническую картину при холедохолитиазе. Диагностика доброкачественных опухолей трудна, даже во время oпeрации их приходится дифференцировать с конкрементами и злокачественным новообразованием. В последнем случае характер опухоли иногда удается выяснить только после срочного, а в отдельных случаях и дополнительного планового гистологического исследования. Лечение. Доброкачественные опухоли желчных протоков подлежат удалению в связи с опасностью развития обтурационной желтухи н их злокачественного перерождения. Эту операцию в отдельных случаях приходится сочетать с резекцией небольшого сегмента протока и последующим сшиванием его конец в конец или с наложением билиодигестивного анастомоза.
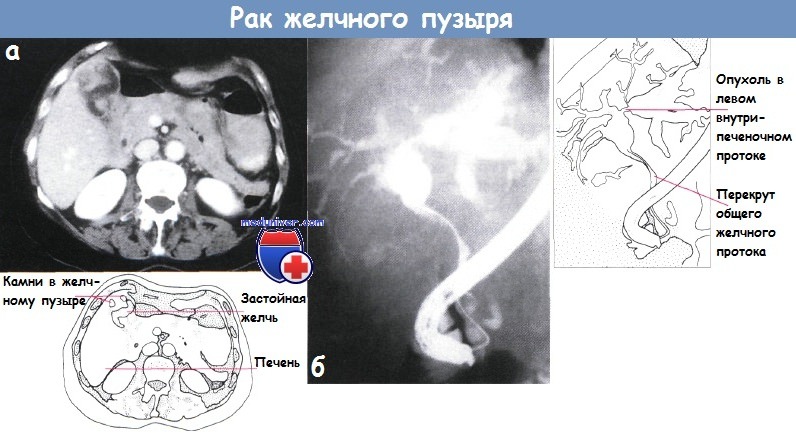
Рак желчного пузыряПервичный рак желчного пузыря составляет от 2 до 8% злокачественных опухолей человека и занимает пятое место среди опухолей желудочно-кишечного тракта. Обычно он поражает лиц в возрасте старше 50 лет. Женщины болеют раком желчного пузыря в 4—5 раз чаще, что объясняется нередким сочетанием его с желчнокаменной болезью, которая у мужчин встречается значительно реже. Однако нельзя говорить о прямой зависимости между этими двумя заболеваниями, так как процент ракового поражения при калькулезном холеинстите невысок, хотя при раке желчного пузыря, как правило, встречаются камни. Рак желчного пузыря локализуется более часто в области дна, реже — шейки желчного пузыря и поверхности, обращенной к печени. По характеру гистологического строения чаще встречаются аденокарцинома, затем скирр, слизистый, солидный, плоскоклеточный и низкодифференцированный рак. Опухоль имеет высокую степень злокачественности, рано метастазирует. обычно по лимфатическим путям. Прежде всего поражаются печень и лимфатические узлы ворот печени, что быстро приводит к развитию обтурацнонной желтухи или сдавлению воротной вены, сопровождающемуся асцитом, гепатомегалии. Рак желчного пузыря, особенно в начальной стадии заболевания, характеризуется бессимптомным течением. Если он развивается на фоне желчнокаменной болезни, то не сопровождается какими-либо патогномоничными признаками. Такие симптомы как интенсивные постоянные боли, пальпируемая бугристая опухоль в правом подреберье, желтуха, снижение массы тела, нарастающая слабость, анемия, позволяющие заподозрить рак желчного пузыря, в большинстве случаев служат проявлениями уже далеко зашедшего внеорганного поражения. Приступообразные боли, значительное повышение температуры тела, озноб, проливной пот для рака желчного пузыря нехарактерны, но могут иметь место при присоединении вторичной инфекции, развитии эмпиемы желчного пузыря, холангита, при сочетании с острым холециститом. В связи с этим В. X. Василенко и И. А. Кикодзе не без основания различают следующие клинические формы первичного рака желчного пузыря: желтушную, «опухолевую», диспепсическую, септическую и «немую». В ряде случаев в клинической картине рака желчного пузыря на первый план выступают симптомы вторичного поражения — прорастания, сдавления опухолью или ее метастазами расположенных рядом органов и тканей, что проявляется симптомами непроходимости желудочно-кишечного тракта, обтурацнонной желтухой, асцитом. Гипохромная анемия, небольшой лейкоцитоз, увеличенная СОЭ, билирубинемия, ахлоргидрия не являются характерными признаками первичного рака желчного пузыря и развиваются обычно в поздней стадии заболевания. Диагностика основывается на данных различных исследований. При дуоденальном зондировании пузырный рефлекс обычно отсутствует. В редких случаях получения порции В в ней имеется большое количество лейкоцитов и слизи, а в мазках, окрашенных по Романовскому — Гимзе, могут быть обнаружены раковые клетки. Рентгенологическое исследование желудочно-кишечного тракта позволяет выявить смешение или сдавление, а также деформацию близлежащих органов, что обычно не является конкретным указанием на поражение желчного пузыря раковой опухолью. При холецистографии в отдельных случаях может определяться дефект наполнения с неровными контурами или деформация тени желчного пузыря. При значительном поражении с вовлечением шейки и пузырного протока желчный пузырь не контрастируется, что, однако, наблюдается иногда и при калькулезном холецистите. Диагностические возможности выделительной холеграфии в большинстве случаев низкие, а при наличии желтухи отрицательные. Сканирование н ультразвуковая биолокация желчного пузыря ввиду отсутствия специфических признаков злокачественного процесса не могут считаться достоверными. Важное диагностическое значение имеет лапароскопия, при которой, помимо визуального исследования, возможно одновременное выполнение чреспеченочной или чреспузырной холангиографии, а также прицельной биопсии со срочным гистологическим исследованием. Кроме того, она позволяет обнаружить метастазы опухоли и избежать необоснованного хирургического вмешательства. Прорастание или метастазирование рака желчного пузыря в печень удастся выявить и с помощью гепатосканирования, ультразвуковой диагностики, а также целиакографии. Таким образом, эти исследования дают возможность определить oпeрабельность опухоли. Во время операции диагностика рака желчного пузыря обычно не представляет трудности, за исключением случаев распространенного экстравезикального поражепия, когда сложно установить первичную локализацию опухоли, а также при поражениях, не выявляемых макроскопически и совершенно неожиданно обнаруживаемых при плановом патоморфологнческом исследовании на фоне острого или хронического воспаления. В связи с этим не лишено оснований предложение производить срочное гистологическое исследование желчного пузыря после холецистэктомии у всех лиц пожилого и старческого возраста. Лечение только хирургическое. Радикальные операции удается выполнить лишь в ранней стадии заболевания, поэтому операбельность составляет около 30%. При локализации ракового процесса в области дна или шейки желчного пузыря вмешательство может быть ограничено холецистэктомией. При поражении стенки, прилежащей к печени, необходима и резекция последней. Если наблюдается прорастание опухоли в печень или солитарный метастаз, производят сегментарную резекцию ее либо гемигепатэктомию, при вовлечении в опухолевый процесс внепеченочных желчных протоков или окружающих органов — их резекцию. Однако целесообразность столь радикальных операций многими хирургами оспаривается. Паллиативные операции выполняют редко. При эмпиемах желчного пузыря производят холецистостомию, при обтурационной желтухе на почве метастаза в ворота печени — реканализацию желчных протоков или наружное транспеченочное дренирование. Прогноз в большинстве случаев плохой даже после радикальных операций. Помимо высокой непосредственной летальности (около 35%), пятилетняя выживаемость не превышает 1%. Несколько лучшие отдаленные результаты наблюдаются при случайном обнаружении рака во время холецистэктомии, производимой по поводу желчнокаменной болезни. Результаты хирургического лечения рака желчного пузыря улучшаются при выполнении операций в более ранние сроки. Это в значительной степени связано с разработкой более совершенных методов исследования рака. Важную роль с точки зрения профилактики и раннего лечения рака желчного пузыря играют своевременные оперативные вмешательства при хроническом калькулезиом холецистите, а также холецистэктомии при сне-мых» камнях, у так называемых носителей желчных камней. Саркомы желчного пузыря встречаются очень редко в виде миосарком, миксохондросарком, меланосарком, лимфосарком и ангиосарком. Гистологически они относятся к веретенообразно-клеточным и полиморфно-клеточным формам с гигантскими клетками. — Также рекомендуем «Рак желчных протоков. Диагностика и лечение рака желчных протоков» Оглавление темы «Болезни желчных путей и поджелудочной железы»: |
В настоящее время ни одна группа медикаментозных препаратов, за исключением блокатора рецепторов прогестерона, не обладает доказанной эффективностью при миоме матки. Основной метод лечения — хирургический. Но всегда ли нужно делать операцию? И, если нужно — какому виду хирургического вмешательства стоит отдать предпочтение?
Еще совсем недавно в отношении пациенток с миомой многие врачи-гинекологи придерживались примерно одной и той же тактики. Какое-то время женщина находилась под наблюдением, периодически проходила УЗИ органов малого таза. Когда узлы достигали больших размеров, врач предлагал удалить их или всю матку целиком.
В настоящее время взгляды на природу миомы изменились, появились новые малоинвазивные методы лечения, одним из которых является эмболизация маточных артерий. Изменились и принципы выбора лечебной тактики.
Согласно современным представлениям лечить миому нужно в следующих случаях:
- Есть симптомы: обильные месячные, признаки сдавления миомой соседних органов (нарушение мочеиспускания), увеличение живота.
- Узлы растут по данным 2–3 последних УЗИ, которые проводились через каждые 4–6 месяцев.
- В будущем женщина планирует забеременеть, и миома может помешать наступлению или вынашиванию беременности.
Принимая решение о необходимости лечения миомы, врач должен учитывать возраст женщины. В период менопаузы миоматозные узлы перестают расти, поэтому в этот период их не целесообразно лечить.
Лапароскопические и полостные операции по удалению миомы матки (миомэктомия)
Классический метод лечения миомы — миомэктомия — это удаление узла хирургическим путем. В настоящее время, список показаний к операции существенно сократился ввиду распространения малоинвазивных способов лечения, в том числе эмболизации маточных артерий.
Миомэктомию проводят под общим наркозом (при полостных и лапароскопических операциях) или под эпидуральной анестезией.
Хирург может выполнить операцию одним из следующих способов:
-
Открытая полостная операция
: при открытой миомэктомии производится
горизонтальный разрез
(длиной 8–10 см или больше) примерно на 2,5 см выше лонного сочленения. Линия разреза проходит по естественной кожной складке, поэтому шрам после операции будет практически незаметен.
Также может быть сделан
вертикальный разрез
, который начинается примерно от середины живота и заканчивается ниже пупка, над лонным сочленением. В настоящее время операции такого типа при миоме матки уходят в прошлое. -
Лапароскопическая
операция по удалению миомы матки выполняется через отверстия в передней брюшной стенке. В одно из них хирург вводит лапароскоп с видеокамерой, в другие — специальные инструменты. -
Роботизированная
миомэктомия напоминает лапароскопическую (также необходимы отверстия в передней брюшной стенке), но при этом хирург управляет инструментами через специальную роботизированную консоль. Для роботизированных операций нужно дорогостоящее оборудование, обученные врачи-специалисты, поэтому их выполняют лишь в единичных крупных клиниках. -
Гистероскопическая
миомэктомия выполняется через
влагалище
. Такую операцию можно проводить при подслизистых миомах, тех, что находятся под слизистой оболочкой и растут в сторону полости матки. Врач вводит во влагалище резектоскоп — инструмент, который использует высокочастотный переменный ток или лазерный луч, чтобы разрезать ткани. Миому разрушают, ее фрагменты вымывают из матки при помощи раствора глюкозы.
Преимущества
Миомэктомия — органосохраняющая операция. Матка остается на месте, а это означает, что в будущем у женщины есть шанс иметь детей. При этом операция является радикальным методом лечения — миоматозные узлы удаляют из матки.
Недостатки
Основные минусы хирургического удаления миом:
- Достаточно высок риск рецидива, особенно при множественных узлах. По данным Минздрава России, при единичном узле он составляет 27%, а при множественных — 59%
[1]
.
- Для того чтобы снизить риск рецидива, женщина вынуждена принимать гормональные препараты.
- Любое хирургическое вмешательство сопряжено с определенными рисками. Иногда при неконтролируемом кровотечении во время операции приходится удалять матку.
- После операции на матке остается рубец. Он создает дополнительные риски во время беременности, может стать причиной кесарева сечения.
- Еще одно возможное осложнение — спайки в малом тазу и, как следствие, трубно-перитонеальное бесплодие.
Показания к операции
Ввиду недостатков и возможных осложнений миомэктомии данный метод лечения показан только при соблюдении ряда условий:
- Отсутствие риска удаления всей матки во время операции.
- Отсутствие риска вскрытия полости матки.
- Предполагается, что на матке не останется много рубцов.
- Женщина планирует беременность в ближайшем будущем, а не в отдаленной перспективе.
Эмболизация маточных артерий (ЭМА) как альтернатива хирургическому удалению миомы матки
Эмболизация маточных артерий (ЭМА) — современная малоинвазивная процедура, которую можно назвать хирургической лишь с оговорками. Врач делает всего один небольшой прокол в области паха под местной анестезией. Через него в бедренную артерию, а затем в маточные артерии, которые кровоснабжают миоматозные узлы, вводят тонкий катетер. Манипуляция выполняется под контролем рентгенотелевидения, врач видит катетер и сосуды на мониторе.
Через катетер вводят специальный эмболизирующий препарат, который состоит из сферических калиброванных частиц определенного размера. Они перекрывают просвет артерий и нарушают приток крови к миоматозному узлу, не влияя на кровоток в здоровых тканях матки. В итоге узел погибает, уменьшается в размерах и замещается соединительной тканью.
Современный эмболизирующий препарат (Embozene), используемый для ЭМА, не вызывает воспалительных и аллергических реакций.
Преимущества
Эмболизация маточных артерий имеет много преимуществ перед хирургическим лечением:
- Нет рисков, связанных с хирургическим вмешательством и наркозом.
- Процедура чаще всего продолжается всего 20 минут (но в зависимости от разных факторов может занять от 10 минут до 1,5 часа). Как правило, пациентку выписывают из клиники уже на 2–3 день.
- Матка остается на месте.
- Период восстановления значительно короче, чем после операции.
Недостатки
Недостатков у эмболизации маточных артерий не так много, они достаточно условны:
- К ЭМА можно прибегать не всегда. Иногда этот метод может быть избыточен, либо, к сожалению, заболевание настолько запущено, что проведенная процедура не принесет необходимых результатов.
- Во время эмболизации маточных артерий врач не удаляет миому. Узел погибает и остается внутри матки. Правда, миомой это назвать уже нельзя: место мышечной ткани занимает соединительная ткань, отделенная от здоровой ткани капсулой. Наступает выздоровление. Но некоторых женщин и гинекологов смущает сам факт того, что «в матке что-то осталось».
Показания к ЭМА
Эмболизация маточных артерий является оптимальным методом в следующих случаях:
- Миома приводит к обильным менструациям, симптомам сдавления тазовых органов.
- Миома значительно растет (по данным последних 2–3 УЗИ органов малого таза).
- Женщина планирует беременность в отдаленной перспективе: после ЭМА отсутствует риск рецидива (рост новых миоматозных узлов), в отличие от миомэктомии.
- Миомэктомия технически трудновыполнима и может нанести большой вред матке, что делает проведение операции нецелесообразным.
Удаление матки (гистерэктомия)
Современная медицина стремится сохранять органы пациента всегда, когда это возможно. В случае с миомой матки это также верно. Подход, при котором женщине удаляли матку в том случае, если она не собирается больше рожать, давно устарел. Все дело в том, что осложнения, которые возникают после гистерэктомии, зачастую оказываются более тяжелыми, чем симптомы миомы:
- Нарушение метаболизма и увеличение массы тела.
- Потливость и приливы, повышение давления и аритмии.
- Нарушения сна, депрессии.
- Снижение качества сексуальной жизни.
Такая картина называется постгистерэктомическим синдромом. Она напоминает ту, что наблюдается при климаксе.
Нельзя воспринимать матку как орган, который предназначен только для деторождения. Она — важная часть репродуктивной системы и всего организма женщины. Удалять матку при миоме можно только в крайних, запущенных случаях, когда весь орган представляет собой скопление огромных узлов. Для того чтобы предотвратить постгистерэктомический синдром, после операции придется принимать заместительную гормональную терапию — синтетический гормональный препарат, принцип действия которого схож с работой женских половых гормонов (гестагенов и эстрогенов).
Сравнение способов оперативного лечения миомы
Краткая сравнительная характеристика основных типов хирургических вмешательств по лечению миомы матки приведена в таблице 1.
Таблица 1. Сравнение типов операций по лечению миомы
| Гистерэктомия | Миомэктомия | Эмболизация | ||
|---|---|---|---|---|
| Показания | Огромные миомы, когда в матке практически не удается обнаружить здоровой ткани. Решить проблему другими методами невозможно. | Главным образом у женщин, которые планируют беременность в ближайшем будущем. | Если женщину беспокоят:
Миома у женщины, которая планирует беременность в отдаленной перспективе, а лечение требуется сейчас. | |
| Степень вмешательства | Полостная или лапароскопическая операция. | Полостная или лапароскопическая операция (в отдельных случаях — гистероскопическая миомэктомия). | Безоперационная малоинвазивная процедура. | |
| Реабилитационный период | До 40 дней | 14–40 дней | 7–14 дней | |
| Возможные осложнения |
|
|
| |
| Вероятность рецидивов | Нулевая, т.к. у женщины больше нет матки. | Возможны. | Возможны. | |
| Возможность беременности | Нет. | Да. | Да. | |
| Стоимость операции в частных клиниках | От 50 000 рублей [2] . | 11 500–314 000 рублей [3] . | 15 000–310 000 * рублей [4] . | |
| *Стоимость операции под ключ. | ||||
Конечно, только врач ставит диагноз, однако и сама пациентка должна иметь представление о том, какие имеются варианты лечения миомы матки. Наименее инвазивной и наиболее щадящей является эмболизация маточных артерий, оставляющая женщине возможность впоследствии забеременеть и родить. Однако, не всегда эта процедура может решить проблему.