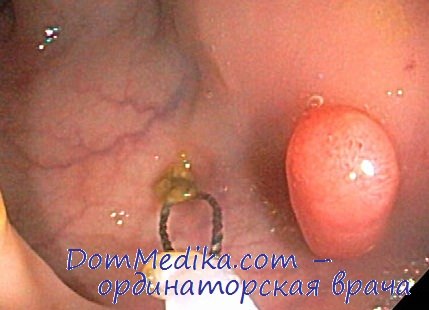
Таргетная терапия при раке желудка
Таргетная терапия рака желудка
Рак желудка является самым распространенным злокачественным новообразованием в мире. На момент постановки диагноза примерно в 50% случаев заболевание находится за пределами основной локализации и/или метастазирует в другие органы и лимфатические узлы.
Основными методами лечения рака желудка являются:
— радикальный метод – хирургическое лечение (доступен для не более половины всех обследуемых пациентов ввиду распространенности злокачественного процесса на момент постановки диагноза);
— основной метод лечения для пациентов на стадии метастазов – химиотерапия. На протяжении десятилетий цитотоксические препараты были основным методом лечения, однако выраженная их токсичность требует новых и более безопасных методов лечения;
— новый и, зачастую, более предпочтительный подход – таргетная терапия – прицельное воздействие на молекулы, связанные с пролиферацией, прорастанием опухоли и образованием метастазов.
Таргетная терапия рака желудка может включать в себя, как комбинацию таргетных препаратов с цитотоксическими препаратами, так и монотерапию препаратами, нацеленными на молекулярные мишени опухоли.
За последние десятилетия изучена вовлеченность в патогенез (механизмы роста и развития) рака желудка множественные генетические изменения, хромосомные абберации, мутации генов и измененные молекулярные сигнальные пути. Некоторые из этих изменений поддаются фармакологическому воздействию.
Рассмотрим основные механизмы таргетного (прицельного) воздействия при раке желудка:
1. Ингибирование рецептора человеческого эпидермального фактора роста типа 2.
При этом механизме используется повышенная экспрессия и амплификация HER2. Рецептор HER2 вовлечен в передачу сигнала, приводящего к росту клеток и их дифференцировке (делению). Повышенная экспрессия этого белка определяется у 7-34% пациентов с раком желудка. Исследования показали, что анти-HER2 терапия имеет значимую противоопухолевую активность. Наиболее распространенный подход, нацеленный на HER2, заключается в его ингибировании моноклональными антителами (пертузумаб и трастузумаб) или с помощью ингибиторов тирозинкиназ (лапатиниб). Оба этих пути были исследованы и активно применяются в 24 странах. В исследованиях участвовали пациенты как с ранее не леченной метастатической или местно-распространенной неоперабельной аденокарциномой желудка, так с опухолями без метастазов.
Клинические исследования TOXAG, HerFLOT, RTOG 1010 оценивали роль трастузумаба в сочетании с химиотерапией и сыграли значительную роль в оценке эффективности данного препарата.
2. Ингибирование рецептора эпидермального фактора роста.
Рецептор EGFR связывает внеклеточные белковые лиганды (участки) семейства EGF. Уровень его экспрессии повышен при нескольких новообразованиях желудочно-кишечного тракта. В 30-50% всех опухолей желудка и гастроэзофагеального соединения встречается повышенная экспрессия гена EGFR. В этих случаях она связана с более старшим возрастом пациента, более агрессивной гистологией и более поздней стадией опухолевого заболевания.
Наиболее распространенным подходом к ингибированию EGFR является использование моноклональных антител, таких как цетуксимаб, панитумумаб и матузумаб или ингибиторово тирозинкиназы (гефитиниб, эрлотиниб). Оба этих подхода достаточно изучены в клинических исследованиях у пациентов с раком желудка и активно применяются во многих странах мира.
3. Ингибирование факторов роста эндотелия сосудов или антиангиогенез.
Ангиогенез является важным аспектом развития, роста и выживания любой опухоли.
VEGF (фактор роста эндотелия сосудов) играет ключевую роль в контроле ангиогенеза, роста опухоли и метастазирования, что делает его привлекательной мишенью для терапевтического воздействия. Уровень VEGF в сыворотке крови был связан с метастазированием и более неблагоприятным исходом для опухолей желудка и гастроэзофагеального соединения.
Множество препаратов было разработано для таргетного воздействия на сигнальный путь VEGF, включая моноклональные антитела и ингибиторы тирозинкиназы.
Одним из достаточно изученных моноклональных антител, нацеленных на рецептор фактора роста эндотелия сосудов является бевацизумаб. Он был тщательно изучен и оценен в качестве монотерапии и в сочетании с химиотерапией для многих видов опухолей. При этом доказан его эффект значительного усиления противоопухолевого действия.
Проведено множество клинических исследований, одним из значимых рандомизированных исследований было AVAGAST. Это исследование проведено в 17 стран мира для оценки эффективности добавления бевацизумаба к химиотерапии. Выявлены более высокие показатели положительных ответов по сравнению с пациентами, не получающих бевацизумаб. Для более точных результатов дополнительно были оценены такие ангиогенные факторы, как EGFR, VEGF-A, VEGFR1, VEGFR2 и нейролипин. В результате проведенных исследований были отмечены не только эффективность добавления бевацизумаба к химиотерапии, но и потенциально важные дополнительные биомаркеры с предсказательными свойствами в отношении бевацизумаба.
Другим подходом для прицельного воздействия на сигнальный путь VEGF заключается в использовании неспецифических ингибиторов тирозинкиназ, которые воздействуют как на рецептор VEGF, так и на рецепторы FLT-3, c-kit и RET. К ингибиторам тирозинкиназ относятся такие препараты как Сунитиниб, Сорафениб, Пазопаниб, Вандетаниб, Телатиниб и Рамуцирумаб. Многие из этих препаратов доказали свою эффективность при сочетании с химиотерапией и в монорежиме у больных с раком желудка.
4. Ингибирование инсулиноподобного фактора
При этом механизме изучена экспрессия рецептора IGF-1R на поверхности клетки и фосфорилирование внутриклеточных субстратов, что в свою очередь ведет к активации сигнальных путей MAPK и PI3K/Akt, содействующих росту опухоли, прогрессии и инвазии при раке желудка.
5. Ингибиторы тирозинкиназы фактора роста фибробластов
При этом механизме задействован рецептор FGFR, котрый несет функцию пролиферации, дифференцировке, подвижности и трансформации клеток. FGFR2 амплифицирован в случае плохо дифференцированного фиброзного рака желудка со злокачественным фенотипом, что делает этот рецептор многообещающей молекулярной мишенью для действия лекарственных препаратов.
6. Ингибиторы тирозинкиназы c-Met
Мембранный рецептор Met необходим для эмбрионального развития и заживления ран. Он экспрессируется эпителиальными и эндотелиальными клетками. Наличие повышенной экспрессии c-Met и активирующих мутаций в гене было подтверждено для рака желудка. И нарушение его регуляции было связано с неблагоприятным исходом для пациента. Ингибирование c-Met применяется у ряда пациентов с многообещающими результатами.
7. Ингибирование клеточного цикла, их подразделяют на следующие механизмы:
— Ингибиторы Polo-подобных киназ
Polo-подобные киназы вовлечены в пути сигнальной трансдукции, приводящие к формированию и изменению веретена деления. Таким образом они задействованы в регуляции клеточного цикла и митоза (деления клеток). Повышенная экспрессия PLK-1 связана с накоплением генов, имеющих отношение к пролиферации и онкогенов. Она отмечается при многих злокачественных новообразованиях, в том числе и раке желудка.
Ингибирование PLK-1 ведет к подавлению роста злокачественных клеток и их гибели (апоптозу). К тому же, PLK-1 является и прогностическим маркером. Пациенты с PLK-1-позитивными опухолями имеют больше метастазов в лимфатических узлах и диффузную структуру опухоли и, соответственно, более неблагоприятный прогноз по сравнению с PLK-1-негативными опухолями. Лечение ингибиторами PLK показало положительный эффект в ряде случаев в виде стабилизации заболевания.
— Ингибиторы киназы Aurora
Являются важными регуляторами пролиферации клеток. Повышенная экспрессия этого вида киназы приводит к нестабильности хромосом при раке желудка. Важно отметить, что киназа Aurora А ингибирует апоптоз (запрограммированную гибель клетки), вызываемый лекарственными препаратами, что приводит к лекарственной резистентности (устойчивости) и выживанию раковых клеток, что транслируется в плохой клинический исход. Поэтому воздействие на этот сигнальный путь может привести к значительному повышению эффективности проводимого лечения.
— Ингибирование циклин-зависимой киназы
Они принимают участие в регуляции клеточного цикла. Флавопиридол ингибирует рост клеток опухоли, индуцирует апоптоз, подавляет ангиогенез и потенцирует эффект химиотерапии при раке желудка. Данный метод эффективен в сочетании с комбинацией препаратов FOLFIRI примерно в 40% случаев.
Ингибиторы убиквитин-протеосомального сигнального пути
Этот сигнальный путь играет важную роль в регуляции клеточного цикла, транскрипции, передаче сигнала и транспорте белков.
Бортезомиб является мощным ингибитором протеосом в отношении ряда солидных опухолей. Проведенные ряд исследований препарата показали высокую эффективность лечения с применением Бортезомиба в сочетании с химиотерапией. Однако, дальнейшее изучение препарата не показывало значительных клинических эффектов и стабилизация заболевания отмечалась лишь в 23% случаев.
8. Ингибирование сигнального пути киназы фосфатидил-инозитол-3,4,5-трифосфата
Аномальная экспрессия белка PTEN при раке желудка обнаруживается в 11% случаев и связана с дифференцировкой опухоли, поздней стадией опухолевого процесса и химиорезистентностью.
Эверолимус – пероральный ингибитор белка-мишени рапамицина, показавший противоопухолевую активность у пациентов Японии с раком желудка. Однако, дальнейшее изучение и применение этого препарата не показало существенного преимущества по сравнению с контрольной группой.
9. Ингибиторы белка теплового шока 90 (HSP90)
При раке желудка экспрессия HSP90 напрямую связана с ростом опухоли и метастазированием в лимфатические узлы. Отрицательная регуляция HSP90 может увеличить чувствительность опухолевых клеток к лекарственным препаратам.
Препарат STA-9090 является мощным ингибитором HSP90 нового поколения. Он показал большую активность и улучшенные показатели безопасности по сравнению с другими фармакологическими веществами. Этот факт дал обоснование для проведения дальнейших исследований препарата в клинической практике при лечении рака желудка.
10. Ингибиторы поли(АДФ)-рибозополимеразы
Ингибиторы PARP действуют путем предотвращения репарации (соединения с восстановлением) одноцепочечных разрывов ДНК, что в свою очередь приводит к клеточной гибели. Эти препараты показали свою высокую эффективность в отношении рака, в особенности у пациентов с мутацией BRCA.
11. Ингибирование протеинкиназы С
Протеинкиназа С явялется ферментом, которая контролирует функцию других белков. Ингибитор протеинкиназы С Бриостатин-1 проходил клинические исследования вместе с паклитакселом для лечения опухолей пищевода и желудка. Была отмечена высокая эффективность такого действия, однако из-за выраженных побочных действий дальнейшее применение было ограничено.
12. Ингибиторы деацетилазы гистонов (HDAC)
Повышенная экспрессия генов деацетилазы гистонов (HDAC) играет ключевую роль в развитии ряда злокачественных опухолей, в том числе рака желудка. Известно 18 типов ферментов HDAC, которые условно разбили на 3 класса. Есть определенные основания полагать, что повышенная экспрессия ряда этих ферментов при опухоли желудка связана с агрессивным фенотипом и распространением ее в лимфатические узлы.
Действие ингибиторов HDAC основано на связывании ионов цинка, необходимое для каталитической функции фермента HDAC. А различная активность и специфичность этих препаратов ведет к выраженным как токсическим, так и терапевтическим эффектам. Препарат Вориностат, официально одобренный FDA (Food and Drug Administration – Управление за качеством пищевых продуктов и лекарственных препаратов в США) для лечения злокачественных гематологических заболеваний показал высокую терапевтическую эффективность у пациентов с раком желудка. В настоящее время проводятся дополнительные клинические исследования Вориностата в сочетании с капецитабином и цисплатином для терапии первой линии метастатического или рецидивирующего рака желудка.
Из описанных выше механизмов и сигнальных путей видно, что существует достаточно примеров успешного таргетного воздействия при раке желудка препаратами, официально одобренными и применяемыми в большинстве стран мира. Затруднения, связанные с ограниченным количеством биомаркеров несколько ограничивают применение ряда таргетных препаратов. Поэтому самым эффективным становится персонализированный подход в таргетной терапии рака желудка.
В медицинском центре «АСС Медикал» мы применяем официально одобренные, оригинальные таргетные препараты, подбирая их под каждого пациента, как в комбинации с химиотерапией, так и в монорежиме.
Статью подготовил С.С. Астафуров
Запись на консультацию врача по телефону 8 (495) 728 02 78
Таргетная терапия – это новый современный метод, используемый для борьбы с раковыми клетками. Когда врач озвучивает диагноз – онкология, это воспринимается как смертный приговор. Ещё десять лет назад лечение рака сводилось к простому поддержанию организма больного. Но сегодня медицина научилась проводить результативную терапию, направленную на полное избавление от раковых клеток.
Лечение онкологических больных отличается высокой стоимостью препаратов и используемого оборудования. Сколько стоит одна капсула лекарства? От 15 000 рублей. Цена терапевтических мероприятий достигает тысячи долларов в медицинских заведениях в Израиле.
Название методики произошло от английского слова «target», означающее цель. Технология новая, разработана для результативной борьбы с раковыми клетками, вошла в состав современного лечения онкологических заболеваний. При этом здоровые ткани не затрагиваются, что приводит к снижению риска побочных воздействий. Часто при использовании химических лекарств и облучения здоровье пациента ухудшается, снижается иммунная защита, выпадают волосы. В результате терапия рака превращается в борьбу с сопутствующими болезнями.
Применение указанного вида технологий в лечении онкологических поражений внутренних органов и систем показывает положительные результаты, пациенты чувствуют себя лучше. Исследования показали возможность терапии:
- Лёгких;
- Молочных желёз;
- Почек;
- При кожных заболеваниях;
- В устранении меланомы.
Однако опытным путём установлено, что таргетная терапия в онкологии помогает при диагностировании рака других органов и систем.
В понятие «таргетного лечения» входят медикаменты, разные по стоимости приобретения и силы действия на заболевание. Применение указанной технологии позволяет в ускоренном темпе устранять негативное воздействие онкологического недуга уничтожением патогенных клеток. Получение препаратов было продолжительным процессом, позволившим добыть необходимое вещество. Средство способно воздействовать на центр, где растёт клетка рака.
Методика используется как самостоятельная процедура или при комплексном воздействии на злокачественное образование. Резистентность опухоли по отношении к терапии таргетного вида ниже, чем при химических способах лечения.
Всего лечение длится от 70 до 140 дней. За это время проходит 3-6 курсов. Один курс проводится на протяжении 21 дня. В период терапии соблюдается диета, тогда прогноз на контролирование роста клеток рака будет положительный.
Показания к применению
При диагностировании у пациента ракового новообразования врач определяет тяжесть заболевания. Полученные результаты говорят о том, какой метод борьбы потребуется применить для положительных результатов. В рекомендации содержатся показания для применения таргетной терапии:
- У больного тяжёлое состояние. При этом невозможно хирургическое вмешательство, химиотерапия недопустима. Указанные мероприятия приведут к ухудшению самочувствия.
- Когда для борьбы с раком используют опасные препараты, приводящие к негативным последствиям в здоровых тканях, использование ТТ позволяет снизить отрицательное влияние.
- Присутствует большой риск распространения метастазов, а также есть опасность возвращения болезни.
- Раковые клетки быстро размножаются и затрагивают новые органы, опухоль растёт ускоренными темпами.
Медицина использует разные виды таргетной терапии, где выделяются дополнительные подгруппы. Каждый вид препаратов направлен на выполнение определённых действий. Их список:
- Медикаменты на основе гормонов. Останавливают выработку секрета, провоцирующего значительный рост опухолевого образования.
- Модуляторы экспрессии генов. Под воздействием потребляемых средств происходят изменения в поведении белков. При меланоме мишень лекарственных средств – это мутированные BRAF гены.
- Индукторы апоптоза. Удаляют из организма клетки раковой ткани, называемые апоптозом.
- Ингибиторы ангиогенеза. Останавливают подачу крови на опухоль. Под воздействием препаратов указанного типа внутри новообразования не развиваются сосуды.
- Моноклональные антитела. С помощью медикаментов происходит доставка молекул токсических веществ к раковым клеткам. Затем происходит уничтожение патогенных тканей.
Антитела в крови человека
Как правило, врачи назначают средства, относящиеся к последнему указанному типу. Компоненты вводимых веществ повторяют антитела, вырабатываемые организмом для борьбы с болезнью.
Воздействие
Когда лечение заболевания проходит с использованием технологии таргетной терапии, способы выбираются разные. Действия, оказываемые на патоген, различаются. Чаще это воздействие на структурную составляющую, способствующую росту опухоли. Способ показал себя с лучшей стороны.
Против чего принимаются препараты, входящие в состав таргетной терапии:
- Против генов, провоцирующих увеличение количества и объёма клеток злокачественного образования.
- Борются с рецепторами, расположенными на поверхности каждой раковой клетки. Рецепторы чувствительны к гормонам и под влиянием способны спровоцировать увеличение объёма раковой опухоли.
- Происходит устранение молекул, участвующих в разрастании апоптоза.
Главная цель медикаментов – это белки. Указанные вещества ускоряют рост патогенных клеток. Также белки принимают активное участие в распространении метастазов. Таргетный препарат останавливает рост онкологической ткани, кровоснабжение опухолевого образования прекращается. Медикаменты блокируют источник, способствующий увеличению количества болезнетворных клеток, снижают или прекращают подачу кровяной жидкости в раковые ткани.
Происходит усиление процесса апоптоза, когда молекула, составляющая лекарство, приводит к прекращению функционирования поражённой раком клетки. Происходит контролируемый распад и выведение из организма остатков повреждённых тканей.
Преимущества и недостатки таргетной терапии
Пациенты и врачи отмечают положительные моменты при использовании указанной методики борьбы с онкологическим заболеванием:
- Использование линейки таргетных препаратов в комплексе с химиотерапевтическими медикаментами даёт усиление полезного воздействия последних.
- Здоровые клетки практически не затрагиваются, что способствует снижению негативных побочных действий.
- Отмечена результативность воздействия в ситуациях, когда медики диагностируют невозможность излечения при метастазах. В результате таргетной терапии больной может прожить дольше на месяцы и годы.
- Фармакологическая форма выпуска таргетных медикаментов – таблетка. Это значит, что принимать лекарство можно без опасения травмировать организм.
- Отмечается, что раковые клетки малочувствительны или нечувствительны к химическим средствам классической терапии, но реагируют на таргетные средства.
С положительными моментами отмечаются и минусы использования указанного метода борьбы со злокачественными клетками опухоли:
- Не все больные могут воспользоваться терапией (поступают жалобы: не получаю лечения). В каждом случае врач после проведения обследования осуществляет назначение индивидуально для больного.
- Только правильно подобранный медикамент даст положительный результат. Для определения лекарства проводят молекулярный и генетический анализ.
- Цена лекарственного средства высока, поскольку его сложно получить. Потому не каждый пациент сможет приобрести медикамент.
Не следует забывать, что у препаратов из линейки таргетной терапии есть побочные эффекты. Негативные последствия не так выражены, как это проявляется при использовании химиотерапевтических лекарств. Применение таргетных средств в качестве самостоятельного способа борьбы с онкологией наносит меньше вреда организму больного, снижается угроза повреждения здоровых органов и тканей. Несмотря на отмеченные плюсы использования, побочные действия достаточно серьёзные, чтобы на них обратить внимание:
- На коже появляется сыпь. Также не исключены другие дерматологические последствия.
- Нарушение функционирования органов выделительной системы.
- Неправильная работа ЦНС, органов эндокринной системы, костного мозга.
- Повышение артериального давления.
- Сердечнососудистая патология. Нередко возникает ухудшение состояния, приводящее к сердечной недостаточности.
- Система дыхания даёт сбои. Развитие пневмонии и заболеваний бронхов.
- Заражение гепатитом, заболеваниями почек.
- Дисфункция желудка.
- Страдает способность крови свёртываться, что приводит к продолжительному заживлению даже мелких ран и порезов.
Появление указанных побочных действий не имеет массового проявления. Их возникновение отмечается по отдельности, и оно менее интенсивное, чем это наблюдается в период применения лечения химией.
Применяемые препараты
Раковый конгломерат – это мутирующие клетки. Мутация гена VHL заключается в провоцировании выделения большего количества белка, участвующего в росте злокачественного образования. Это значит, что применяемые препараты должны воздействовать на источники белка и останавливать продуцирование. Это поможет снизить скорость развития опухоли и заблокирует рост.
Мутировавшая клетка
Сегодня разработано большое количество таргетных препаратов направленного действия:
- Сорафениб, или Нексавар. Отмечена положительная динамика в замедлении роста онкологических образований. Используется при диагностировании опухоли в печени. Под действием средства блокируется ангиогенез, ростовые молекулы утилизируются. В продажу поступают в виде таблеток. В качестве побочных воздействий может являться сыпь на коже, понос, повышенное артериальное давление, отёчность, пациент быстро устаёт.
- Бевацизумаб, или Авастин. Продается в виде раствора для внутривенного введения. Замедляет рост кровеносных сосудов, снабжающих раковый конгломерат. Нередко врачи используют в комплексе с интерфероном-альфа. Лечение становится более результативным. Доктора отмечают хорошую переносимость препарата практически всеми пациентами. Есть небольшой риск развития гипертензии и появления тромбов в крови. Используется для борьбы с поражением простаты, при опухоли головного мозга.
- Эверолимус, или Афинитор. Под воздействием медикаментов происходит блокировка белка mTOR. Реализуется в таблетках, принимать один раз в сутки. Лечит раковые опухоли 4 стадии, помогает при лимфомах. Однако при использовании возникает большое количество побочных действий, поэтому его назначают в крайних случаях.
- Темсиролимус или Торисел. Препараты инъекционного введения. Использование оправдано в тяжёлых случаях болезни и на последних стадиях, поскольку содержат массу побочных действий.
- Сунитиниб или Сутент. Тирозинкиназ результативно блокируется. Последствия приёма проявляются менее интенсивно, но положительные значения проведенной терапии ниже, чем показывают другие лекарства против рака.
- Эрлотиниб. Активно используется для лечения онкологии поджелудочной железы. Оказывается положительное воздействие на естественный защитный механизм больного, активизируя внутренние силы.
- Иматинибом спасают при злокачественных образованиях в каналах пищеварительной системы.
Другие таргетные вещества используются для борьбы с поражением мочевого пузыря, костей, печени.
Лечение онкологических заболеваний
Медициной разработаны препараты, относящиеся к линейке таргетной терапии, имеющие узкую направленность. Вещество попадает в определённый орган и там оказывает терапевтическое воздействие. Это значит, что средство, разработанное для борьбы с онкологией молочной железы, нельзя использовать для уничтожения злокачественных новообразований в лёгких. Результат отсутствует, а побочные действия проявляются.
Поражение щитовидной железы карциномой способно преобразоваться в рак медуллярного типа. Это происходит в трёх случаях из ста. В зоне риска преобладают женщины в период менопаузы.
Рак кишечника и прямой кишки успешно лечится с помощью таргетных препаратов в моно-режиме и в виде комплексного воздействия.
При саркоме препараты направлены на повреждение биологической структуры образования. Процесс разрушения продолжается даже при глубоком поражении мягких тканей.
Молочная железа
Для лечения указанного органа используются препараты, относящиеся к следующим классам воздействия:
- Блокировка рецепторов эпидермального роста, что приводит к снижению выработки белка для увеличения объёма опухоли.
- Останавливается рост кровеносных сосудов, снабжающих жидкостью раковый конгломерат.
- Негативное действие на продуцирование эстрогена.
- Угнетение PARP белка.
Какие лекарства используют при раке молочной железы:
- Препараты с избирательной блокировкой отдельных рецепторов эстрогенов, расположенных на поверхности опухолевого образования. Тамоксифен, Фулвестрант, Фарестон, Фазлодекс.
- Лекарства, оказывающие негативное воздействие на чувствительные ER-позитивные опухоли. Другое название – ингибиторы ароматазы. Средства снижают активность фермента, превращающего андрогены в эстрогены. Герцептином нарушается процесс жизнедеятельности раковых клеток за счёт устранения гормона роста. Аромазин, Фемара, Аримидекс. Вещества противопоказаны при менопаузе из-за малого содержания ароматазы в яичниках.
- Селективные блокаторы ростовых факторов. Авастин, Трастузумаб, Вектибикс. Трастузумаб тормозит скорость развития кровеносных сосудов, снабжающих жидкостью образование, что приводит к остановке роста конгломерата.
Когда блокируются рецепторы, а метастазы лишаются возможности разрастаться, приступают к следующему этапу борьбы со страшной болезнью – торможению ароматазы. Комплексное лечение позволяет значительно снизить активный рост опухоли и дать надежду на выздоровление. Когда лечение отсутствует, метастазы переходят в кости, усугубляя состояние.
Мужские и женские органы
Ежегодно в мире 230 тысячам женщин ставят диагноз рак яичников. Онкологический недуг протекает без симптомов, развитие протекает в ускоренном темпе. Смерть наступает в большинстве случаев, часто после лечения наступает рецидив. Опасность заключается в позднем обнаружении, когда метастазы распространены внутри. В указанном случае целью лекарств таргетного лечения становятся VEGF – источник роста эндотелия сосудов. Не давая опухоли возможности питаться, добиваются снижения агрессии и развития.
Такое заболевание, как рак яичка, встречается редко в возрасте от 18 до 30 лет. Однако развитие происходит быстро и пациента не всегда удаётся спасти. Использование таргетной методики позволяет блокировать рост раковых клеток. При этом процедура нетоксична, не влияет на общее состояние других внутренних органов.
Почки
Онкология, поражающая органы, подлежит результативному лечению путём использования медикаментов таргетной терапии. Их главная задача – предотвращение роста сосудов, провоцирующих появление метастазов. Для терапевтических мероприятий применяют следующие лекарства:
- Нексавар;
- Авастин;
- Торисел.
Для правильного назначения препаратов от рака почки проводится обследование. Это необходимо, чтобы снизить негативные последствия приёма таргетных лекарств.
Побочные действия:
- Рвота;
- Развитие артериальной гипертензии;
- Проблемы на коже;
- Расстройство кишечника.
Если сравнивать воздействие химиотерапии, последствия использования, то появление побочных действий после таргетных средств считается мелочью.
Нередко побочным результатом опухоли становится поражение внутренней полости брюшной полости. При канцероматозе брюшины патогенные клетки приносятся кровотоком и оседают на органах, провоцируя рост метастазов. Осложнения, возникающие при отсутствии лечения: асцит и плеврит.
Поражение протока желчного пузыря раковой опухолью встречается нечасто. Заболевание относится к пожилым людям, после 60-ти лет.
Лёгкое
Заболевание дыхательной системы обнаружить сложно из-за слабо выраженной симптоматики и вялого проявления признаков патологии, проникшей в лёгкие. Медицинские статистические данные говорят о том, что 3/4 пациентов, обратившихся за помощью с диагнозом немелкоклеточного рака лёгкого (НМРЛ) с метастазами, не подлежат операции. В указанном случае использование таргетной терапии – единственный шанс на улучшение самочувствия и выздоровление. При мелкоклеточном недуге органов наблюдается повышенная чувствительность к медикаментозным препаратам направленного действия.
Механизм, используемый в лекарствах, направлен на снижение роста опухолевого образования путём разрушения цепи реакций, проходящих на биологическом и химическом уровне. Используются три класса медикаментов:
- Блокирующие ферменты роста;
- Специфические иммуноглобулины;
- Блокировщики сосудистого разрастания.
Многочисленные положительные отзывы свидетельствуют о результативности таргетной терапии. У пациентов онкологических центров появился шанс на излечение от страшного недуга. Поскольку стоимость лекарств высокая, немногие больные могут позволить себе использование методики. В России предусмотрены квоты на таргетную терапию. Решение принимается консилиумом врачей, и пациента направляют на высокотехнологичное оказание помощи.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди: