T4n2m1 расшифровка рак желудка канцероматоз
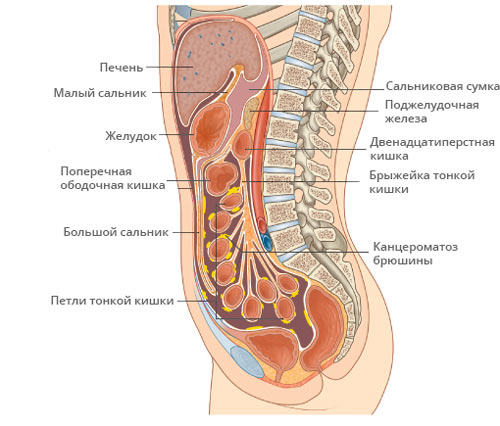
Канцероматоз при раке желудка
При прорастании опухолей, состоящих из эпителия ЖКТ, мочеполовой системы с образованием вторичных метастаз, развивается канцероматоз брюшины. Реже провоцируют обсеменение полости первичные очаги перитонеального рака. Симптомы недуга — асцит, резкое снижение веса, хроническая тошнота и ослабленность. Диагностика проводится визуальными методами — МСКТ, УЗИ, лапароскопия. Для подтверждения диагноза требуется цитология свободной жидкости в брюшине. Лечение — иссечение первичной опухоли и метастаз в брюшине с последующей химиотерапией.
Что за патология?
Канцероматоз — вторичный рак, который поражает всю брюшную полость, точнее — ее серозные оболочки.
Канцероматоз брюшины отличается неблагоприятным прогнозом с невыясненными четкими причинами развития (в некоторых случаях). Чаще при раке желудка, яичников или других органов брюшины поражаются самые уязвимые участки — серозная оболочка и плевральные листы. Этот факт объясняется хорошо развитой системой лимфо — и кровотока. Особенная структура плевры предполагает ее тесное прилегание к соседствующим органам. Именно поэтому метастазирование раковых образований, развившихся в ЖКТ, мочеполовой системе, происходит именно в брюшину.
Обсеменение плевры происходит злокачественными клетками, которые отделились от первичного онкообразования, проникли в серозную жидкость, крово — и лимфоток. По сосудистым сплетениям раковые клетки быстро распространяются по листам брюшины, образуя вторичные очаги патологии. Поэтому появление канцероматоза брюшины связано с потерей аномально делящимися клетками свойства сцепления (адгезии) друг с другом.
Механизм развития
Под канцероматозом в брюшной полости понимают злокачественный процесс аномального деления клеток, запущенный механизмом образования метастаз. Заболевание поражает тонкую серозную оболочку, покрывающую брюшину изнутри. Но эта патология является вторичной, так как ее появление обусловлено проникновением через лимфо — и кровоток или вместе с серозной жидкостью патогенных клеток, формирующих первичный очаг.
Механизм обсеменения брюшины развивается в две стадии:
Стадия распределения раковых клеток из первичного патологического очага. Согласно последним исследованиям считается, что процесс запускается на фоне ослабления взаимодействия между аномальными клетками с приобретением ими чрезмерной подвижности. Первопричинами механического выведения могут стать хирургические вмешательства, повреждение лимфы или сосудов. Стадия усугубления канцероматоза, когда происходит взаимодействие онкологии со срединными эпителиальными пластами брюшной области. На этом этапе аномальные клетки обсеменяют всю площадь серозной оболочки, прорастают в слой межклеточного вещества и соединительнотканный пласт. Постепенно начинает формироваться собственная кровеносная система, питающая растущий очаг вторичной онкологии.
Несмотря на вышеописанное, механизмы образования канцероматоза брюшины до конца не изучены, поэтому сложно предсказать исход и назначить эффективную терапию. Чаще ориентируются на особенности процесса метастазирования. Известна прямая связь канцероматоза с первичной локализацией опухоли, величиной и глубиной проникновения онкологии, ее степенью дифференцировки.
Внутренними провокаторами начала канцероматоза, помимо онкологии, являются:
- непосредственное контактирование плевры с другими органами; плотное прилегание брюшных складок; густая сеть кровеносных сосудов и лимфатических канальцев.
Перечисленные факторы способствуют проникновению озлокачествленных клеток в брюшину по следующим путям распространения:
- непосредственное прорастание из соседних органов; обсеменение патологичными клетками вместе с кровью или лимфотоком; последствие оперативного лечения органов брюшины.
Вернуться к оглавлению
Степени развития
Наиболее приемлемым является подразделение канцероматоза по таким параметрам, как количество, расположение метастазов. В зависимости от этих особенностей различают:
- Р1 — очаговое поражение брюшины (до 2-х метастаз); Р2 — затрагивание нескольких участков, разделенных здоровыми листами брюшины; Р3 — многочисленные вторичные очаги, которые имеют тенденцию к слиянию в одну крупную зону поражения.
Дополнительно для классификации применяется методика индексации канцероматоза в брюшинных листах или бальная система оценки. Для этого производится суммирование баллов (от 0 до 3-х), определенных после измерения самых крупных метастаз в 13-ти вероятных зонах поражения брюшинных листов. Но единой классификации патологии нет из-за разнообразия характеристик первичной онкологии, способной поразить брюшину.
Симптоматика
При развитии канцероматоза в брюшинных листах симптоматика формируется из особенностей проявления первичной онкологии. Специфическим признаком является асцит — скопление больших объемов свободной жидкости в брюшной полости, что влечет за собой сильное изменение внешности: увеличение живота на фоне визуального истощения тела. Но если асцитическое проявление является единственным симптомом, дифдиагностика затрудняется.
Сопутствующими асциту проявлениями считаются:
- болезненность с ноющими, тупыми ощущениями; диарея, чередующаяся с хроническим запором; подташнивание с приступами рвоты; высокое потоотделение; мигрени; общая и мышечная ослабленность; потеря трудоспособности; колебание температуры тела — от предельно низких до высоких значений; пальпирование крупных узлов через кожу (при существенном росте метастаз).
Вернуться к оглавлению
Диагностика
Согласно статистике, канцероматозное поражение брюшины в 40% случаев обуславливается обсеменением тканей клетками опухолей ЖКТ, в 1/3 случаев — раковым поражением яичников.
Проведение лабораторных и клинических тестов поможет выявить болезнь.
Выявить канцероматоз брюшины позволяют следующие методы:
Анализ анамнеза пациента, оценка жалоб. Проведение лабораторных и клинических тестов. Применение визуальных методик определения патологии.
При этом пациента наблюдают такие врачи, как гастроэнтеролог и онколог. В анализах крови обнаруживаются превышение концентрации лейкоцитов на фоне ускоренной скорости оседания эритроцитов. Наиболее наглядные и точные результаты позволяет получить УЗИ органов брюшины и малого таза. Полезной диагностической процедурой считается методика МСРТ с применением контраста и цитологическим методом исследования выделенной асцитической жидкости. Чтобы отобрать биожидкость на анализ, требуется проведение лапароцентеза.
Для окончательного диагностирования применяется малоинвазивная лапароскопия, которая позволяет изучить и определить степень поражения серозной выстилки брюшины, диафрагмы, пространства Дугласа. Точные данные позволяет получить биопсия. Чтобы выявить локализацию первичной опухоли, рассчитать путь метастазирования, делается ПЦР (полимеразная цепная реакция) с обратнотранскриптазным подходом. Современные методики диагностики предполагают оценку состояния организма путем выявления специфических онкомаркеров.
Лечение канцероматоза при раке желудка
Операция иссечения
Хирургическая коррекция показана при незначительных поражениях. В этих случаях злокачественный очаг вырезается, прооперированное место обрабатывается антисептиками с последующей установкой дренажа. После операции обязательно проводится химиотерапия с непосредственным введением в область онкопоражения. Затем проводится удаление первичного очага онкопатологии. Если этого не сделать, рецидив неизбежен, причем будет он более стремительным и агрессивным.
Химия при канцероматозе
Для лечения не применяется системный подход, так как методика предполагает использование большого количества химиопрепаратов, подбор которых осложнен. Наибольшую эффективность при канцероматозе проявляет интраперитонеальная гипертермия. Суть такого лечения заключается в высокотемпературном воздействии на опухоль с одновременным ведением цитостатиков внутрь самого очага, из-за чего раковые клетки погибают. Преимущество техники — возможность подведения максимальных доз противоопухолевого препарата, что повышает действенность лечения. В качестве лекарств выбора выступают платиносодержащий «Цисплатин» и его аналоги. Реже применяется альтернатива химического воздействия — фотодинамическое лечение, основанное на инъекции в опухоль фотосенсибилизирующего вещества.
Симптоматическая терапия
Чтобы облегчить состояние онкобольного, повысить качество его жизни, важно купировать симптомы канцероматоза. Для этих целей применяются методики:
- пункционного удаления избыточной жидкости из брюшной полости; обезболивания; стабилизации перистальтической активности ЖКТ; купирования рвоты и тошноты; нормализации водно-электролитного равновесия; стабилизации выделения мочи.
Канцероматоз — тяжелая болезнь с крайне пессимистичным исходом. Только при своевременном лечении первичной опухоли есть шанс предупреждения патологии.
Выживаемость
Длительность жизни после проведенной терапии зависит от индивидуальных особенностей организма, его состояния. Несмотря на успешность лечения, люди с таким диагнозом живут не более года.
Прогноз будет благоприятным, если первичная опухоль и метастазы в брюшине были обнаружены на ранней стадии и одновременно. В этом случае подбирается более эффективная комплексная тактика лечения, улучшающая прогноз.
Рак желудка T4N2M1
Регистрация: 23.03.2013 Сообщений: 8
Рак желудка T4N2M1
Здравствуйте! У моего папы год назад (операция 13.03.2012) был диагностирован рак желудка T4N2M1 Канцероматоз. Асцит. В выписке из Тамбовской онкологической больницы было рекомендовано:
1. наблюдаться у онколога
3. избегать физических нагрузок
4. оформить группу инвалидности
5. симптоматическая терапия
Заключение зав. химиотерапевтическим отделением: «Учитывая распространенность процесса, нечувствительность опухоли к ПХТ –проведение химиотерапии нецелесообразно»
Такая ситуация в корне не устраивала. В результате метаний куда податься и что делать, удалось оформится на лечение в РОНЦ им. Блохина. Оказалось, что есть целая международная программа для лечения больных с таким заболеванием.
Ровно год мы лечились в РОНЦ. Но после последнего обследования к сожалению было выявлено прогрессирование заболевания. Нас быстренько выписали для прохождения химеотерапии по месту жительства. Рекомендовали схему химеотерапии.
Выписка от 21.03.2013
Возраст: 54 года
Гистологическое заключение: (пересмотр готовых гистологических препаратов от 13.03.2012. лапаротомия с биопсией): низкодифференцированная аденокарцинома.
Жалобы: на незначительную общую слабость 1 степени, онемение кончиков пальцев рук и ног 1 степени.
Анамнез: 13.03.2012 при диагностической лапаротомии с биопсией выявлен и морфологически подтвержден диагноз рака желудка T4N2M1 с диссеминацией по брюшине (гистология №9280/2012 биопсия диссеминации по брюшине, пересмотр готовых гистологических препаратов в РОНЦ: низкодифференцированная аденокарцинома). Интраоперационно: по капсуле печени, по брюшине сальниковой сумки, малого таза выявлена множественная метастатическая диссеминация до 5 мм в диаметре, взята биопсия. ЭГДС от 29.03.2012: начиная от кардиального отдела отмечается плоская опухолевая инфильтрация преимущественно по малой кривизне и передней стенке, на границе средней и нижней трети желудка опухолевая инфильтрация циркулярно охватывает все стенки желудка, передняя стенка в этой области бугристая с единичным язвенным дефектом около 1 см в диаметре, покрытая фибрином. Дистальная граница опухолевой инфильтрации на уровне средней трети антрального отдела. Стенки в области инфильтрации ригидные, перистальтика прослеживается. Заключение: инфильтративный рак желудка, тотальное поражение. Дивертикул свода желудка. Деформация просвета 12-ПК. Маркеры от 28.03.2012:РЭФ 5,78нг/мл.
С 17.04.2012 по 27.02.2013 проведено 12 курсов химиотерапии цисплатин 80мг/м2 (после 7 курсов цисплатин был отменен), 5-ФУ 800мг/м2 в течение 5 суток. После 7 курсов химиотерапии у больного выявлена обструкция мочевыводящих путей, генез которого не ясен, многократные попытки стентирования левого мочеточника оказались безуспешными, учитывая рецидивирующие инфекции мочевыводящих путей, решено оставить нефростому.
Больной обсужден с главным исследователем проф. М. Р. Личиницером. У больного имеется обструкция мочевыводящих путей, генез которой не ясен, учитывая повышение креатинина в биохимическом анализе, принято решение продолжить химиотерапию без цисплатина. С 8 курса больной получает химиотерапию в монорежиме 5-ФУ.
При контрольном обследовании после 14 курсов химиотерапии отмечено прогрессирование заболевания: накопление асцита, появление мтс по брюшине.
1. омез 20мгх2р/сутки
2. фраксипарин 0,3млх1р/сутки п/к
3. контрольное обследование в РОНЦ через 2 месяца лечения.
Сейчас папа жалуется на ноющую тянущую боль внизу живота.
1.Какие еще варианты(способы, методы) лечения возможны в нашем случае?
2. Насколько может быть эффективна предложенная схема?
3. За чем(какими показателями) необходимо следить при проведении химеотерапии?
4. Химиотерапия должна проводиться в стационаре под присмотром специалистов или можно лечиться на дому?
Источники:
https://tvoyzheludok. ru/rak/kantseromatoz-pri-rake-zheludka. html
https://www. oncoforum. ru/forum/showthread. php? t=88861
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.

Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Запись
на консультацию
круглосуточно
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.