Препарат su11248 применяемый при раке желудка


Диагностический период заканчивается принятием решения о лечении. Во многих странах оно не может быть предпринято без детального обсуждения с пациентом плана терапии. У нас многие годы эта модель не функционировала. Не будем обсуждать психологические и этические моменты этой процедуры. Остановимся на возможностях современной медицины.
Важнейшим критерием выбора метода лечения является решение вопроса о распространенности новообразования.
Главной задачей всегда остается полное удаление опухоли и при возможности метастазов. С этой целью используются следующие методы: эндоскопическое (местное) удаление опухоли (или предшествующего ей образования), оперативное вмешательство, химиотерапия, лучевая терапия.
Только крайне маленькие опухоли, поражающие лишь слизистую желудка, могут быть щадяще удалены с помощью эндоскопической техники. Это же касается изменений, классифицируемых как предраковая стадия. В этих случаях врач должен быть убежден, что опухоль не выходит за пределы слизистой оболочки органа. К сожалению, на этой стадии заболевание редко выявляется. В Японии благодаря широкому внедрению гастроскопии это случается значительно чаще, поэтому у них этот метод пользуется успехом, да и смертность ниже.
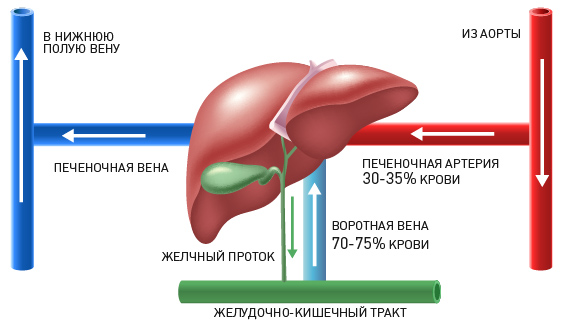
Операция у больных раком желудка чаще всего является методом выбора, при этом стремятся полностью удалить злокачественную опухоль и ближайшие лимфатические узлы. В зависимости от расположения опухоли желудок может быть удален полностью или частично. Для восстановления проходимости пищеварительного тракта используют участок тонкой или толстой кишки, при этом стремятся создать условия для попадания в него желчной кислоты и секрета поджелудочной железы. Таким образом, «искусственный желудок» вполне может решать важные задачи сохранения энергии и питательных веществ, чтобы восстановить силы больного. Не у каждого пациента оперативное вмешательство заканчивается удачным исходом. Даже при радикальном удалении опухоли могут остаться в окружающих (внешне совершенно здоровых) тканях раковые клетки, приводящие к рецидиву злокачественного новообразования. Чтобы избежать этого, часто назначают дополнительное лечение.
Лучевая и химиотерапия
При раке желудка стратегия применения лучевой (радио-) терапии различна. В послеоперационном периоде нередко назначают «облучение» самостоятельно или в комбинации с химиотерапией. Подобная длительная терапия осуществляется также, когда возможно лишь частичное удаление опухоли. В ряде случаев целесообразна предоперационная подготовка комбинированным методом. Врачи надеются, что это позволит значительно уменьшить размеры опухоли, что даст возможность в дальнейшем успешно ее убрать. В специализированных центрах используют лучевую терапию во время операций (интраоперативную радиотерапию). Для этого к операционному полю подводят облучающее устройство, чтобы воздействовать непосредственно на раковые клетки при максимально щадящем режиме для здоровых тканей. В далеко зашедших стадиях рака лучевая терапия носит вспомогательный характер, снижая влияние симптомов и болей, вызываемых опухолью. Этот лечебный эффект можно усилить дополнительным назначением цитостатиков (лекарственных веществ, блокирующих деление клеток).
Лучевая терапия, как известно, имеет побочные эффекты. Если поле облучения захватывает пищевод, возможно затруднение глотания, которое можно преодолеть с помощью лекарственных средств. Поскольку желудок окружен петлями кишечника, то предохранить их от попадания некоторой дозы невозможно. Следствием этого могут быть поносы, запоры или незначительные боли в животе. Иногда эти явления могут вынудить врача прекратить лечение.
Опыт применения стандартных методов лечения злокачественных опухолей, таких как хирургический, лучевая или химиотерапия, показал ограниченность их возможностей. Поэтому неустанно ведется поиск новых методов лечения в надежде сделать рывок в онкологии. Благодаря развитию фундаментальной науки, сделавшей более понятным процесс возникновения и функционирования опухолевой клетки на молекулярно-генетическом уровне, в настоящее время становится возможным создание новых противоопухолевых препаратов с другим механизмом действия. Поскольку их действие избирательно направлено на генетические или биохимические изменения конкретной опухолевой клетки у конкретного больного, в онкологии намечается постепенный переход от лечения опухоли известного органа к лечению специфических изменений, имеющихся в опухолевой клетке у конкретного больного. В этой связи возрастает значение молекулярной и биохимической диагностики отклонений, имеющихся в клетках опухоли. Именно характер молекулярно-генетических нарушений в скором времени будет определять выбор лекарственных средств в онкологической клинике и, как хотелось бы надеяться, повысит результативность лечения.
Иммунотерапия
Иммунотерапия является одним из самых перспективных направлений в лечении рака. Известно, что человеческий организм обладает рядом эффективных способов самозащиты от рака и других болезней. Это позволяет во многих случаях подавить возникающие очаги рака и препятствует образованию метастазов. Естественно желание ученых сделать более эффективными природные защитные механизмы и этим помочь организму справиться с болезнью самому. Чтобы достичь результата, уже давно делаются попытки стимулировать иммунную систему, то есть используют иммунотерапию. Привлекательность идеи этого метода заключается в борьбе с болезнью природными средствами, что делает опасность побочных эффектов минимальной.
Современная иммунотерапия включает в себя несколько направлений: противораковые вакцины, лечение антителами, клеточная иммунотерапия, иммуномодуляторы.
Механизм действия противораковых вакцин, конкурирующих инфекций, других иммуностимуляторов, в том числе растительных препаратов и витамина С, достаточно хорошо изучен. Они оказывают мощное стимулирующее воздействие, вызывая увеличение выработки иммуноглобулинов и лимфоцитов и этим повышая готовность и эффективность иммунной системы. Отмечено, что лучше реагируют на этот вид лечения те пациенты, опухоли у которых являются быстрорастущими. Впрочем, и при назначении лучевой и химиотерапии шансы на успех лечения тем выше, чем агрессивнее опухоль.
Поиск методов, стимулирующих защитные силы организма, ведется в нескольких направлениях. Наиболее многообещающим является лечение с помощью моноклональных антител. Этот метод основан на обнаружении в раковых клетках специфического белка – антигена, на который в организме человека иммунная система вырабатывает специфические антитела. Последние, соединяясь с антигеном, приводят к разрушению раковой клетки. Подобная защитная реакция организма зависит от состояния иммунной системы, так как при ее ослаблении опухоль начинает расти.
Под клеточной иммунотерапией понимают создание клеток-киллеров, способных активно воздействовать на раковые клетки. Поиски ведутся в нескольких направлениях с использованием различных клеток крови, активированных вне организма. Поскольку эти методы находятся на стадии экспериментально-клинических исследований, широкое внедрение их в практику еще впереди.
В настоящее время проходят испытания более десятка биопрепаратов, способных целенаправленно воздействовать на обменные процессы в раковых клетках и блокировать появление новых сосудов, питающих опухоль. Таким является, например, препарат SU11248, применяемый при раке желудка. Ученые надеются, что со временем можно будет отказаться от лучевой и химиотерапии.
далее >>
Сотни поставщиков везут лекарства от гепатита С из Индии в Россию, но только M-PHARMA поможет вам купить софосбувир и даклатасвир и при этом профессиональные консультанты будут отвечать на любые ваши вопросы на протяжении всей терапии.
Диагностический период заканчивается принятием решения о лечении. Во многих странах оно не может быть предпринято без детального обсуждения с пациентом плана терапии. У нас многие годы эта модель не функционировала. Не будем обсуждать психологические и этические моменты этой процедуры. Остановимся на возможностях современной медицины.
Важнейшим критерием выбора метода лечения является решение вопроса о распространенности новообразования.
Главной задачей всегда остается полное удаление опухоли и при возможности метастазов. С этой целью используются следующие методы: эндоскопическое (местное) удаление опухоли (или предшествующего ей образования), оперативное вмешательство, химиотерапия, лучевая терапия.
Только крайне маленькие опухоли, поражающие лишь слизистую желудка, могут быть щадяще удалены с помощью эндоскопической техники. Это же касается изменений, классифицируемых как предраковая стадия. В этих случаях врач должен быть убежден, что опухоль не выходит за пределы слизистой оболочки органа. К сожалению, на этой стадии заболевание редко выявляется. В Японии благодаря широкому внедрению гастроскопии это случается значительно чаще, поэтому у них этот метод пользуется успехом, да и смертность ниже.
Операция у больных раком желудка чаще всего является методом выбора, при этом стремятся полностью удалить злокачественную опухоль и ближайшие лимфатические узлы. В зависимости от расположения опухоли желудок может быть удален полностью или частично. Для восстановления проходимости пищеварительного тракта используют участок тонкой или толстой кишки, при этом стремятся создать условия для попадания в него желчной кислоты и секрета поджелудочной железы. Таким образом, “искусственный желудок” вполне может решать важные задачи сохранения энергии и питательных веществ, чтобы восстановить силы больного. Не у каждого пациента оперативное вмешательство заканчивается удачным исходом. Даже при радикальном удалении опухоли могут остаться в окружающих (внешне совершенно здоровых) тканях раковые клетки, приводящие к рецидиву злокачественного новообразования. Чтобы избежать этого, часто назначают дополнительное лечение.
Лучевая и химиотерапия
При раке желудка стратегия применения лучевой (радио-) терапии различна. В послеоперационном периоде нередко назначают “облучение” самостоятельно или в комбинации с химиотерапией. Подобная длительная терапия осуществляется также, когда возможно лишь частичное удаление опухоли. В ряде случаев целесообразна предоперационная подготовка комбинированным методом. Врачи надеются, что это позволит значительно уменьшить размеры опухоли, что даст возможность в дальнейшем успешно ее убрать. В специализированных центрах используют лучевую терапию во время операций (интраоперативную радиотерапию). Для этого к операционному полю подводят облучающее устройство, чтобы воздействовать непосредственно на раковые клетки при максимально щадящем режиме для здоровых тканей. В далеко зашедших стадиях рака лучевая терапия носит вспомогательный характер, снижая влияние симптомов и болей, вызываемых опухолью. Этот лечебный эффект можно усилить дополнительным назначением цитостатиков (лекарственных веществ, блокирующих деление клеток).
Лучевая терапия, как известно, имеет побочные эффекты. Если поле облучения захватывает пищевод, возможно затруднение глотания, которое можно преодолеть с помощью лекарственных средств. Поскольку желудок окружен петлями кишечника, то предохранить их от попадания некоторой дозы невозможно. Следствием этого могут быть поносы, запоры или незначительные боли в животе. Иногда эти явления могут вынудить врача прекратить лечение.
Опыт применения стандартных методов лечения злокачественных опухолей, таких как хирургический, лучевая или химиотерапия, показал ограниченность их возможностей. Поэтому неустанно ведется поиск новых методов лечения в надежде сделать рывок в онкологии. Благодаря развитию фундаментальной науки, сделавшей более понятным процесс возникновения и функционирования опухолевой клетки на молекулярно-генетическом уровне, в настоящее время становится возможным создание новых противоопухолевых препаратов с другим механизмом действия. Поскольку их действие избирательно направлено на генетические или биохимические изменения конкретной опухолевой клетки у конкретного больного, в онкологии намечается постепенный переход от лечения опухоли известного органа к лечению специфических изменений, имеющихся в опухолевой клетке у конкретного больного. В этой связи возрастает значение молекулярной и биохимической диагностики отклонений, имеющихся в клетках опухоли. Именно характер молекулярно-генетических нарушений в скором времени будет определять выбор лекарственных средств в онкологической клинике и, как хотелось бы надеяться, повысит результативность лечения.
Иммунотерапия
Иммунотерапия является одним из самых перспективных направлений в лечении рака. Известно, что человеческий организм обладает рядом эффективных способов самозащиты от рака и других болезней. Это позволяет во многих случаях подавить возникающие очаги рака и препятствует образованию метастазов. Естественно желание ученых сделать более эффективными природные защитные механизмы и этим помочь организму справиться с болезнью самому. Чтобы достичь результата, уже давно делаются попытки стимулировать иммунную систему, то есть используют иммунотерапию. Привлекательность идеи этого метода заключается в борьбе с болезнью природными средствами, что делает опасность побочных эффектов минимальной.
Современная иммунотерапия включает в себя несколько направлений: противораковые вакцины, лечение антителами, клеточная иммунотерапия, иммуномодуляторы.
Механизм действия противораковых вакцин, конкурирующих инфекций, других иммуностимуляторов, в том числе растительных препаратов и витамина С, достаточно хорошо изучен. Они оказывают мощное стимулирующее воздействие, вызывая увеличение выработки иммуноглобулинов и лимфоцитов и этим повышая готовность и эффективность иммунной системы. Отмечено, что лучше реагируют на этот вид лечения те пациенты, опухоли у которых являются быстрорастущими. Впрочем, и при назначении лучевой и химиотерапии шансы на успех лечения тем выше, чем агрессивнее опухоль.
Поиск методов, стимулирующих защитные силы организма, ведется в нескольких направлениях. Наиболее многообещающим является лечение с помощью моноклональных антител. Этот метод основан на обнаружении в раковых клетках специфического белка – антигена, на который в организме человека иммунная система вырабатывает специфические антитела. Последние, соединяясь с антигеном, приводят к разрушению раковой клетки. Подобная защитная реакция организма зависит от состояния иммунной системы, так как при ее ослаблении опухоль начинает расти.
Под клеточной иммунотерапией понимают создание клеток-киллеров, способных активно воздействовать на раковые клетки. Поиски ведутся в нескольких направлениях с использованием различных клеток крови, активированных вне организма. Поскольку эти методы находятся на стадии экспериментально-клинических исследований, широкое внедрение их в практику еще впереди.
В настоящее время проходят испытания более десятка биопрепаратов, способных целенаправленно воздействовать на обменные процессы в раковых клетках и блокировать появление новых сосудов, питающих опухоль. Таким является, например, препарат SU11248, применяемый при раке желудка. Ученые надеются, что со временем можно будет отказаться от лучевой и химиотерапии.
далее >>
Source: brosaem.info
Продолжается соревнование фармацевтических фирм в поисках наиболее эффективных
противоопухолевых препаратов. Вот некоторые из самых многообещающих препаратов,
которые в настоящее время проходят последние стадии клинических испытаний.
| Препарат | Производитель | Основные показания |
| 572016 | GlaxoSmithKline | Рак молочной железы, рак мочевого пузыря |
| ABX-EGF | Abgenix, Amgen | Рак толстой кишки, другие опухоли |
| BAY-439006 | Onyx Pharmaceuticals, Bayer | Распространенный рак почек |
| PTK-787 | Novartis | Рак толстой кишки |
| Provenge | Dendreon | Рак предстательной железы |
| Revlimid | Celgene | Миелодиспластические синдромы |
| SU11248 | Pfizer | Рак желудка |
| Tarceva | OSI Pharmaceuticals, Genentech, Roche | Рак легких |
| Telcyta | Telik | Рак яичников |
572016
| Рыночный потенциал: | $$ |
| Новизна: | ++ |
Если раковая опухоль плохо поддается лечению, недостаточно воздействовать только
на один ген, необходимо «держать на прицеле» несколько. Эта теория послужила
основой создания препарата двойного действия для лечения злокачественных опухолей
молочной железы, мочевого пузыря и др. В сущности, он объединяет механизмы
действия двух препаратов: Iressa (для лечения рака легких, AstraZeneca) и Herceptin
(рак груди, Genentech) в одной таблетке. В настоящее время препарат
проходит последние стадии клинических испытаний в лечении рака молочной железы.
ABX-EGF
| Рыночный потенциал: | $$ |
| Новизна: | + |
Это моноклональное антитело воздействует на те же молекулы, что и недавно
одобренный Erbitux компании ImClone Systems, однако в его основе лежит новаторская
технология, позволяющая создать «полностью человеческие» препараты антител.
Можно надеяться, что «полностью человеческие» антитела будут вызывать
меньше аллергических реакций, чем препараты, частично основанные на мышиных антителах,
как Erbitux (в ходе клинических испытаний Erbitux вызывал тяжелые аллергические
реакции примерно у 3% пациентов).
BAY-439006
| Рыночный потенциал: | $ |
| Новизна: | ++ |
Этот препарат изначально был предназначен для уничтожения белка, называемого
RAF-киназа, который способствует делению клеток. Однако выяснилось, что BAY-439006
способен также блокировать белки, которые стимулируют рост кровеносных сосудов,
питающих опухоль. Именно этим объясняется эффективность препарата в лечении
рака почек, невосприимчивого к другим средствам. В ходе клинических
испытаний, проведенных в июне этого года, выяснилось, что под действием BAY-439006
у 37 пациентов из 106 опухоль уменьшилась на 25%, а еще у 38 пациентов
опухоль перестала расти. Для сравнения: существующие противораковые средства дают
положительный эффект у 15% пациентов с поражением почек. BAY-439006
в настоящее время находится на последних стадиях клинических испытаний.
PTK787
| Рыночный потенциал: | $$ |
| Новизна: | ++ |
Этот препарат для лечения рака толстой кишки в какой-то мере повторяет
механизм действия ингибитора ангиогенеза Avastin (компания Genentech), но выпускается
в форме таблеток. Как и Avastin, он перекрывает кровоснабжение опухоли,
блокируя рецепторы фактора роста сосудистого эндотелия, необходимые для развития
новых кровеносных сосудов. В предварительных испытаниях под действием препарата
(в сочетании с химиотерапией) размеры опухоли уменьшились у 15
пациентов из 28. Ведутся дополнительные исследования. Если испытания окажутся
успешными, Novartis сможет подать заявку на одобрение препарата уже в следующем
году.
Provenge
| Рыночный потенциал: | $ |
| Новизна: | +++ |
Очередная гениальная идея: создать вакцину против рака, научив иммунную систему
самостоятельно убивать раковые клетки. До сих пор эта идея не срабатывала. Provenge
оказался эффективным в лечении некоторых пациентов с нетяжелыми формами
рака предстательной железы. Второе клиническое испытание этого препарата должно
завершиться в конце этого или в начале следующего года. Специалисты
по-прежнему настроены скептически, но в случае успеха Provenge может стать
первой противораковой вакциной на фармацевтическом рынке.
Revlimid
| Рыночный потенциал: | $$ |
| Новизна: | + |
Revlimid (ранее Revimid) представляет собой более мощную версию талидомида
(предлагаемого той же компанией), препарата для лечения множественной миеломы
при раке крови. Для пациентов с миелодиспластическими синдромами (МДС) (еще
одна группа злокачественных поражений крови) новый препарат позволит снизить количество
переливаний крови. У пациентов с определенным генетическим дефектом
Revlimid, по всей видимости, полностью устраняет МДС. С другой стороны, Revlimid
оказался неэффективным в лечении рака кожи. Препарат может получить одобрение
в 2005 году.
SU11248
| Рыночный потенциал: | $ |
| Новизна: | ++ |
Этот препарат воздействует на несколько генов, принимающих участие в стимулировании
роста раковой опухоли. Pfizer унаследовал SU11248 в результате приобретения
компании Pharmacia в 2002 году, и сейчас препарат проходит последние
испытания на эффективность в лечении рака желудка и почек. На предыдущем
этапе испытаний препарат помог 65% из 92 больных раком желудка, ранее безуспешно
применявших противоопухолевое средство Gleevec компании Novartis; причем у семи
пациентов опухоль уменьшилась более чем на 20%. В лечении рака почек SU11248
также показал впечатляющие результаты: уменьшение опухоли наблюдалось у 33%
пациентов, а еще у 40% болезнь перестала прогрессировать (напомним:
современные лекарственные средства дают положительный эффект в 15% случаев).
Tarceva
| Рыночный потенциал: | $$ |
| Новизна: | ++ |
Этот препарат вызывал большие сомнения, но в апреле 2003 года разработчики
объявили, что Tarceva существенно продлевает жизнь пациентам на поздних стадиях
немелкоклеточного рака легких. У 731 пациента в ходе клинических испытаний
препарата средняя продолжительность жизни увеличилась на 26,7 месяцев, что
является статистически значимой разницей. Этот результат может дать новому препарату
преимущество перед противораковым средством Iressa (AstraZeneca) с таким
же механизмом действия. Остается только один вопрос: какое влияние на рыночный
потенциал этих лекарств окажет открытие мутаций, позволяющих прогнозировать, будут
ли эти препараты работать. Такое диагностическое средство может снизить спрос
на данные препараты. Однако Genentech и его партнер OSI Pharmaceuticals настаивают,
что Tarceva позволяет продлить жизнь гораздо большему количеству пациентов, чем
окажется в той небольшой группе, где будут обнаружены определенные мутации.
В настоящее время клинические испытания препарата Tarceva завершены и ожидается
решение о его одобрении.
Telcyta
| Рыночный потенциал: | $ |
| Новизна: | ++ |
Telcyta представляет собой специально разработанную молекулу, которая должна
оставаться безвредной до тех пор, пока не вступит в контакт с ферментом,
вырабатываемым определенными раковыми клетками. Этот фермент расщепляет молекулу
на две части, одна из которых ядовита. Ядовитая часть быстро расщепляется и убивает
раковую клетку, в то время как здоровые клетки остаются неповрежденными.
Препарат выглядит многообещающим для нескольких типов раковых заболеваний. В двух
исследованиях, проведенных в июне, положительный результат наблюдался примерно
у половины пациенток с раком яичников. Еще в одном исследовании
у 3 из 16 пациентов раковые опухоли исчезли, по крайней мере, на время. Результаты
последних тестов будут известны в начале следующего года.
Рыночный потенциал оценка предполагаемого объема продаж, основанная
на расчетах аналитиков журнала Forbes:
$ до $500 млн в год;
$$ от $500 млн до $1 млрд;
$$$ от $1 млрд до $2 млрд;
$$$$ более $2 млрд.
Новизна препарата (по оценкам аналитиков журнала Forbes):
+ новый препарат в уже существующем классе;
++ значительно улучшенное средство по сравнению с уже существующими;
+++ препарат нового класса или выдающийся по своим качествам;
++++ принципиально новый подход.
https://www.forbes.com
© Провизор 1998–2017