Обходные анастомозы при раке желудка
При раке желудка выполняют два типа паллиативных операций. При первом типе вмешательств операция, не устраняя очага поражения, направлена на улучшение питания и общего состояния больного. Такими операциями являются обходной анастомоз между желудком и тонкой кишкой — гастроэнтероанастомоз, гастро- и еюностомии. При втором типе операций удаляется первичный очаг опухоли или метастазы. К таким операциям относятся паллиативные резекции, паллиативные гастрэктомии и удаление метастазов.
Гастроэнтеростомия (наложение гастроэнтеростомоза)
Желудочно-кишечный анастомоз накладывается при иноперабельном раке выходного отдела желудка, и эта операция является наиболее частым паллиативным вмешательством. Смысл операции заключается в создании соустья между желудком и тощей кишкой. В настоящее время выполняют заднюю — позадиободочную, реже переднюю — впередиободочную гастроэнтеростомию. В первом случае через отверстие в брыжейке поперечно-ободочной кишки выводят заднюю стенку желудка и соединяют анастомозом с петлей тонкой кишки. Во втором варианте, петлю кишки проводят впереди от поперечно-ободочной кишки, прикладывают к передней стенке желудка и соединяют с ним соустьем. В 8-10 см ниже гастроэнтероанастомоза обычно накладывается межкишечный брауновский анастомоз.
Гастростомия
Операцию применяют при неоперабельном раке проксимального отдела желудка и пищевода, сопровождающемся нарушением проходимости пиши. Предложено более ста модификаций этой операции. Наибольшее распространение получила гастростомия по Кадеру и Витцелю.
Энтеростомия
Кишечный свищ или энтеростому накладывают для обеспечения питания больного при раке желудка и создания проходимости пищеварительного тракта. Операция также производится при обширном поражении желудка с нарушением проходимости и невозможности наложить гастростому. Подобная операция является единственным средством помочь неоперабельному больному раком резецированного желудка. Чаще искусственный свищ создается в начальном отделе кишечника (еюностомия).
Однао еюностомия не пользуется популярностью среди хирургов. Это связано с тем, что введение зонда, значительно суживающего просвет кишки, вызывает застой и создает условия для вытекания кишечного содержимого.
Ко второму типу паллиативных операций относятся паллиативные резекции. Эти операции, в основном, выполняются при невозможности полного удаления метастазов в лимфатических узлах или в органах при удалимости первичной опухоли. Паллиативную резекцию желудка производят главным образом в целях увеличения эффективности последующей лучевой и химиотерапии.
Противопоказаниями к проведению паллиативной резекции являются: метастазы в брюшину, брыжейку, сальник, асцит; отдаленные метастазы в кости, головной мозг, легкие и т.д., тяжелое общее состояние больного.
Паллиативное удаление первичного очага позволяет уменьшить массу опухоли и, тем самым, снизить токсическое ее влияние на организм больного, устранить источник непроходимости и кровотечения, что позволяет больному жить некоторое время с метастазами. В основном паллиативные резекции выполняются с целью дальнейшего проведения химио- и лучевой терапии Обходные анастомозы, гастро- и еюностомы также облегчают проведение лекарственного лечения, поскольку ослабленный голодом больной не в состоянии выдержать лечение. Улучшение состояния пациента после начала питания через стому в дальнейшем позволит применить химиотерапию. Техника таких операций такая же, как и обычной резекции желудка, но без удаления лимфатических узлов или метастазов.Химиотерапию в чистом виде применяют только при неоперабельных формах рака. Попытки продлить жизнь этих больных с помощью полнили монохимиотерапии показали эффективность 5-фторурацила и фторафура. 5-Фторурацил вводят внутривенно из расчета 15 мг/кг через день в суммарной дозе на курс лечения 4—5 г. Фторафур назначают по 30 мг/кг внутривенно или внутрь, рекомендуется суточную дозу делить на 2 приема, ориентировочная суммарная доза — 20—30 г. Повторные курсы химиотерапии проводят через 4—6 нед.
Химиотерапия позволяет добиться частичной регрессии опухоли у 20—30% больных. Средняя продолжительность жизни больных, перенесших паллиативную дистальную резекцию желудка, при проведении им химиотерапии составляет 23,3±3,6 мес, а если химиотерапия не назначалась — только 12,9±2,8 мес.
Профилактическая химиотерапия может проводиться у радикально оперированных больных раком желудка. Дополнительное лечение 5-фторурацилом в дозе 15 мг/кг через день (по 3 г суммарно) назначают через 1 и 3 мес после радикальной операции. Это лечение уменьшает частоту рецидивов и метастазов.
Химиотерапия перечисленными препаратами может сопровождаться рядом побочных явлений, среди которых основное значение имеет угнетение кроветворения (особенно белого ростка и тромбоцитов) и поражение слизистых оболочек желудочно-кишечного тракта. В этих случаях ограничивается возможность длительного лечения или применения высоких доз.
Дата добавления: 2016-07-18; просмотров: 3087;

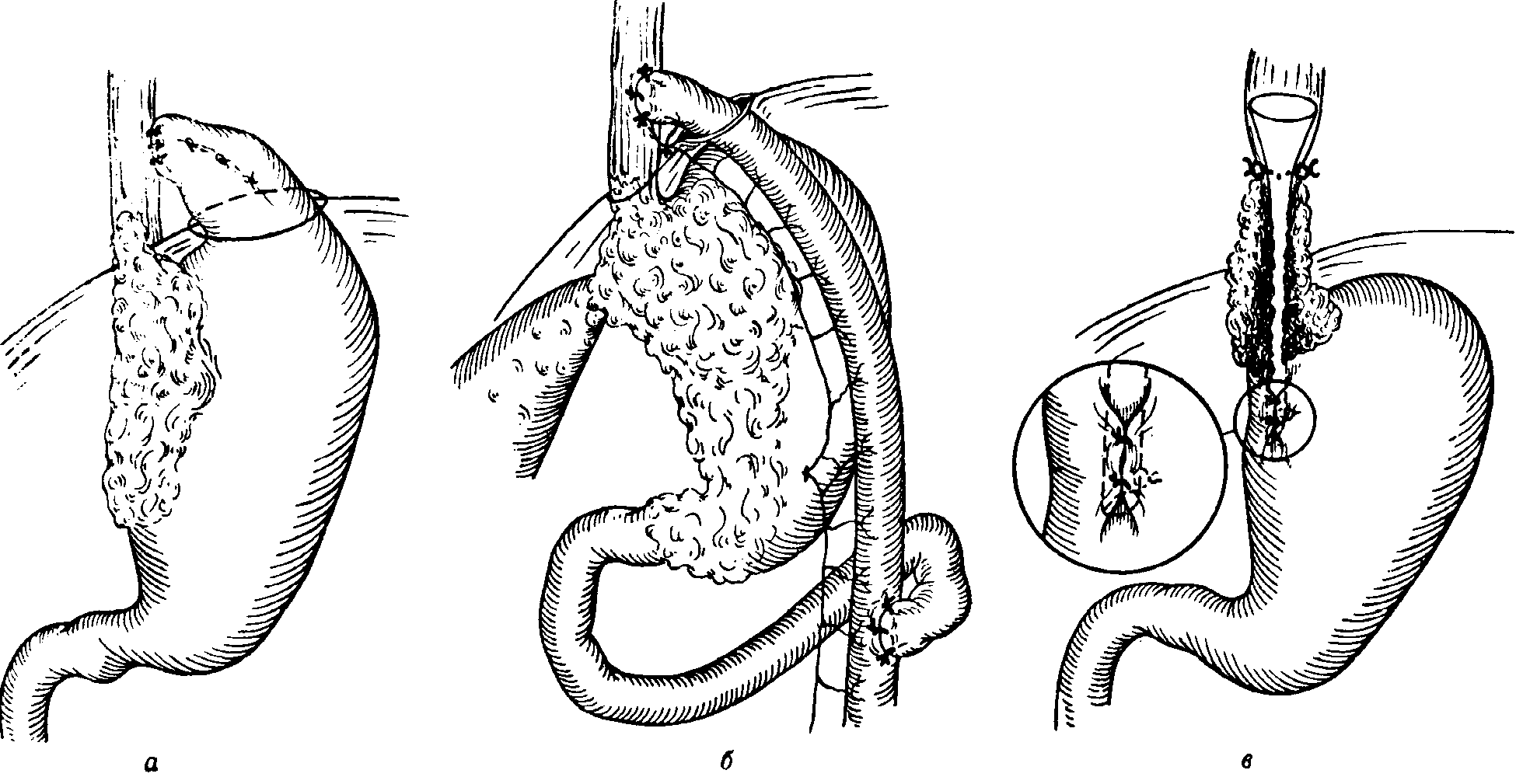
Рис.
3-169.
Паллиативные вмешательства при полностью
стенозирующих просвет нерезецируемых
опухолях кар-дии. а)
Обходной анастомоз между пищеводом и
дном желудка; б)
анастомоз между пищеводом и У-образной
петлей тонкой кишки по
Roux;
в) введение
синтетической трубки через стенозированный
опухолью пищевод
операций наилучшее восполнение этой
функции осуществляется по методу
Seoи его сотрудников(1952).При этой операции
используются участки толстой и
подвздошной кишок, которые вставляются
между пищеводом и двенадцатиперстной
кишкой. Это вмешательство имеет те
недостатки, что продолжительность
операции намного увеличивается и
возрастает возможность нарушения
стерильности. Опыт показывает, что
резервуарная функция развивается
раньше или позже в отделе кишки, идущей
от пищевода. На протяжении нескольких
лет просвет тонкой кишки может увеличиться
в несколько раз.
На практике можно считать, что любая
реконструктивная операция является
хорошей, при которой достаточно
используется и улучшается резорбционная
поверхность тонкой кишки, а также
препятствуется возможность возникновения
регургитации щелочного содержимого
кишки в пищевод. Эти два условия в
основном выполняются при тех оперативных
вмешательствах, когда между пищеводом
и двенадцатиперстной кишкой в
изоперистальтическом направлении
помещают петлю кишки (тонкой кишки,
подвздошно-толсто-кишечный сегмент).
К этому следует добавить, что вставляемая
часть петли кишки должна быть достаточной
длины. Наряду с этим бывает, что проходят
многие годы после операции и больные,
у которых двенадцатиперстная кишка и
первые сантиметры тонкой кишки не
служат резорб-ционной поверхностью,
несмотря на это находятся в отличном
состоянии.
В литературе можно встретить большое
число описаний состояния «отсутствующей
емкости желудка» после гастрэктомии.
Автор этих строк считает себя вправе,
исходя из собственного опыта, на основе
более чем 180операций,
высказать мнение о том, что больные
даже после тотальной гастрэктомии
могут благополучно существовать и быть
работоспособными, если нет рецидива
канцероматозного процесса и реконструкция
пищеварительного тракта выполнена по
всем правилам.
Во время операции у больного, страдающего
полной и частичной непроходимостью
пищи по пищеводу вследствие ракового
процесса, радикальная операция может
оказаться невыполнимой и возникает
вопрос об иноперабильнос-ти. Следует
во всех случаях все же пытаться
восстановить проходимость пищи. Из
большого числа имеющихся методов, о
которых будет сказано дальше; надо
выбирать наиболее подходящие для
каждого данного конкретного случая.
Паллиативная резекция кардии
Может оказаться, что кардия поражена
первичным капцероматозным процессом,
который, однако, занимает небольшую
поверхность и не
связан с окружающими тканями, но имеются
уже отдаленные метастазы. В таких
случаях наиболее подходящим паллиативным
вмешательством является резекция
карциномы, нарушавшей пассаж пищи. При
этом, само собой разумеется, что удаляется
большой и малый сальник, а также
селезенка. Методика осуществления
паллиативной резекции и реконструкции
описана на стр. 214.
Обходной анастомоз между пищеводом и желудком
При отсутствии
поражения опухолевым процессом дна
желудка и верхней трети большой кривизны
выводят дно желудка через отдельно
наложенное вблизи от хиатуса пищевода
отверстие в грудную полость и накладывают
эзофаго-фундостомию по типу «бок в бок»
(рис.
3-169(1).
Обходной анастомоз между пищеводом и y-образной тонкокишечной петлей по Roux
Наложение обходного анастомоза с
использованием петли тонкой кишки по
Rouxвозможно даж^
ч^гда, когда весь желудок поражен
карциномой и на его поверхности нет
свободного от опухоли места. Этот
обходной анастомоз может обеспечить
прохождение пищи в тех критических
ситуациях, когда такие паллиативные
меры, как введение синтетической трубки
в просвет пищевода или гастростомия
невозможны(рис. 3-1696).
Петлю тонкой кишки формируют,
какэто-иЗло-жено на стр. 191.При этом петля кишки протягивается
вверх, в грудную клетку, к пищеводу,
часто даже впереди поперечноободочной
кишки и желудка через отдельное отверстие
в диафрагме. Можно не опасаться, что в
послеоперационный
период возникнет расширение желудка
или толстой кишки, которое могло бы
вызвать сдавливание петли по
Rouxи нарушить
прохождение по ней пищи. Такому расширению
препятствует опухолевая инфильтрация
и делает его практически невозможным.
Проведенная через прорезанное в
диафрагме круглое отверстие тонкая
кишка протягивается вверх в грудную
полость. Между боком расширенного
пищевода и концом петли тонкой кишки
по Rouxнакладывается анастомоз по типу «бок
в конец». Для наложения анастомоза
пищевод вскрывается в поперечном
направлении, а швы накладываются по
методике, как это изложено на стр.
193.
Нередко бывает, однако, проще пересечь
в пределах здоровых тканей пищевод в
поперечном направлении, дистальную
культю зашить, а анастомоз наложить по
изложенной выше методике между оральным
концом и петлей по Roux.
Протягивание синтетической трубки через сужение пищевода, вызванное раковой опухолью
Для введения в суженный опухолевым
процессом пищевод синтетической трубки
должно быть достаточное, свободное от
опухоли место в стенке желудка для
гастротомии. После вскрытия просвета
желудка через это отверстие и кардию
проводят узкий буж или соответствующий
зонд, конец которого при его продвижении
вверх выйдет из полости рта. К выведенному
из полости рта концу бужа или зонда
анестезиолог прикрепляет синтетическую
трубку, которая затем, как это описано
на стр. 207,протягивается
через суженный карциномой пищевод.
Нижний конец трубки прикрепляется
1—2швами к малой кривизне желудка(рис. 3-169в).Гастротомический разрез
зашивается двухрядным швом.
172
Соседние файлы в папке 0912
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Оглавление темы «Операции при раке поджелудочной железы.»:
- Показания для панкреатикодуоденэктомии по Уипплу
- Доступ и ход операции панкреатикодуоденэктомии по Уипплу
- Показания для обходных анастомозов при неудалимом раке поджелудочной железы
- Доступ и ход операции обходного анастомоза при раке поджелудочной железы
- Показания для дистальной панкреатэктомии при раке поджелудочной железы
- Доступ и ход операции дистальной панкреатэктомии при раке поджелудочной железы
- Показания для центральной панкреатэктомии с панкреатикогастростомией
- Доступ и ход операции центральной панкреатэктомии с панкреатикогастростомией
Доступ и ход операции обходного анастомоза при раке поджелудочной железы
Вмешательство можно выполнить либо через двусторонний подрёберный доступ, либо через верхнюю срединную лапаротомию. Мы предпочитаем выполнение позадиободочной гастроеюностомии. В прошлом основным обходным желудочным анастомозом при неоперабельном периампулярном раке была впередиободочная гастроеюностомия.
После такой операции нередко возникала задержка опорожнения желудка, вследствие чего больные, не имевшие дуоденальной обструкции или застоя желудочного содержимого до операции, вынуждены были оставаться в стационаре на долгое время для лечения этого осложнения. Позже мы стали выполнять позадиободочную гастроеюностомию. Прооперировав более 200 больных, мы лишь в немногих случаях столкнулись с задержкой опорожнения желудка.
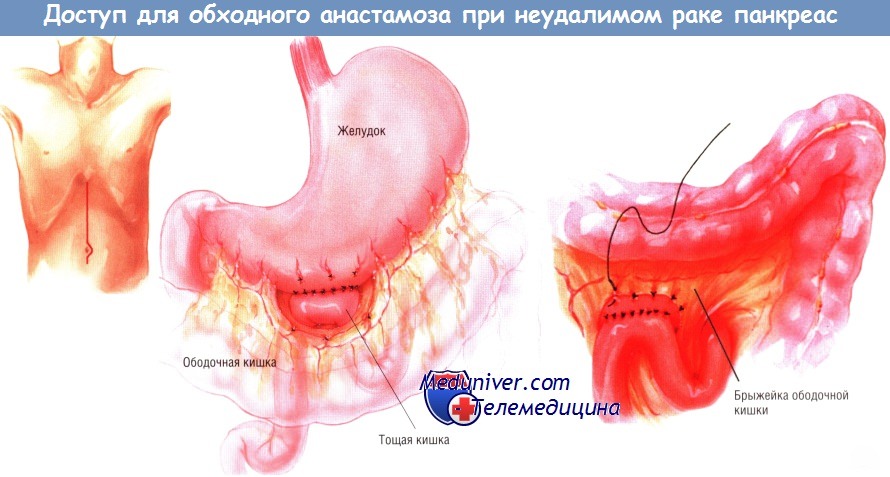
Большую кривизну желудка отделяют от сальника в наиболее свисающей области. После этого проксимальную петлю тощей кишки, расположенную чуть ниже связки Трейтца, протягивают кверху через отверстие в брыжейке поперечной ободочной кишки и накладывают гастроеюноанастомоз «бок в бок».
Внутренний непрерывный ряд швов создают синтетической рассасывающейся нитью № 3/0, тогда как наружный ряд отдельных узловых швов делают шёлком № 3/0. Соустье прикрепляют к отверстию в брыжейке ободочной кишки со стороны желудка, чтобы исключить образование внутренней грыжи, в которой могут ущемиться петли тонкой кишки.
Следующую петлю тощей кишки проводят наверх через отдельное отверстие в брыжейке поперечной ободочной кишки. Выполняют холецистэктомию, если она не была сделана ранее. Пересекают общий желчный проток и прошивают дистальный конец желчного дерева. После этого выполняют гепатикоеюностомию «конец в бок» одним рядом одиночных узловых швов синтетической рассасывающейся нитью № 4/0. Эта петля должна быть не меньше 45 см длиной.
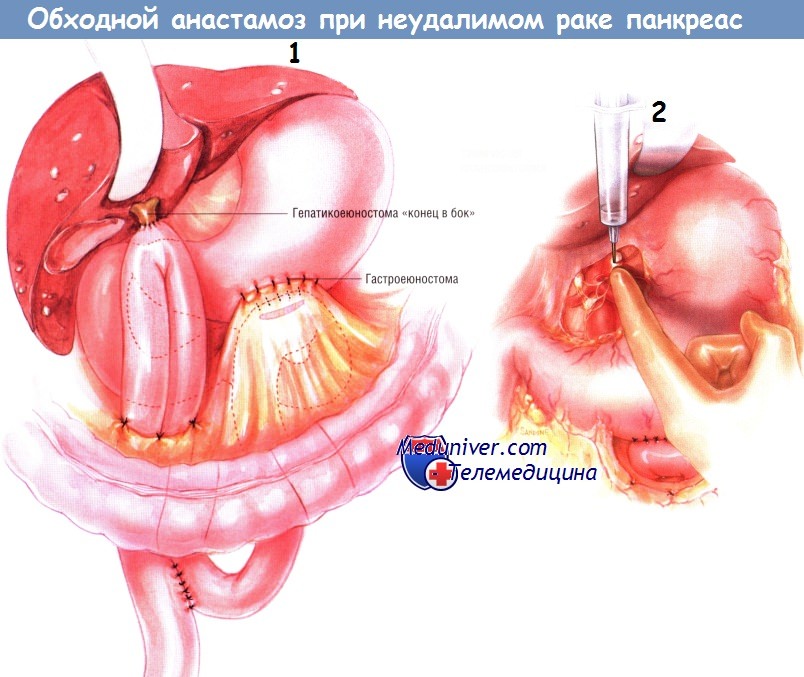
В её основании, между приводящей и отводящей кишками, делают анастомоз «бок в бок», расположенный ниже отверстия в брыжейке ободочной кишки. Внутреннюю линию швов этого соустья делают рассасывающейся синтетической нитью № 3/0, а наружную — одиночными узловыми шёлковыми швами № 3/0. Обе (приводящую и отводящую) ветви кишечника прикрепляют к отверстию в брыжейке поперечной ободочной кишки и друг к другу серией одиночных узловых швов шёлком № 4/0.
Химическая спланхнэктомия — рутинный этап данной операции. Её выполняют, инъецируя 20 мл 50% спирта по бокам от аорты на уровне чревного ствола. В результате происходит перерыв чревных нервов, идущих к чревному сплетению. Результаты химической спланхнэктомии были оценены в проспективном рандомизированном двойном слепом исследовании и свидетельствуют о том, что она уменьшает боли или предупреждает их возникновение в последующем.
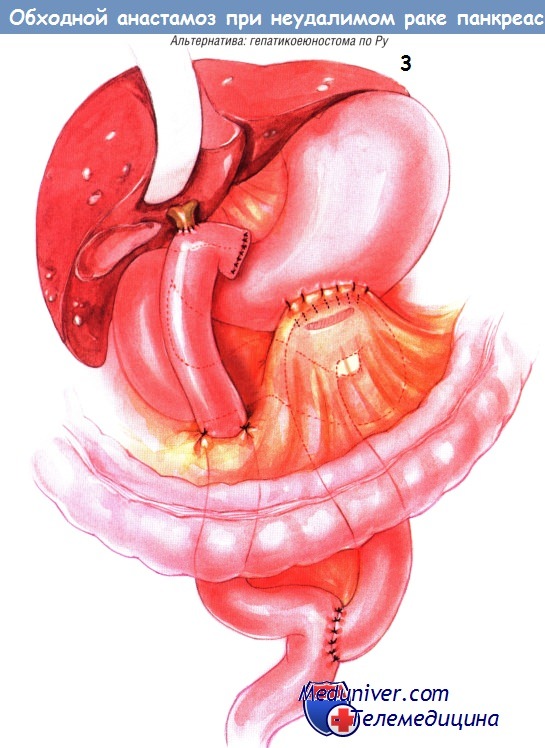
Альтернативный способ создания двойного обходного соустья — создание У-образного анастомоза по Ру дистальнее гастроеюностомы. Целостность пищеварительного тракта восстанавливают еюноеюностомией «бок в бок», её внутренний шов — непрерывный, из рассасывающегося синтетического материала, а наружный — из одиночных узловых швов шёлком № 3/0. Бранша анастомоза по Ру должна быть около 60 см длиной. Повторим вновь, что выполняют холецистэктомию и пересечение общего желчного протока. Дистальный отдел протока прошивают и перевязывают.
Гепатикоеюноанастомоз «конец в бок» выполняют одним рядом одиночных узловых швов синтетической рассасывающейся нитью № 4/0. Браншу анастомоза по Ру подшивают к отверстию в брыжейке поперечной ободочной кишки одиночными швами шёлком № 4/0.
— Также рекомендуем «Показания для дистальной панкреатэктомии при раке поджелудочной железы»
При раке желудка выполняют два типа паллиативных операций. При первом типе вмешательств операция, не устраняя очага поражения, направлена на улучшение питания и общего состояния больного. Такими операциями являются обходной анастомоз между желудком и тонкой кишкой — гастроэнтероанастомоз, гастро- и еюностомии. При втором типе операций удаляется первичный очаг опухоли или метастазы. К таким операциям относятся паллиативные резекции, паллиативные гастрэктомии и удаление метастазов.
Гастроэнтеростомия (наложение гастроэнтеростомоза)
Желудочно-кишечный анастомоз накладывается при иноперабельном раке выходного отдела желудка, и эта операция является наиболее частым паллиативным вмешательством. Смысл операции заключается в создании соустья между желудком и тощей кишкой. В настоящее время выполняют заднюю — позадиободочную, реже переднюю — впередиободочную гастроэнтеростомию. В первом случае через отверстие в брыжейке поперечно-ободочной кишки выводят заднюю стенку желудка и соединяют анастомозом с петлей тонкой кишки. Во втором варианте, петлю кишки проводят впереди от поперечно-ободочной кишки, прикладывают к передней стенке желудка и соединяют с ним соустьем. В 8-10 см ниже гастроэнтероанастомоза обычно накладывается межкишечный брауновский анастомоз.
Гастростомия
Операцию применяют при неоперабельном раке проксимального отдела желудка и пищевода, сопровождающемся нарушением проходимости пиши. Предложено более ста модификаций этой операции. Наибольшее распространение получила гастростомия по Кадеру и Витцелю.
Энтеростомия
Кишечный свищ или энтеростому накладывают для обеспечения питания больного при раке желудка и создания проходимости пищеварительного тракта. Операция также производится при обширном поражении желудка с нарушением проходимости и невозможности наложить гастростому. Подобная операция является единственным средством помочь неоперабельному больному раком резецированного желудка. Чаще искусственный свищ создается в начальном отделе кишечника (еюностомия).
Однако еюностомия не пользуется популярностью среди хирургов. Это связано с тем, что введение зонда, значительно суживающего просвет кишки, вызывает застой и создает условия для вытекания кишечного содержимого.
Ко второму типу паллиативных операций относятся паллиативные резекции. Эти операции, в основном, выполняются при невозможности полного удаления метастазов в лимфатических узлах или в органах при удалимости первичной опухоли. Паллиативную резекцию желудка производят главным образом в целях увеличения эффективности последующей лучевой и химиотерапии.
Противопоказаниями к проведению паллиативной резекции являются: метастазы в брюшину, брыжейку, сальник, асцит; отдаленные метастазы в кости, головной мозг, легкие и т.д., тяжелое общее состояние больного.
Паллиативное удаление первичного очага позволяет уменьшить массу опухоли и, тем самым, снизить токсическое ее влияние на организм больного, устранить источник непроходимости и кровотечения, что позволяет больному жить некоторое время с метастазами. В основном паллиативные резекции выполняются с целью дальнейшего проведения химио- и лучевой терапии Обходные анастомозы, гастро- и еюностомы также облегчают проведение лекарственного лечения, поскольку ослабленный голодом больной не в состоянии выдержать лечение. Улучшение состояния пациента после начала питания через стому в дальнейшем позволит применить химиотерапию. Техника таких операций такая же, как и обычной резекции желудка, но без удаления лимфатических узлов или метастазов.
Отдаленные результаты хирургического лечения рака желудка зависят от стадии заболевания, гистологической структуры опухоли и своевременности начатого лечения. При начальных формах рака 5-летняя выживаемость составляет в среднем свыше 90 %, 10-летняя — 75 %. Однако более половины пациентов раком желудка поступают на лечение в запущенном состоянии, когда радикальная операция возможна лишь у 30-40 % всех больных. В целом при экспансивном раке 5-летняя выживаемость достигает 40-45 %, при инфильтративном — 3-5 %. Наличие метастазов или прорастание серозной оболочки желудка в 2-3 раза ухудшает результаты. После гастрэктомии и проксимальной резекции 5 лет живут 20-25 % радикально оперированных. Средняя продолжительность жизни больных после радикальной операции по поводу осложненного перфорацией и кровотечением рака составляет до 30 месяцев.
Неудовлетворительные результаты хирургического метода лечения рака желудка явились предпосылкой к разработке комбинированного метода лечения. Резекция желудка или гастрэктомия производится в сочетании с лучевым или химиотерапевтическим воздействием на опухоль в пред- или послеоперационном периоде. Однако высокая радиорезистентность рака желудка ограничивает применение лучевой терапии. Лучевую терапию рака желудка в основном проводят при локально контролируемых формах — при кардиальном и кардиоэзофагеальном раке, при котором риск развития лучевого повреждения относительно невелик и предсказуем. Предоперационное облучение по интенсивной методике может увеличить количество радикальных вмешательств и показатели 5-летней выживаемости.
Наиболее эффективными препаратами при лечении больных раком желудка являются 5-фторурацил, митомицин С, адриамицин, этопозид, препараты платины. В большинстве случаев рак желудка также является химиорезистентнои опухолью, а системная внутривенная химиотерапия больных раком желудка в настоящее время не имеет перспектив в связи с низкой концентрацией препаратов в опухоли. Поэтому важным подходом при лечении больных раком желудка являются способы введения и доставки химиопрепаратов к опухолевому очагу. Наиболее адекватным путем доставки химиопрепаратов к раковой опухоли является их прямое введение в сосуды, питающие опухоль, через катетер, установленный в правой желудочно-сальниковой или левой желудочной артерии. Такая терапия, называемая внутриартериальной неоадъювантной полихимиотерапией (ВАПХТ), может выполняться не только на предоперационном этапе лечения, но и у неоперабельных больных. При сравнении эффективности лечения больных раком желудка оказалось, что наибольшая, 10-летняя, выживаемость была достигнута при применении селективной ВАПХТ с последующей операцией (64 %) и практически не менялась при системной химиотерапии с последующей операцией и только лишь хирургическом лечении (28 %).
При лечении рака желудка также могут быть использованы методы непосредственного ввеедения цитостатиков в опухоль и вокруг нее во время фиброгастроскопии, внутрибрюшинно при лапароскопиях и во время выполнения радикальной операции.
Очень важное значение для повышения чувствительности раковых клеток к химио- и лучевой терапии имеет использование модифицирующих факторов. К методам, усиливающим воздействие химиопрепаратов у больных раком желудка, относится локальная гипертермия. Локальное прогревание рака желудка (СВЧ-гипертермия) при температуре 43-44°С вызывает повреждение резистентных опухолевых клеток, не относящихся к пролиферативному пулу или находящихся в зоне гипоксии ткани, не затрагивая нормальные клетки. К модификаторам химио- и лучевой терапии следует отнести действие вихревых магнитных полей, сверхнизких температур, иммунотерапию (препараты производные интерлейкинов и интерферона), использование искусственной гипергликемии. В настоящее время предложена большая группа модификаторов различного механизма действия — левамизол, лейковорин, интерферон, Т-активин, церулоплазмин, курантил, амфотерицин, циметидин, дрожжевые полисахариды, антиоксидантные комплексы, энзимы, фитоадаптогены. Благодаря адекватной доставке химиопрепаратов к опухоли и применению модуляторов, при лечении рака желудка становится вполне возможным перевод рака желудка из «нерезектабельного» в «резектабельное» состояние.


