Неоадъювантная терапия рака желудка

В последние десятилетия в мировом масштабе наблюдается устойчивая тенденция по снижению заболеваемости раком желудка (РЖ), особенно низкие показатели отмечены среди белого населения США, а также в Австралии, Канаде. Однако в государствах Юго-Восточной Азии, Латинской Америки, странах бывшего СНГ эта нозология остается среди наиболее распространенных злокачественных новообразований [1]. В России в общей структуре онкологической заболеваемости РЖ переместился на 4-е ранговое место после злокачественных опухолей кожи, рака легкого и молочной железы, в 2012 г. выявлено 35 597 новых случаев Р.Ж. При этом эффективность ранней диагностики по-прежнему крайне низка: РЖ I стадии диагностирован у 9,3% больных, местно-распространенный (II—III стадии) — у 46,0%, диссеминированный — в 39,3% впервые выявленных случаев. Такая ситуация негативно сказывается на результатах лечения. Так, показатели летальности в течение 1 года с момента установления диагноза у больных РЖ с 2002 по 2012 г. не претерпели существенных положительных изменений, составляя 55,3 и 49,8% соответственно [2, 3].
Внедрение современных хирургических технологий с расширенной перигастральной лимфаденэктомией привело к определенному улучшению отдаленных результатов лечения больных резектабельным Р.Ж. По данным ведущих зарубежных клиник, прежде всего японских, а также отечественных лечебных учреждений, в которых накоплен наибольший опыт радикальных операций с лимфаденэктомией D2, 5-летняя выживаемость больных РЖ без учета стадии достигает 56,3—65,1%. Однако у пациентов с местно-распространенным РЖ, особенно при метастатическом поражении регионарных лимфатических узлов (РЛУ), эти показатели снижаются до 24—36% [4—6]. По данным нашей клиники, после радикальных операций с лимфаденэктомией D2 у больных РЖ с реализовавшейся лимфогенной диссеминацией уровень общей 5-летней выживаемости составил 37% при N1 и 11% при N2 [7]. Таким образом, операции при местно-распространенных новообразованиях следует считать условно-радикальными. Очевидна необходимость разработки дополнительных терапевтических методов воздействия, точкой приложения которых будут являться невыявленные, а следовательно, и неудаленные метастазы, что в конечном итоге предполагает предупреждение диссеминации опухолевого процесса [8].
Теоретическая целесообразность комбинированного лечения с предоперационной (неоадъювантной) химиотерапией (НАХТ) в целом и по поводу местно-распространенного РЖ в частности не вызывает сомнений. Ее преимуществами являются возможность уменьшения размера опухоли и повышение резектабельности, снижение биологической активности опухолевых клеток и риска интраоперационной диссеминации, возможность оценки эффекта лечения in vivo, лучшая переносимость по сравнению с послеоперационной химиотерапией [9, 10]. Однако на практике неоадъювантная терапия применяется редко, что во многом связано с устоявшейся точкой зрения о высокой резистентности РЖ к цитостатической терапии и значительной токсичностью последней, а это может негативно сказаться на репаративных процессах в послеоперационном периоде [11]. В то же время ряд современных химиопрепаратов, таких как оксалиплатин, иринотекан, капецитабин, имеют умеренную и хорошо контролируемую токсичность, в клинических исследованиях доказана их эффективность и удовлетворительная переносимость при лечении метастатического РЖ [12], что позволяет включить их в схему комбинированного лечения местно-распространенного РЖ [13, 14].
Цель исследования — оценить эффективность НАХТ при комбинированном лечении больных местно-распространенным РЖ.
В исследование были включены 62 пациента с морфологически подтвержденным диагнозом РЖ, которые получили лечение в торакоабдоминальном отделении ФГБУ «НИИ онкологии» СО РАМН за период с 2009 по 2012 г. Возраст больных колебался от 47 лет до 71 года, средний возраст составил 57,4 года. Из них мужчин было 41 (66,1%), женщин — 10 (33,9%). Всем больным до начала лечения проведено комплексное обследование, включающее полипроекционную рентгенографию органов грудной клетки, пищевода и желудка; эзофагогастродуоденоскопию с биопсией, эндоскопическую ультрасонографию; УЗИ органов брюшной полости и малого таза; компьютерную томографию органов брюшной полости с контрастированием. В большинстве случаев процесс был верифицирован как аденокарцинома умеренной или низкой степени дифференцировки — в 52 (83,8%) наблюдениях, недифференцированный или перстневидно-клеточный РЖ диагностирован у 10 (16,1%) больных. Завершающим этапом диагностики являлась диагностическая лапароскопия, пациенты включались в исследование при исключении признаков перитонеальной диссеминации опухолевого процесса. По результатам обследования во всех случаях распространенность опухоли была расценена как T3—4NxM0.
В соответствии с целью исследования больные были разделены на 2 группы.
В основной группе (n=29) проводили комбинированное лечение, на первом этапе которого все больные получили 2 курса НАХТ по схеме FOLFOX: оксалиплатин в дозе 85 мг/м2 в 1-й день в виде 2-часовой внутривенной инфузии; лейковорин в дозе 200 мг/м2 в 1-й и 2-й дни в виде 2-часовой внутривенной инфузии; 5-фторурацил в дозе 400 мг/м2 в 1-й день внутривенно болюсно, затем в дозе 2400 мг/м2 в виде 46-часовой внутривенной инфузии. Перерыв между курсами составил 2 нед. Радикальную операцию выполняли через 3 нед после завершения второго курса НАХТ с предварительной оценкой эффективности проведенной химиотерапии по критериям ВОЗ (полная или частная регрессия, стабилизация, прогрессирование).
В контрольной группе (n=33) пациентам выполняли радикальное хирургическое лечение в монорежиме.
Кроме оценки непосредственной эффективности предоперационной химиотерапии, в настоящем исследовании изучали частоту и степень тяжести побочных реакций НАХТ, частоту послеоперационных осложнений, уровень отдаленной (2-летней) выживаемости. Отдаленные результаты анализировали без учета послеоперационной летальности.
Исследование проводили в соответствии с Хельсинкской декларацией 1964 г. (исправленной в 1975 и 1983 г.) и с разрешения локального этического комитета ФГБУ «НИИ онкологии» СО РАМН. Были получены информированные согласия пациентов.
Полученные данные обрабатывались с использованием стандартных пакетов программ статистического анализа Statistica 7.0.
Все пациенты основной группы завершили запланированный курс лечения в полном объеме и в установленные сроки. На этапе предоперационной химиотерапии побочные реакции отмечены у 9 (31,0%) больных, превалировали эметогенные осложнения (20,6%), в основном в виде тошноты I—II степени, которые не требовали перерыва курса НАХТ и хорошо купировались стандартной терапией сопровождения. Серьезных гематологических осложнений не было, у 7 (24,1%) больных выявлена лейкопения I степени, у 3 (10,3%) — анемия I степени, последняя, вероятнее всего, была связана с проявлениями основного заболевания, а не с назначением цитостатической терапии. Во всех случаях побочные реакции не требовали перерыва курсов химиотерапии и купировались стандартной терапией сопровождения. Таким образом, проводимые курсы НАХТ по схеме FOLFOX отличались удовлетворительной переносимостью и низким уровнем токсичности, что не оказало негативного влияния на хирургический компонент комбинированного лечения РЖ.
При анализе хирургического этапа комбинированного лечения в основной группе установлено, что оперативные вмешательства выполняли в запланированные сроки — через 3 нед после завершения НАХТ. При этом вид оперативного пособия определяли по результатам первичного обследования, проведенного до химиотерапии, уменьшения объема вмешательства, даже при значительной или полной регрессии опухоли после НАХТ, не проводили.
В основной группе резектабельность составила 100%, в большинстве случаев выполнены радикальные операции — 93,1% (табл. 1). У 1 (3,5%) больной после гастрэктомии при гистологическом исследовании операционного материала были обнаружены клетки опухоли по проксимальной границе резекции — операция R1, у 1 (3,5%) пациента при интраоперационной ревизии был выявлен ранее недиагностированный метастатический очаг в правой доле печени, была выполнена субтотальная резекция желудка — операция R2. В контрольной группе все операции по радикальности соответствовали критерию R0.
 Таблица 1. Объем и характер выполненных операций в сравниваемых группах
Таблица 1. Объем и характер выполненных операций в сравниваемых группах
Объем выполненных операций в сравниваемых группах оказался одинаковым (см. табл. 1), более чем у половины больных осуществлена гастрэктомия. Во всех случаях выполнена перигастральная лимфаденэктомия D2 с обязательной круговой диссекцией гепатодуоденальной связки, количество удаленных лимфатических узлов в сравниваемых группах было одинаковым.
В послеоперационном периоде осложнения возникли у 9 больных в каждой из групп, что составило 31,0 и 27,3% соответственно (p>0,05). В большинстве случаев они проявлялись реактивным плевритом слева, в основном после комбинированных операций с резекций смежных органов. В контрольной группе чаще выявляли осложнения гнойно-воспалительного характера, что в 3 (9,1%) случаях потребовало выполнения релапаротомии и дополнительного дренирования брюшной полости, в дальнейшем эти явления были купированы. В основной группе повторных операций не выполняли. У 24,2% больных, на 2—5-е сутки после операции, отмечали подъем уровня амилазы крови, однако это не сопровождалось клинической манифестацией послеоперационного панкреатита и купировалось назначением ингибиторов протеаз и октреотида по разработанной в клинике методике [15]. В раннем послеоперационном периоде умерли 2 больных, по одному пациенту в каждой группе, летальность оставила 3,5 и 3,0% соответственно (p>0,05). Причинами явились нехирургические осложнения: в основной группе летальный исход был следствием острого трансмурального инфаркта миокарда, который развился на 5-е сутки после субтотальной резекции желудка; в контрольной — массивная тромбоэмболия легочной артерии, возникшая на 3-е сутки после гастрэктомии. Таким образом, проведение 2 курсов НАХТ по схеме FOLFOX у больных РЖ не оказывало влияния на течение периоперационного периода, частота, характер и степень тяжести послеоперационных осложнений определяются иными факторами, в первую очередь объемом выполненного хирургического вмешательства и исходным соматическим состоянием больного.
Как было указано, стратификация больных по стадиям опухолевого процесса осуществлялась с учетом данных гистологического исследования операционного материала. Распределение по стадиям (классификация TNM, 7-я редакция, 2009) [16] представлено в табл. 2. Обращает на себя внимание, что у больных основной группы опухолевый процесс имеет меньшую распространенность, чем в контрольной группе, несмотря на то что на этапе предоперационной диагностики первичная опухоль во всех случаях была расценена как местно-распространенный Р.Ж. По нашему мнению, это связано с феноменом «downstaging» в процессе предоперационной химиотерапии, уменьшение стадии до pT0—2N0M0 зафиксировано в 10 (34,5%) наблюдениях. Действительно, при оценке непосредственной эффективности НАХТ и выраженности лечебного патоморфоза в основной группе было установлено, что полная, морфологически подтвержденная регрессия опухоли (лекарственный патоморфоз IV степени) зарегистрирована в 3 (10,3%) случаях, частичная регрессия — в 18 (62,1%), стабилизация процесса — в 7 (24,1%), прогрессирование заболевания (метастатическое поражение печени, выявленное при интраоперационной ревизии) — в 1 (3,4%) наблюдении.
 Таблица 2. Распределение по стадиям в сравниваемых группах с учетом морфологического исследования операционного материала
Таблица 2. Распределение по стадиям в сравниваемых группах с учетом морфологического исследования операционного материала
Сроки динамического наблюдения после лечения составили 12—42 мес, большинство больных наблюдаются более 24 мес. За время мониторинга в основной группе прогрессирование опухолевого процесса зарегистрировано у 5 больных через 6—15 мес после операции, что реализовалось в виде гематогенных метастазов или перитонеальной диссеминации. Локорегиональный рецидив в течение первого года после лечения возник у 1 больной, перенесшей R1-операцию. Неблагоприятными факторами прогноза оказались метастатическое поражение печени, операция R2 (1 больной), операция R1 (1 больная), переход опухоли на пищевод (2 больных), распространенность опухолевого процесса T4a—bN2—3 (4 больных). У 4 пациентов было сочетание нескольких неблагоприятных признаков. В контрольной группе в отдаленные сроки наблюдения местных рецидивов не было, однако отдаленные метастазы в 1-й год наблюдения развились у 6 больных, во 2-й год — у 3 пациентов. Таким образом, 1-годичная выживаемость в основной группе составила 85,7%, в контрольной — 81,3% (p>0,05). Значимые различия отдаленных результатов в сравниваемых группах больных появляются при анализе 2-летней выживаемости — 82,1 и 68,8% соответственно (p<0,05).
Приводим клиническое наблюдение местно-распространенного РЖ с полной морфологической регрессией опухолевого очага.
Пациентка П., 1958 г. р., поступила в торакоабдоминальное отделение ФГБУ «НИИ онкологии» СО РАМН 20.08.10. При комплексном обследовании диагностирован РЖ III стадии (T3N+M0). При ЭГДС (30.08.10) в антральном отделе желудка по передней стенке визуализируется язвенный дефект диаметром до 0,4 см, с радиально распространяющейся инфильтрацией протяженностью от нижней трети тела желудка до привратника, ткань при биопсии фрагментируется, умеренно кровоточит. Заключение: опухоль антрального отдела желудка, инфильтративно-язвенная форма роста. При эндоскопической ультрасонографии (01.09.10) опухоль выходного отдела желудка с возможной инфильтрацией серозной оболочки и прилежащих тканей. Результаты эндоскопического исследования были подтверждены при КТ органов брюшной полости; кроме того, в малом сальнике определялись увеличенные лимфатические узлы, один из них диаметром до 4 см (рис. 1). Гистологическое исследование биопсийного материала (11.08.10): низкодифференцированная аденокарцинома (рис. 2).
 Рис. 1. Компьютерные томограммы органов брюшной полости до начала комбинированного лечения. На левом скане стрелкой указана протяженность первичной опухоли, на правом скане — увеличенный перигастральный лимфатический узел.
Рис. 1. Компьютерные томограммы органов брюшной полости до начала комбинированного лечения. На левом скане стрелкой указана протяженность первичной опухоли, на правом скане — увеличенный перигастральный лимфатический узел.
 Рис. 2. Микрофото. Низкодифференцированная аденокарцинома желудка. Окраска гематоксилином и эозином, ×400.
Рис. 2. Микрофото. Низкодифференцированная аденокарцинома желудка. Окраска гематоксилином и эозином, ×400.
Учитывая распространенность опухолевого процесса, больной проведено 2 курса предоперационной химиотерапии по схеме FOLFOX6. Лечение перенесла удовлетворительно, побочных реакций не наблюдалось. При контрольном обследовании перед операцией отмечено уменьшение размера опухоли с 6 до 3,1 см, размера лимфатического узла с 4 до 2,3 см, а также исчезновение более мелких перигастральных узлов (рис. 3).
 Рис. 3. Компьютерные томограммы органов брюшной полости через 2 нед после завершения 2-го курса неоадъювантной химиотерапии по схеме FOLFOX. Отмечается уменьшение размера первичной опухоли и перигастральных лимфатических узлов.
Рис. 3. Компьютерные томограммы органов брюшной полости через 2 нед после завершения 2-го курса неоадъювантной химиотерапии по схеме FOLFOX. Отмечается уменьшение размера первичной опухоли и перигастральных лимфатических узлов.
06.10.10 больной выполнена субтотальная дистальная резекция желудка, лимфаденэктомия D2. На макропрепарате в антральном отделе желудка, по малой кривизне, на фоне атрофичной слизистой оболочки определялся остаточный язвенный дефект диаметром менее 1 см, макроскопически измененных перигастральных лимфатических узлов не обнаружено (рис. 4). Послеоперационный период протекал без осложнений, заживление первичным натяжением. Больная выписана в удовлетворительном состоянии на 14-е сутки после операции.
 Рис. 4. Макропрепарат. На фоне атрофичной слизистой антрального отдела и нижней трети тела желудка определяется поверхностное изъязвление диаметром менее 1 см.
Рис. 4. Макропрепарат. На фоне атрофичной слизистой антрального отдела и нижней трети тела желудка определяется поверхностное изъязвление диаметром менее 1 см.
При плановом гистологическом исследовании операционного материала (19.10.10) хроническая язва желудка, воспалительная инфильтрация распространяется на всю стенку антрального отдела желудка, где выражен фиброз и лимфоплазмоцитарная инфильтрация. Клеток опухоли не обнаружено. Лекарственный патоморфоз IV степени. В лимфатических узлах синусовый гистиоцитоз.
При контрольном обследовании в марте 2014 г. признаков прогрессирования опухолевого процесса не выявлено.
Таким образом, НАХТ при местно-распространенном РЖ характеризуется хорошей переносимостью, не утяжеляет течение послеоперационного периода. Полученные отдаленные результаты позволяют считать предложенный метод весьма перспективным. Для окончательной оценки эффективности комбинированного лечения РЖ с применением НАХТ планируется продолжение данного исследования.
Участие авторов:
Концепция и дизайн исследования: С.Г.А.
Сбор и обработка материала: С.Г.А., А.В.А., И.М.Д., М.Ю.В.
Статистическая обработка: И.М.Д.
Написание текста: А.В.А.
Редактирование: С.Г.А.
Конфликт интересов отсутствует.
Новости онкологии
18.10.2012
С.А. Тюляндин
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Несмотря на то, что до настоящего времени хирургическое лечение остается главным методом лечения ранних стадий рака желудка, становится все более очевидным, что в большинстве случаев он представляет собой системное заболевание. Системность подтверждается неудовлетворительными результатами хирургического лечения больных I-III стадиями. Более чем у 50% из них после радикальной операции в последующем отмечается прогрессирование заболевания в основном за счет развития отдаленных метастазов.
Примерно у 30% больных раком желудка I-II стадий определяются циркулирующие опухолевые клетки в периферической крови и/или микрометастазы в костном мозге, наличие которых значимо увеличивает шанс развития отдаленных метастазов после операции. Все это делает обоснованным желание использовать системную терапию, в частности, химиотерапию, на предоперацинном или послеоперационном этапе у больных операбельным раком желудка для улучшения отдаленных результатов лечения.
Для оценки эффективности адъювантной терапии рака желудка в конце 1990-х – начале 2000-х годов было проведено несколько рандомизированных исследований, однако немногочисленность больных, включенных в эти исследования, и противоречивость их результатов не позволили сделать однозначного заключения о клинической целесообразности подобного подхода. Вместе с тем, проведенный мета-анализ этих исследований все же свидетельствовал о том, что проведение адъювантной терапии с включением фторпиримидинов может увеличивать 5-летнюю общую выживаемость на 4,8% (с 49,5% в группе хирургического лечения до 55,3% в группе комбинированного лечения, HR=0,82, р<0,001) [1].
Однако адъювантная терапия до сегодняшнего дня не является стандартным подходом в лечении больных раком желудка. И для этого есть несколько причин. Основной причиной является отсутствие эффективных препаратов и комбинаций для лечения рака желудка. Сегодня ни одна из используемых комбинаций для лечения метастатического рака желудка не позволяет достигнуть медианы продолжительности жизни ≥12 месяцев, что ставит под сомнение эффективность этих же комбинаций при использовании их в адъювантом режиме (с целью увеличения шанса на излечение).
Следствием этого является отсутствие единого мнения о стандарте проведения первой линии химиотерапии. В некоторых странах это комбинация цисплатина и капецитабина или инфузий 5-фторурацила, другие используют режим ЕСF (эпидоксорубицин, цисплатин, капецитабин) или ECF (эпидоксорубицин, цисплатин, капецитабин). Остается популярным назначение комбинации TCF (доцетаксел, цисплатин, 5-фторурацил). Все большую популярность завоевывает режим CAPOX (капецитабин+оксалиплатин).
Другая важная причина непопулярности адъювантной терапии – плохое общее состояние больных после перенесенной гастрэктомии, часто или всегда сопровождаемой лимфодиссекцией в разных объемах. На момент начала терапии большинство подобных больных имеют серьезный дефицит веса, который продолжает нарастать после операции в связи с нарушениями всасывания и развитием у части больных демпинг-синдрома. Проведение химиотерапии на этом фоне сопровождается частым развитием тяжелых осложнений, требующих снижения доз препаратов, увеличения интервалов или отказом от дальнейшего лечения. Все это приводит к потере потенциальной пользы от проведения адъювантной терапии больных раком желудка.
Однако результаты последних исследований заставляют по-новому оценить возможности адъювантной химиотерапии рака желудка. В исследовании японских авторов больным раком желудка II-III стадий выполняли гастрэктомию с лимфодиссекцией D2 с или без добавления в послеоперационном периоде препарата S-1 (комбинированный препарат, состоящий из фторафура и ингибиторов фермента дигидропиримидиндегидрогеназы, разрушающего фторпиримидины) в течение года [2]. В исследование было включено 1059 больных, и на сегодняшний день известны результаты 5-летнего наблюдения.
Общая 5-летняя выживаемость в группе, получившей только хирургическое лечение, составила 61,1%, а в группе адъювантной терапии – 71,7% (снижение относительного риска смерти на 33%, HR=0,67, р<0,05), 5-летняя безрецидивная выживаемость составила 53,1% и 65,4% соответственно (снижение относительного риска прогрессирования заболевания на 35%, HR=0,65, р<0,05). Лечение S-1 переносилось хорошо, основным проявлением токсичности было снижение аппетита. Нежелательные явления 3-4 степени выраженности наблюдалась лишь у 5% больных.
Закончили 12-месячный прием препарата 66% больных, из них у половины потребовалось снижения дозы. Подгрупповой анализ показал, что улучшение результатов лечения при назначение адъювантной терапии наблюдалось вне зависимости от стадии заболевания, морфологии опухоли, возраста и пола больных. На основании этих данных авторы сделали вывод о том, что годичная адъювантная терапия пероральным фторпиримидином S-1 улучшает результаты лечения больных раком желудка II-III стадии, подвергнутых гастрэктомии с лимфодиссекцией D2.
![Общая (А) и безрецидивная (B) выживаемость больных раком желудка после радикального хирургического лечения с или без адъювантной терапии S-1 [1]](https://rosoncoweb.ru/news/oncology/2012/10/18/image001.png)
Рисунок 1. Общая (А) и безрецидивная (B) выживаемость больных раком желудка
после радикального хирургического лечения с или без адъювантной терапии S-1 [1].
Другое исследование (CLASSIC) было также выполнено в странах Азии (Китай, Корея, Тайвань) у больных раком желудка после гастрэктомии и лимфодиссекции D2 [3]. В этом исследовании, в которое было включено 1035 больных, в качестве адъювантной терапии использовали комбинацию CAPOX (оксалиплатин в дозе 130 мг/м2 1 день и капецитабин в дозе 1000 мг/м2 внутрь 2 раза в день 1-14 дни, каждые 3 недели 8 курсов лечения). При среднем сроке наблюдения 34 месяца 3-летняя безрецидивная выживаемость составила 59% в группе только хирургического лечения и 74% в группе адъювантной терапии (снижение относительного риска прогрессирования на 44%, HR=0,56, р<0,0001).
Назначение химиотерапии сопровождалось развитием нежелательных явлений 3-4 степени у 56% больных (наиболее часто наблюдали нейтропению (22%), тромбоцитопению (8%), тошноту (8%) и рвоту (8%), слабость). Частота развития сенсорной нейропатии 1-2 степени составила 10%, и лишь у 3 больных это осложнение достигло 3 степени выраженности. Все 8 курсов терапии получили 67% больных, однако почти все они потребовали снижения дозы. Токсичность была причиной прекращения терапии у 10% больных.
Подгрупповой анализ показал, что польза от проведения адъювантной терапии отмечена у больных N1-2, мужчин и не зависела от стадии заболевания и возраста. Авторы данного исследования также сделали вывод о том, что проведение адъювантной терапии после гастрэктомии с лимфодиссекцией D2 уменьшает риск прогрессирования заболевания у больных раком желудка.
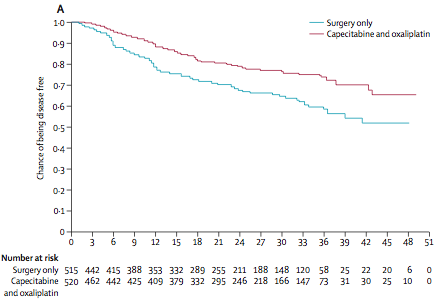
Рисунок 2. Безрецидивная выживаемость больных раком желудка
после хирургического лечения с или без проведения адъювантной терапии комбинацией CAPOX [2].
Картина адъювантых методов лечения рака желудка будет неполной без упоминания химиолучевой терапии. Американские коллеги в исследовании SWOG-0116 показали, что введение 5-фторурацила и лейковорина до, в процессе и после лучевой терапии на верхний этаж брюшной полости СОД 45 Гр улучшает показатели общей и безрецидивной выживаемости больных раком желудка Т3-4 и N+ после гастрэктомии и лимфодиссекции D0-1 [4].
Данная методика стала стандартной в США, где гастрэктомия зачастую не сопровождается расширенной лимфодиссекцией. Большинство комментаторов пришло к заключению, что проведение лучевой терапии в данном случае компенсирует недостаточный объем оперативного вмешательства. В другом, уже корейском исследовании (ARTIST) была предпринята попытка оценить целесообразность добавления лучевой терапии к адъювантной химиотерапии CAPOX у больных раком желудка после гастрэктомии и лимфодиссекции D2 [5].
Добавление лучевой терапии не улучшило результаты адъювантного лечения, хотя в группе больных с метастазами в регионарные лимфоузлы и была отмечена тенденция к улучшению безрецидивной выживаемости. Была предпринята попытка улучшения результатов химиолучевой терапии за счет замены 5-фторурацила и лейковорина на режим ECF [8]. Предварительный анализ показал отсутствие преимуществ при использовании более интенсивной химиотерапии.
В России проведение химиолучевой терапии при раке желудка в целом (включая местно-распространенные, неоперабельные опухоли) и в качестве адъювантной терапии в частности не пользуется популярностью. Во всяком случае, в моей практике не было ни одного больного, получившего данное лечение в нашей стране. Методика облучения верхнего этажа брюшной полости трудоемка, требует современных ускорителей и тщательного дозиметрического планирования.
Поэтому я не берусь обсуждать перспективы химиолучевого лечения при раке желудка в нашей повседневной практике. Тем более, что в России отмечается тенденция к увеличению числа больных, у которых гастрэктомия сопровождается лимфодиссекцией D2, после которой проведение химиолучевой терапии не доказало своего преимущества.
Еще одним подходом, исследовавшимся при операбельном раке желудка, является проведение лекарсственного лечения до и после операции. Cunnignam et al. оценивали эффективность добавления к операции 3 курсов лечения в режиме ECF предоперационно и 3 курсов адъювантно [7]. Потенциальными преимуществами предоперационной системной терапии являлось ожидаемое увеличение частоты R0 резекции вследствие уменьшения размеров опухоли, элиминация микрометастазов, уменьшение выраженности симптомов, обусловленных опухолевым процессом, и оценка чувствительности опухоли к проводимой химиотерапии.
Комбинация ECF предусматривала введение каждые 3 недели эпидоксорубицина в дозе 50 мг/м2 и цисплатина 60 мг/м2 и постоянную инфузию 5-фторурацила в суточной дозе 200 мг/м2 в течение 21 дня. В исследование были включены 503 больных с резектабельной аденокарциномой желудка и нижних отделов пищевода, рандомизированно распределявшиеся на проведение радикальной операции с или без дополнительного лекарственного лечения.
Больные, получившие предоперационную химиотерапию, продемонстрировали хорошую переносимость, меньшую опухолевую распространенность и одинаковую частоту послеоперационных осложнений. Из 250 больных, рандомизированных в группу химиотерапии, 215 (86%) получили 3 курса предоперационно и 104 (42%) закончили 6 курсов химиотерапии. По сравнению с больными, которым была выполнена только операция, проведение системной терапии уменьшило относительный риск прогрессирования на 34% (HR=0,66, p<0,001) и риск смерти на 25% (HR=0,75, p=0,009), что позволило увеличить 5-летнюю выживаемость с 23% до 36%.
Выражу свое субъективное мнение, что предоперационная терапия рака желудка в ближайшее время не будет востребована в России. Это потребует изменения психологии хирургов, к которым в первую очередь попадают больные операбельным раком желудка и которые рассматривают это заболевание как чисто хирургическую проблему.
Системность рака желудка, как и всех других злокачественных опухолей, требует мультидисциплинарного подхода, обсуждения тактики лечения больного, в том числе и целесообразность выполнения операции или проведения системной терапии на первом этапе, онкологами различных специальностей сразу после постановки диагноза. Пока это не станет повседневной практикой в работе любого онкологического учреждения, предоперационная системная терапия у операбельных больных не будет популярной.
Однако уже сегодня онкологи-химиотерпевты могли бы более активно использовать в своей практике назначение адъювантной системной терапии. За последние годы получены убедительные свидетельства, что проведение адъювантной химотерапии достоверно улучшает отдаленные результаты оперативного лечения рака желудка, в том числе и подвергнутого операциям с включением лимфодиссекции D2.
Комбинация CAPOX широко используется в нашей стране для лечения колоректального рака, и большинство практикующих химиотерапевтом имеют личный опыт ее применения. С учетом 15% разницы в 3-летней безрецидивной выживаемости у нас нет оснований отказывать в проведении адъювантной химиотерапии CAPOX больным раком желудка, имеющим общее удовлетворительное состояние после гастрэктомии и лимфодиссекции D2 (как минимум при наличии метастазов в удаленных лимфоузлах).
Литература
- GASTRIC Group, Paoletti X, Oba K, Burzykowsky T, et al. Benefit of Adjuvant chemotherapy for resectable gastric cancer: a meta-analysis. JAMA 2010. 303: 1729-37.
- Sasako M, Sakuromoto S, Katai H, et al. Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J. Clin. Oncol. 2011; 29: 4387-93.
- Bang Y-J, Kim Y-W, Yang H-K, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomized controlled trial. Lancet 2012; 379: 315-21.
- Smalley SR, Benedetti JK, Haller DG, et al. Updated analysis of SWOG-directed Intergroup study 0116: A phase III trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. J Clin Oncol. 2012. 30: 2327-2333.
- Lee J, Lim do H, Kim S, et al. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: The ARTIST trial. J Clin Oncol. 2012. 30: 268-273.
- Fuchs CS, Tepper JE, Niedzwiecki D, et al. Postoperative adjuvant chemoradiation for gastric or gastroesophageal junction (GEJ) adenocarcinoma using epirubicin, cisplatin, and infusional (CI) 5-FU (ECF) before and after CI 5-FU and radiotherapy (CRT) compared with bolus 5-FU/LV before and after CRT: Intergroup trial CALGB 80101. J Clin Oncol. 2011. 29 (suppl): 256s, abstr 4003.
- Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006. 355: 11-20.
![]()
![]()
![]()
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.


