Моноклональное антитело при лечении желудка


Моноклональные антитела — это новейшее достижение медицины, которое применяется при лечении тяжелых заболеваний. Среди них злокачественные новообразования, аутоиммунные, системные, заболевания сердечно-сосудистой системы, некоторые инфекции и многое другое. Помимо этого, моноклональные антитела широко используются в диагностике, например, в иммуногистохимии, иммуноферментном анализе, проточной цитофлуориметрии и др. Таким образом, данная технология используется во многих отраслях современной медицины.
Человечество уже давно открыло для себя действие антител — особых молекул, которые вырабатываются клетками иммунной системы для распознавания чужеродных агентов — антигенов и их уничтожения. Антитела обладают специфичностью. Это значит, что они узнают только свой антиген, причем не просто антиген, а отдельный его фрагмент — детерминантную группу. В одном антигене может быть несколько таких детерминантных групп, и к ним будут образовываться разные антитела. Более того, к одной детерминанте может образовываться сразу несколько видов антител, которые могут отличаться по структуре, степени родства и прочности связывания. Таким образом, при введении антигена в организм образуется большое количество разных видов антител, направленных исключительно на один вид антигена. Это позволяет обеспечить адекватную иммунную защиту.
Антитела образуются специальными антителообразующими клетками. Причем каждый их вид образуется отдельной группой генетически однородных клеток — клонов. Чем больше необходимо видов антител, тем больше образуется клонов. Соответственно, антитела, которые вырабатываются одним клоном клеток называются моноклональными антителами.
Раньше для производства антител применялась иммунизация животных, после которой отбиралась их плазма и использовалась для приготовления отдельных препаратов — иммунных сывороток для борьбы с различными токсинами (дифтерия, столбняк), вирусами, ядами и др. Но бывают ситуации, когда нужно конкретное антитело, направленное на конкретную детерминанту антигена. Здесь уже обычной иммунизацией не обойтись. Требуются более прицельные технологии.
Запись
на консультацию
круглосуточно
Способы получения моноклональных антител
Получение моноклональных антител — это сложный многоступенчатый процесс, который проходит следующие этапы:
- Иммунизация животных. Обычно используются мыши или крысы. Это нужно для того чтобы увеличить количество лимфобластов — клеток, продуцирующих нужные антитела и перевести эти клетки в активное состояние. После выделения из организма эти клетки не могут долго существовать в лабораторных условиях, они погибнут даже на питательных средах с содержанием ростовых факторов. Чтобы это предотвратить, их скрещивают со злокачественными миеломными клетками.
- Подготовка миеломных клеток. Параллельно с иммунизацией животных проводят подготовку опухолевых миеломных клеток. Они, во-первых, обладают способностью синтезировать моноклональные антитела, а во-вторых, обладают неограниченным жизненным потенциалом (они бессмертны и способны к бесконечному воспроизведению). Для того чтобы миеломные клетки не погибли вне организма, их культивируют на специальных средах с использованием факторов роста.
- Гибридизация (слияние) лимфобластов и миеломных клеток для образования гибридомы. Для этого клетки обрабатывают различными антителами, чтобы изменить строение их мембран и спровоцировать образование цитоплазматических контактов. При этом образуются разные типы клеток, имеющих двойной набор хромосом (дикарионы). Это могут быть дикарионы, образованные только лимфоцитами, или только миеломными клетками. Но для производства моноклональных антител нужны именно дикарионы, образованные лимфоцитом и миеломной клеткой — гибридные клетки.
- Отбор гибридных клеток. Для этого используют специальные растворы, которые позволяют выжить только лимфобластным и гибридомным дикарионам. Первые в скором времени погибают, т. к. не обладают возможностью безграничного деления, а гибридомные клетки остаются жизнеспособными.
- Реклонирование гибридомных клонов.
- Определение и отбор гибридом, продуцирующих моноклональные антитела. Обычно для этого используется иммуноферментный анализ.
- Массовое наращивание антител.
- Очистка полученных антител. Степень очистки будет определяться областью применения препарата. Если это диагностика, достаточно 70-95% степени чистоты. Если препарат предполагается использовать для иммунотерапии, требуется более высокая степень чистоты. Для очистки используется аффинная и ионообменная хроматография.
- Удаление оставшихся примесей и обеззараживание полученного препарата от вирусов и бактерий.
В настоящее время идет тенденция отказа в использовании антител животных для лечебных целей. Во-первых, они являются чужеродными агентами для организма и могут спровоцировать аллергические реакции, вплоть до анафилаксии, что напрямую угрожает жизни пациентов. Во-вторых, иммунная система человека, распознавая такие антитела как чужеродные, будет пытаться их инактивировать, что снизит эффективность противоопухолевого лечения. Получить человеческие моноклональные антитела вышеописанным методом не представляется возможным, ввиду следующих проблем:
- Иммунизация человека различными антигенами неэтична.
- Даже если получить иммунизированные лимфоциты человека, будут проблемы на этапе их слияния с клетками миеломы мыши — полученные гибридомы будут нестабильны.
- Клеточные линии миеломы человека, которые можно было бы эффективно использовать в рамках биотехнологий для получения антител, пока получить не удалось.
В этой связи необходимо было искать новые технологии получения антител. Решением проблемы стали гибридные, гуманизированные и одноцепочечные антитела, производство которых подразумевало применение гибридомной технологии, кратко описанной выше, и технологии рекомбинантной ДНК.
- Гибридное или химерное антитело — это антитело, в котором его константный домен заменен на иммуноглобулин человека. Получаются они посредством технологии рекомбинантной ДНК, когда удаляется фрагмент мышиной ДНК, отвечающей за синтез константного домена и меняют его на фрагмент человеческой ДНК. Таким образом, в антителе в качестве константного домена, который обладает иммуногенными и эффекторными свойствами, будет человеческий белок, что позволит организму воспринимать его «за своего», а вариабельный домен, который специфически взаимодействует с антигеном, останется мышиным. Все вместе это позволит сохранить специфичность и уменьшить аллергенность и иммуногенность применяемого препарата.
- Гуманизированное антитело содержит еще меньше мышиного белка за счет только антигенсвязывающих гипервариабельных участков вариабельного домена. Это еще больше снижает вероятность осложнений со стороны иммунной системы.
- Одноцепочечное антитело представляет собой минимальный фрагмент антитела, который еще в состоянии хорошо связаться с антигеном и оказать свое действие. Он не содержит константного домена вообще.
Механизм действия моноклоналных антител
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.

Изменение клеточных сигналов
В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Комплемент-зависимая цитотоксичность
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Усиление цитотоксического воздействия иммунных клеток
Моноклональные антитела могут стимулировать иммунные клетки, например, макрофаги. Они будут распознавать клетки злокачественных опухолей и «пожирать» их, тем самым уничтожая их.
Развитие адаптивного иммунитета
Одной из причин, по которой становится возможным образование и развитие злокачественной опухоли в организме, является то, что иммунная система человека не распознает такие клетки как чужеродные. Моноклональные антитела дают возможность иммунитету «познакомиться» с раком и делает его доступным для связывания и последующего уничтожения. Таким образом, организм получает возможность самостоятельно бороться с опухолью.
Препараты с моноклональными антителами
Препараты на основе моноклональных антител уже два десятилетия входят в протоколы противоопухолевого лечения некоторых злокачественных новообразований. В 2008 году ВОЗ были приняты рекомендации относительно непатентованных названий таких препаратов:
- Их название должно заканчиваться на маб, от английского monoclonal antibody.
- Для указания источника получения моноклонального антитела должны использоваться следующие подосновы:
- -аксо — гибридное антитело.
- -о — мышиное антитело.
- -кси — химерное антитело.
- -у — человеческое антитело.
В настоящее время используется два вида противоопухолевых моноклональных антител:
- Неконъюгированные антитела — они оказывают непосредственное действие на процессы, которые приводят к гибели злокачественной клетки.
- Конъюгированные антитела — они связаны (конъюгированы) с токсинами или изотопами. Токсины и изотопы обладают уничтожающим действием на злокачественные клетки, а антитело обеспечивает их прицельную доставку к клеткам-мишеням.
Применение неконъюгированных антител
Эти препараты используются чаще всего. Их целью является определенный рецептор на поверхности злокачественной клетки.
К этому типу препаратов относится ритуксимаб — первое моноклональное антитело, которое было одобрено для применения в клинической практике. Его используют для лечения CD20+ В-клеточных лимфом. Рецептор CD20 есть на В-лимфоцитах, как здоровых, так и опухолевых, но он отсутствует на других тканях и клетках, в том числе на стволовых. Поэтому при воздействии ритуксимаба хоть и погибает популяция В-лимфоцитов, но потом она восстанавливается за счет нетронутых стволовых клеток. Причем восстанавливаются именно здоровые клетки.
Неконъюгированные антитела могут помечать злокачественные клетки и делать их видимыми для иммунной системы. Таким способом работает алемтузумаб, который связывается с CD52+ лимфоцитами и привлекает к ним внимание иммунитета.
Также к неконъюгированным моноклональным антителам относятся ингибиторы рецепторов факторов роста. Факторы роста — это специальные молекулы, которые запускают деление клетки. Для того чтобы запустить этот процесс, фактор должен связаться со специальным рецептором, расположенным на мембране клетки, что приведет к каскаду соответствующих реакций. Такие рецепторы есть и у здоровых клеток, и у злокачественных, но у злокачественных их может быть очень много, что позволяет таким клеткам делиться быстрее. Блокирование рецепторов с помощью антител приводит к нарушению этого процесса деления и клетки уже не могут бесконтрольно размножаться. К таким препаратам относится трастузумаб, цетуксимаб и др.
К неконъюгированным антителам относятся и ингибиторы ангиогенеза — образования кровеносных сосудов. Ангиогенез очень важен для злокачественных опухолей, чтобы получать большее количество кислорода и питательных элементов, поэтому опухоли инциируют его образование с помощью специальных химических сигналов. Моноклональные антитела либо блокируют передачу этих сигналов, либо разрушают уже созданную внутри опухоли сосудистую сеть. Это приводит к нарушению ее питания и остановке роста. К группе этих препаратов относится рамуцирумаб, бевацизумаб и др.
Применение конъюгированных антител
Конъюгированные моноклональные антитела связывают с цитотоксическими или радиотоксическими веществами, что позволяет прицельно воздействовать разрушающим агентом на злокачественные клетки. В качестве примера такого препарата можно привести ибритумомаб (Зевалин), в котором моноклональное антитело против CD20 (как мы помним, это маркер В-лимфоцитов) соединено с радиоактивным изотопом — иттрием-90. Препарат применяется для лечения В-клеточных лимфом. В качестве другого препарата можно привести Кадсилу — препарат, в котором антитело трастузумаб конъюгировано с ингибитором микротрубочек DM1, оказывающим цитотоксический эффект. Применяют его для лечения рака молочной железы.
Проблемы при использовании моноклональных антител
Несмотря на, казалось бы, огромные перспективы в лечении онкологических больных, применение моноклональных антител не является панацеей и тоже имеет ряд проблем:
- Препараты на основе моноклональных антител биологически и биохимически нестабильны. Особенно это касается конъюгированных антител. Это требует особых условий производства, хранения и транспортировки.
- Антитела плохо проникают внутрь опухоли.
- Они могут вызывать иммунный ответ против себя, что блокирует их действие. У 75% пациентов, которым вводились мышиные антитела, наблюдалось образование нейтрализующих антител, что снижало эффективность лечения.
- Препараты на основе моноклональных антител оказывают токсическое действие. Конечно, оно не такое выраженное как у цитостатиков, но в ряде случаев токсичность настолько высокая, что требует отмены препарата.
- Наиболее важным моментом является высокая специфичность моноклональных антител и высокая гетерогенность опухолевых клеток. Не все раковые клетки имеют молекулы мишени, на которые направлено действие препарата. Соответственно, они ускользают от его действия и остаются нетронутыми. Постепенно масса этих клеток накапливается и опухоль становится резистентной к данному методу лечения.
Чтобы улучшить результаты лечения, разрабатываются новые виды моноклональных антител. Одним из вариантов являются биспецифические антитела, которые направлены сразу на две молекулярные мишени, например, блинатумомаб — препарат, направленный сразу на две клеточные мишени В-лимфоцита — CD 19 и CD22. Он повышает узнаваемость злокачественных клеток даже после их трансформации в другие виды лейкоза.
В любом случае моноклональные антитела — это новое и высокоперспективное направление в современной онкологии. Разработка современных, более совершенных технологий помогает решать имеющиеся проблемы и делает лечение пациентов эффективнее и безопаснее.
Запись
на консультацию
круглосуточно
Величайшим достижением современной онкологии в лечении рака за рубежом является разработка и внедрение в клиническую практику различных препаратов, способствующих созданию противоракового иммунитета. Эти лекарства имеют биологическое происхождение, они не токсичны, не вызывают побочных эффектов и угнетения различных функций организма больного, как химиопрепараты. Научной базой для создания такого метода лечения являются открытия в области иммунологии, в частности, у онкологических больных.
Содержание:
- Препараты иммунотерапии в современной онкологии
- Интересные исторические факты иммунотерапии в онкологии
- Механизм воздействия и основные группы препаратов иммунотерапии
- Препараты иммунотерапии для разных видов рака
- Где можно пройти лечение рака иммунопрепаратами
Препараты иммунотерапии в современной онкологии
Установлено, что при злокачественных опухолях в организме пациентов всегда имеет место снижение его защитных свойств, то есть иммунитета. Далее, учеными, исследующими иммунологию рака в крупнейших онкологических центрах мира, было обнаружено, что потенциальные раковые клетки (незрелые клетки различных тканей) ежедневно образуются в больших количествах у каждого человека. Теоретически это создает такую ситуацию, что каждый человек ежедневно рискует заболеть 6-8 видами рака. Но у большинства людей этого не случается по той причине, что постоянно срабатывает иммунная система и обезвреживает эти аномальные клетки, воспринимая их как чужеродные, и рак развивается именно тогда, когда защитная функция организма недостаточна.
Это и легло в основу идеи создания препаратов, которые могли бы естественным образом воздействовать на злокачественные клетки – как профилактически, не давая возможности развиться опухоли, так и с целью воздействия на уже имеющуюся раковую опухоль. Сегодня арсенал таких препаратов довольно широк, и он постоянно пополняется, а применение этих лекарств в клинической практике доказывает их эффективность при лечении различных форм рака у взрослых и у детей.
Более подробную информацию о возможности пройти иммунотерапию рака можно получить на нашем сайте, заполнив форму контакта. В течение суток предоставляется бесплатная консультация ведущего онколога, вся необходимая информация и всесторонняя организационная помощь в прохождении лечения в выбранной клинике.
Закажите бесплатную консультацию
Интересные исторические факты иммунотерапии в онкологии
Препараты иммунотерапии – это новое, перспективное и еще недостаточно изученное направление в онкологии, но корнями своими оно уходит к концу 19-го века. Американский хирург Вильям Коли в 1891 г. обнаружил уникальную закономерность у онкологических больных, переболевших стрептококковой инфекцией (рожистым воспалением, скарлатиной). Спустя время после этих инфекций он отметил обратное развитие, уменьшение опухолей, в частности, саркомы. Это побудило его к созданию первой противораковой вакцины на базе ослабленных возбудителей инфекционных заболеваний. При введении в организм они не вызывали развития инфекции, а лишь стимулировали иммунную систему, и образовавшиеся антитела воздействовали на опухоль. Ученый получил серию хороших результатов в лечении рака, но его метод был подвергнут критике как противоестественный и опасный.
Лишь спустя много лет, в 60-е годы прошлого века, с развитием иммунологии и открытием различных факторов иммунитета (интерлейкина, интерферона, факторов роста и т.д.) положило начало системному созданию и применению иммунопрепаратов в онкологии. А с развитием генетики в 1991 г. был выявлен первый онкоген, кодирующий злокачественный рост. В настоящее время таких мутантных генов уже выявлено множество разновидностей и принадлежность их к развитию того или иного вида опухоли. И сами иммунные препараты уже создаются не методом иммунизации человека или лабораторных животных, а методом генной инженерии (перекодирования генов).
Механизм воздействия и основные группы препаратов иммунотерапии
Все современные препараты иммунотерапии в онкологии по механизму действия разделяются на 3 основных группы:
- Создающие активный специфический иммунитет, это противораковые вакцины, содержащие антиген конкретной опухоли и побуждающие организм вырабатывать специфические антитела против нее.
- Неспецифические иммунопрепараты или иммуномодуляторы, повышающие в целом защитные свойства организма, выработку защитных иммунных тел.
- Моноклональные антитела – принципиально новое направление в иммунотерапии рака, это – создание в лабораторных условиях специфических иммунных белковых тел из одной единственной клетки, то есть это специфическая, точечная или клеточная иммунотерапия рака.
Противораковые вакцины для иммунотерапии
Противоопухолевых вакцин создано множество разновидностей, они делятся по способу получения и действия на следующие подгруппы:
-
 клеточные вакцины, в состав которых входят целые опухолевые клетки (аутологичные – данного пациента или аллогенные – другого пациента с подобным видом рака);
клеточные вакцины, в состав которых входят целые опухолевые клетки (аутологичные – данного пациента или аллогенные – другого пациента с подобным видом рака); - антигенные вакцины, действующим фактором которых является лишь антиген, извлеченный из опухолевых клеток.
В клеточных вакцинах содержатся раковые клетки, ослабленные и лишенные способности к развитию и делению, поэтому они не могут «заразить» пациента раком, а лишь вызывают выработку на них иммунных тел. В состав антигенных вакцин входят не целые раковые клетки, а лишь их различные компоненты: белки, генетический материал (ДНК, РНК). Для их введения используются специальные вирусы-проводники, которые не вызывают заболевания, а лишь способствуют транспортировке антигенов к иммунной системе.
Примерами наиболее используемых в практике вакцин являются Oncophage (Витеспен), Onyvax, Cancer-Vax, NY-ESO-1, ALVAC-CEA, VG-1000, TRICOM, Prostvac и другие. Одни из них являются моновалентными, предназначенными для одного вида рака, другие – поливалентными, которые можно применять для лечения нескольких видов рака. Одни вакцины уже широко применяются в клинической практике, целый ряд новых вакцин проходят клинические испытания, постоянно ведется научный поиск и разработка более эффективных вакцин.
Неспецифические иммунопрепараты в онкологии, адьюванты
Эти препараты оказывают общее стимулирующее действие на иммунную систему, и таким образом усиливают в том числе и противораковый иммунитет. Они обычно применяются как адьюванты – дополнение к другим препаратам для усиления выработки специфического противоопухолевого иммунитета.
Наибольшее применение в онкологии получили следующие препараты:
- иммуномодуляторы – Талидомид, Ревлимид, Ромалист, а также бацилла Кальметта-Герена (BCG), то есть то, что нам известно, как БЦЖ – иммунизация ослабленной микобактерией туберкулеза;
- цитокины – белковые молекулы, влияющие на активность иммунных клеток и их деление: Интерлейкин-2, Интерферон-альфа, Колониестимулирующий фактор, Сарграмостин.
Моноклональные антитела в иммунотерапии
Открытие и создание моноклональных антител совершило революцию в иммунотерапии рака. Они представляют собой иммунные белки, вырабатываемые одной клеткой (клоном), потому обладают специфичным направленным действием именно на подобные клетки.
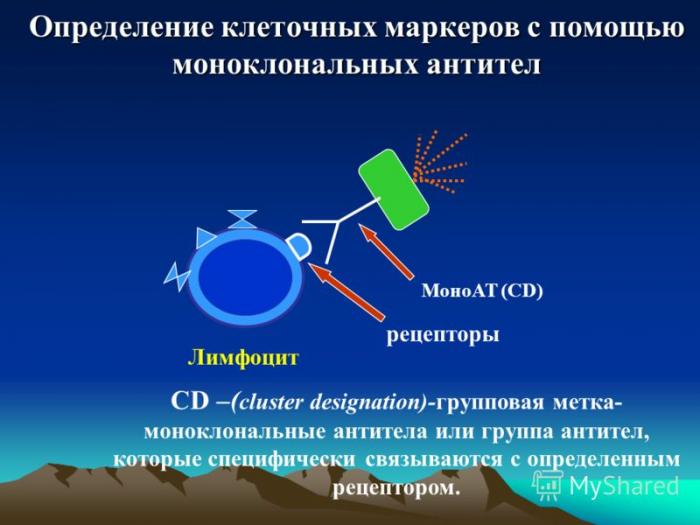
По механизму действия выделяют 2 группы моноклональных антител:
- неконъюгированные – оказывающие самостоятельное воздействие на раковую клетку и «помечающие» опухоль для иммунной системы;
- конъюгированные, или препараты целевого (таргетного) действия, несущие на себе к раковым клеткам молекулы химиопрепарата или же радиоактивные изотопы;
Наиболее широко применяются именно неконъюгированные моноклональные антитела, кроме «указательной» функции они сами воздействуют на клетки рака – угнетают факторы роста, активность ферментов, блокируют ангиогенез (образование новых сосудов в растущей опухоли). Примерами подобных препаратов являются Алемтузумаб для лечения лейкемии за границей, Ритуксимаб для лечения лимфомы, Эрбитукс для лечения рака толстой кишки, Герцептин для лечения рака молочной железы за рубежом, Рамуцирумаб для лечения рака желудка и другие препараты.
Конъюгированные моноклональные антитела – новое направление в комбинированном лечении рака, объединяющее в себе сразу 2 метода: радио- и иммунотерапию и химио- и иммунотерапию. Например, Ибритумомаб (Зевалин), применяемый для лечения лимфомы, Трастузумаб длялечения рака молочной железы.
В настоящее время в США и Европе ведутся работы по созданию поливалентных и гуманизированных моноклональных антител, а также конъюгированных с микроэлементом селеном, повышающим эффективность лечения.
Узнайте точную стоимость лечения
Препараты иммунотерапии для разных видов рака
Препараты иммунотерапии показаны на всех стадиях рака и практически при раке любой локализации. На ранних стадиях рака они сыграют большую роль в предупреждении метастазирования опухоли в лимфоузлы и органы, а также существенно снизят вероятность ее рецидива после лечения, укрепят иммунную систему. На поздних, метастатических стадиях рака они способствуют замедлению развития опухоли и ее распространения, а коньюгированные препараты отыщут вторичные раковые очаги в любом участке организма и проведут таргетное воздействие химиопрепаратом или радиоактивными частицами, непосредственно на клеточном уровне, не повреждая при этом здоровых тканей.
Припараты иммунотерапии при раке легкого
В комплексе лечения рака легких применяются:
- Бевацизумаб (Авастин) – ингибитор ангиогенеза, лишающий опухоль притока крови и приводящий к задержке ее развития, применяется в сочетании с химиопрепаратами, содержащими платину;
- Бавитуксимаб – воздействует на внешнюю белковую защиту раковых клеток и делает их заметными для иммунной системы организма;
- Патритумаб – оказывает блокирующее воздействие на белковый механизм деления раковых клеток, обычно применяется в сочетании с препаратом Эрлотиниб.
Припараты иммунотерапии при раке простаты
Для лечения рака простаты наиболее применяемы следующие препараты:
- Вакцина GVAX – клеточная вакцина, оказывающая блокирующее влияние на рост раковых клеток;
- Вакцина PROSTVAC – изготовлена на основе опухолевого антигена PSA и содержит вирусный «проводник» (из ослабленного вируса оспы кур);
- Вакцина Прованж (Provenge) – терапевтическая клеточная вакцина, изготавливаемая для каждого пациента индивидуально в специальной лаборатории;
- Вакцина ProstAtak – конъюгированная вакцина; содержащая молекулы цитостатика Валацикловира и вирусный проводник для доставки препарата непосредственно раковым клеткам;
- Ипилимумаб (Yervoy) – моноклональное антитело, активизрующее цитотоксическое действие Т-лимфоцитов и повышающее иммунный ответ за счет обнаружения раковых клеток.
Припараты иммунотерапии при раке молочной железы
При раке молочной железы, в основном, применяются вакцины и моноклональные антитела:
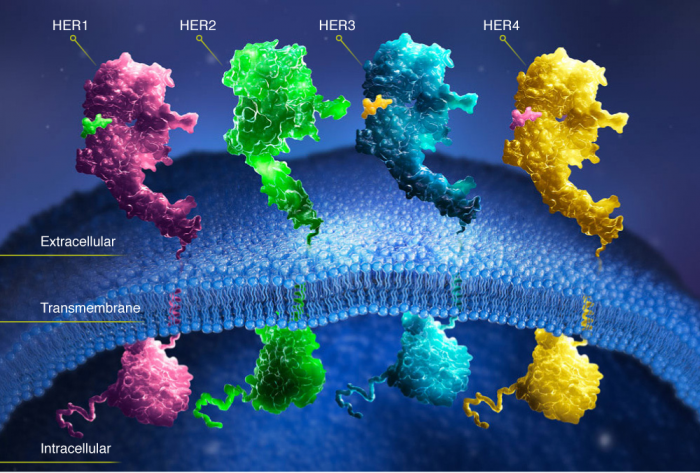
- Герцептин – содержит моноклональные антитела, блокирущие белок HER-2 в раковых клетках, тем самым препятствующие их росту и развитию;
- Вакцина Neuvenge – эффективна при наиболее агрессивном HER-2 позитивном раке груди;
- Вакцина РЕСАН (создана в Беларуси) – включает более 40 разновидностей антигенов опухоли, создает клеточный противораковый иммунитет с формированием «памяти» иммунитета, что значительно снижает число рецидивов рака;
- Тайкерб (Лапатиниб) – оказывает действие, подобное Герцептину, но имеет более широкий спектр эффективности, и применяется в сочетании с Кселодой, когда Герцептин оказывается малоэффективным.
Припараты иммунотерапии при раке желудка
Для лечения рака желудка в комплексе с химиотерапией применяются следующие иммунные препараты:
- Иматиниб (Тайверб) – моноклональное антитело, блокирующее рецепторы роста раковой клетки;
- Бортезомиб (Велкейд) – ингибитор белкового обмена в раковых клетках, повреждает структуру ДНК, повышает чувствительность опухоли к химиотерапевтическим препаратам;
- Эверолимус – препарат применяется как ингибитор иммунитета при пересадке органов, но обнаружено его сильное угнетающее действие на раковые клетки путем блокирования фермента АТФ.
Припараты иммунотерапии меланомы
Одна из самых злокачественных опухолей – меланома, устойчивая ко многим химиопрепаратам, оказалась более «податливой» к воздействию иммунотерапии:
- Ниволумаб – является моноклональным антителом таргетного действия, блокирует рост опухолевых клеток;
- Пембролизумаб (Кейтруда) – моноклональное антитело, блокирует защитный белок PD-1 меланомных клеток, делая их заметными для иммунной системы.
Большой опыт применения подобных препаратов накоплен в лечении рака в Израиле, где эффективность терапии меланомы является самой вкоысой.
Проконсультируйтесь с врачом Online
Где можно пройти лечение рака иммунопрепаратами
Иммунотерапия рака за границей – новый и пока еще дорогостоящий метод лечения рака, тем более, что большинство современных препаратов выпускаются западными фармацевтическими кампаниями. Поэтому, если ваш выбор падает на отечественной онкологии, то такое лечение можно пройти в столицах России, Украины, Казахстана, Беларуси.
Если же вы можете позволить себе лечение за границей, то во всех онкологических центрах развитых стран оно доступно на самом высоком уровне, а цены на лечение рака за рубежом более демократичными будут в клиниках Израиля. Более подробно узнайте обо всем через контактную форму на сайте.


