Лечение рака желудка методические рекомендации
Онкологические заболевания нередко называют чумой XXI века. Действительно, распространенность этих патологий, к сожалению, растет, и врачи пока не нашли лекарства, которое действовало бы на все виды рака. Среди онкологических заболеваний рак желудка — один из самых распространенных: в год фиксируется около миллиона новых случаев, а смертность от рака желудка превышает 500 тысяч человек в год[1]. Россия входит в число стран, где пациенты сталкиваются с этой патологией достаточно часто. Какие симптомы могут выявить рак желудка и как его лечить, мы расскажем в этой статье.
Классификация рака желудка
Словом «рак» обозначаются злокачественные новообразования, состоящие из клеток, деление которых происходит бесконтрольно. Такие образования (опухоли) могут проникать в другие органы, давая метастазы, нарушать их работу, приводить к серьезному нарушению функционирования всего организма. Рак желудка может возникать в любом отделе этого органа: пилорическом, кардиальном, на большой и малой кривизне и т.д. Опухоль может поражать как часть желудка, так и весь орган.
Частота возникновения метастазов при этом заболевании превышает 80%[2]. Но на ранних стадиях проявления заболевания можно спутать с другими патологиями, поэтому пациенты нередко не обращают на тревожные симптомы внимания и начинают лечение несвоевременно.
Медицинская статистика
Рак желудка имеет очень широкое распространение и уступает по частоте возникновения только раку легких у мужчин и раку молочной железы у женщин. Ежегодно в нашей стране регистрируют около 38 тысяч новых случаев онкологии желудка, и большинство пациентов умирают. Мужчины страдают от рака желудка в 1,3 раза чаще женщин, пик заболеваемости приходится на возраст старше 70 лет[3].
Перечислим различные существующие сегодня классификации рака желудка.
- Международная классификация ВОЗ выделяет несколько разновидностей рака:
- Папиллярная аденокарцинома (опухоль из железистого эпителия);
- Тубулярная аденокарцинома (опухоль из клеток кубического и цилиндрического эпителия);
- Низкодифференцированная аденокарцинома (клетки, образующие опухоль, плохо различаются);
- Муцинозная аденокарцинома (опухоль состоит из эпителиальных клеток, которые могут продуцировать слизь);
- Перстневидный рак желудка (атипичные клетки быстро распространяются вглубь органа);
- Плоскоклеточный рак (развивается из клеток шиповатого слоя эпителия);
- Железисто-плоскоклеточный рак (сочетание аденокарциномы и плоскоклеточного рака);
- Карциносаркома (достаточно редко встречающаяся опухоль, состоящая из клеток разного вида);
- Хориокарцинома (редкая агрессивная форма заболевания, которая характеризуется ранним метастазированием);
- Недифференцированный рак (также агрессивная форма заболевания, для которого характерно раннее метастазирование);
- Другие формы рака.
- В рамках классификации по морфологическому признаку выделяются следующие виды рака желудка:
- Ограниченно растущий рак (экзофитная форма). Обычно для этой формы заболевания характерны кровотечения, симптомы интоксикации. Достаточно хорошо поддается излечению.
- Инфильтративно растущий рак (эндофитная, диффузная форма). Чаще связан с ростом метастазов, быстрым поражением желудка.
- Есть также переходные формы, объединяющие черты перечисленных двух.
- Классификацию рака желудка по гистологическому признаку называют также классификацией по Lauren. Фактически эта классификация описывает три формы рака желудка:
- Кишечный тип. Эта разновидность заболевания подобна раку кишечника. Опухоль напоминает железистую структуру.
- Диффузный тип. В опухоли дифференцируются одиночные клетки или небольшие группы клеток с большим содержанием муцина (слизи).
- Также выделяется смешанный тип, для которого характерны черты описанных выше двух.
Стадии и симптоматика желудочной онкологии
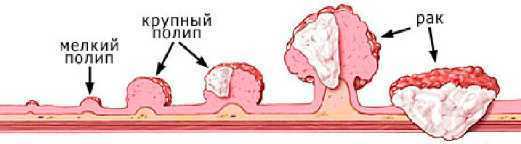
Если пациенту поставлен диагноз «рак желудка», то следующая задача врача — установить стадию заболевания. Современная медицина выделяет пять стадий:
- Нулевая. Начало процесса перерождения нормальных клеток эпителия в патологические. На этой стадии рак обычно не имеет проявлений, но если заболевание диагностируют, то пациенту рекомендуют оперативное лечение с высокими шансами на полное выздоровление.
- Первая. Врачи отмечают возникновение опухоли с четкими контурами, которая находится или в слизистом слое, или начинает проникать в мышечный. Симптомы: быстрая утомляемость, падение уровня гемоглобина в крови, вздутие живота после еды, отказ от еды, бледность.
- Вторая. На этой стадии опухоль начинает поражать не только оболочки желудка, но и лимфатические узлы. Рак на этой стадии вызывает болезненность желудка, жар, боль при глотании. Необходимо удалять опухоль, но если она находится в районе крупных сосудов, то операция сопряжена с очень большим риском.
- Третья. Опухоль разрастается, затрудняя движение желудка, начинается ее прорастание в соседние органы. Поражается мышечный слой стенки желудка и большое количество лимфоузлов. На этой стадии заболевания происходит резкое расстройство пищеварения, постоянная тошнота сочетается с запорами и диареей, пациент резко теряет вес.
- Четвертая. Опухоль прорастает в соседние, а также отдаленные органы (в том числе и в головной мозг), поражает большое количество лимфоузлов. На этой стадии рак желудка вызывает постоянные боли, частую рвоту с примесями крови, ощущение тяжести даже при небольших порциях съеденной пищи, накопление жидкости в брюшине. На этой стадии излечение рака невозможно, основная цель лечения — облегчение состояния пациента и предупреждение осложнений.
Диагностика
Мы уже упомянули о том, что рак желудка на начальной стадии явными симптомами не сопровождается. Тем не менее чем раньше обнаружена патология, тем выше шансы на успешное излечение. Именно поэтому важно знать о методах диагностики, с помощью которых можно достоверно выявить это опасное заболевание.
Обратите внимание
На ранней стадии заболевание может проявляться таким комплексом симптомов, как быстрое насыщение, снижение интереса к мясной пище, анемия, потеря веса, дискомфортные ощущения в желудке. На более поздних стадиях начинаются боли, постоянная тошнота, кровотечения, изменения стула.
Ассоциация онкологов России разработала рекомендации, в соответствии с которыми основными методами диагностики рака желудка являются следующие:
- Осмотр, сбор анамнеза.
- Эндоскопия верхних отделов ЖКТ, биопсия тканей. В ходе обследования уточняются размеры опухоли, визуализируются ее границы.
- Рентген желудка. Врач может оценить протяженность опухоли, однако не при всех видах рака желудка этот вид диагностики показателен.
- УЗИ или КТ органов брюшной полости. УЗИ — неинвазивный метод диагностики, хорошо переносится пациентами. Позволяет оценить, есть ли метастазы и насколько они распространились.
- Клинический и биохимический анализы крови.
- ЭКГ и обследование грудной полости.
Лечение рака желудка
На сегодняшний день существует несколько методик лечения рака желудка, эффективность которых зависит от стадии заболевания, локализации опухоли, состояния пациента. Расскажем подробнее о каждом из видов лечения.
Оперативное лечение
Операция по удалению части желудка или желудка полностью является самым распространенным методом радикального лечения рака. При этом если операция проведена вовремя, на ранней стадии рака, выживаемость составляет более 90% в течение 5 лет. Во время операции удаляется не только часть органа или желудок полностью, но и лимфоузлы, в том числе и в большом количестве, если есть серьезный риск распространения опухоли.
Медикаментозное лечение
Медикаментозное лечение рака желудка проводится по нескольким направлениям. Во-первых, это обезболивающие препараты, причем на начальных стадиях заболевания не рекомендуется прописывать сильные анальгетики. В противном случае они не будут действовать на более поздних стадиях. В сочетании с анальгетиками могут быть назначены антидепрессанты и нейролептики для усиления эффекта.
Во-вторых, это препараты, которые помогают справиться с неприятными симптомами, такими как тяжесть в желудке, изжога, вздутие, тошнота. Это могут быть ферментные препараты, например «Мезим», лекарства против изжоги, такие как «Ренни» или «Смекта».
В-третьих, это собственно противоопухолевые препараты. К этой группе относятся, в частности, «Фторафур», «Капецитабин» и другие. Они же оказывают иммуномодулирующее действие.
Тест нового лекарства от рака…
…Проводят в университете Стэнфорда на мышах. Средство уже показало блестящий результат: у 95% мышей раковая опухоль поддалась лечению. Для тех 5%, на которых препарат не оказал действия, была увеличена доза, что дало положительный эффект. Новое лекарство должно стимулировать иммунную систему человека, чтобы она боролась с раковыми клетками. Если применение препарата на людях будет успешным, то средство будут вводить перед операцией по удалению опухоли, что позволит в дальнейшем избежать возвращения патологии[4].
Химиотерапия
На протяжении довольно длительного времени считалось, что при раке желудка химиотерапия неэффективна. Однако последние исследования показали, что трех- и пятилетняя выживаемость пациентов при применении химиотерапии вырастает на 10–15%.
Чаще всего для лечения рака желудка в рамках химиотерапии применяется 5-фторурацил, который блокирует деление клеток, а значит, и рост опухоли. В последние годы чаще стали использоваться препараты платины в составе комбинированной химиотерапии. Также химиотерапия применяется в сочетании с лучевым лечением.
Лучевая терапия
Как и при лечении других форм рака, при поражении желудка применяется лучевая терапия, которая в данном случае ограничена близким расположением других органов и вариабельным положением желудка. При облучении нужно, чтобы воздействию подвергался весь желудок, но в этом случае в зону облучения попадают, например, почки или сердце. Это осложняет проведение лечения.
Второй непростой момент при проведении лучевой терапии — питание больных. Рак желудка нередко приводит к серьезной потере массы тела, отсутствию аппетита, у больного может развиться анорексия. Лучевая терапия, ухудшающая самочувствие пациента, приводит к еще большему сокращению рациона, поэтому очень важно подобрать для пациента оптимальный режим питания и диету.
Лучевая терапия применяется в сочетании с другими методами. В частности, она может выполняться и во время операции, когда действие пучка частиц наиболее направлено. Такая методика помогает избежать лучевых осложнений.
Паллиативное лечение
Паллиативное лечение проводится на поздних стадиях рака желудка, чтобы облегчить состояние пациента. Удалить опухоль или избавиться от метастазов на этой стадии, как правило, невозможно, однако можно добиться облегчения состояния пациента. Для этого проводятся паллиативные операции, которые улучшают пищеварение, облегчают прохождение пищи по ЖКТ. Выполняется паллиативное удаление опухоли и метастазов. Это не приводит к излечению от рака, но улучшает качество жизни пациента. Также паллиативные операции по удалению очага опухоли уменьшают ее массу, снижают интоксикацию организма, позволяют провести курс химио- или лучевой терапии, которые оказываются более эффективными.
Врачи неизменно отмечают, что перспективы пациента с любым видом рака, в том числе раком желудка, зависят от того, на какой стадии заболевания началось лечение. На ранних стадиях возможность благоприятного исхода превышает 80%[5]. Однако многие пациенты обращаются к врачам тогда, когда заболевание уже серьезно сказывается на общем состоянии здоровья, когда пострадал не только желудок, но и лимфатическая система, а также близлежащие органы, что существенно затрудняет лечение. В частности, оперативное вмешательство не дает заметного результата, когда врачи вынуждены назначать симптоматическое, поддерживающее, лечение. Именно поэтому необходимо обращаться к специалистам при появлении первых тревожных симптомов, таких как потеря веса, расстройство аппетита, тошнота, наличие крови в кале и других.
1. Черноусов А.Ф., Поликарпов С.А., Годжело Э.А. Ранний рак и предопухолевые заболевания желудка — М.: ИздАТ, 2002. — 256 с.
2. Щепотин И.Б., Эванс С.Р. Рак желудка: практическое руководство по профилактике, диагностике и лечению. Киев «Книга Плюс» 2000. — 227 с.
3. Статистика злокачественных новообразований в России и странах СНГ в 2012 г. Под редакцией М.И. Давыдова и Е.М. Аксель М., Издательская группа РОНЦ, 2014, 226 страниц
4. Adachi, Y. Persistence of mucosal gastric carcinomas for 8 and 6 years in two patients/Y. Adachi, M. Mori, K. Sugimachi//Arch. Pathol. Lab. Med. — 1990. — Vol. 114. — P. 1046 — 1048.
5. Adachi, Y. Prognostic significance of the number of positive lymph nodes in gastric carcinoma/Y. Adachi, T. Kamakura, M. Mori et al.//Br. J. Surg. — 1994. — Vol. 81. — P. 414 — 416.
6. Ito, H. Complete ten-year postgastrectomy follow-up of early gastric cancer./H. Ito, Y Oohata, K. Nakamura et al.//Am. J. Surg. — 1989. — Vol. 158. — P. 14 — 16.
7. Isozaki, H. Distant lymph node metastasis of early gastric cancer./H. Isozaki, K. Okajima, T. Ichinowa et al.//Jpn. J. Surg. — 1997. — Vol. 27. — P. 600 — 605.
8. Германов, А.Б. Расширенные и расширенно-комбинированные операции при раке проксимального отдела желудка. Диссертация доктора медицинских наук./А.Б. Германов//- М. — 1998. — 312 С.
9. Давыдов, М.И. Хирургическое лечение рака проксимального отдела желудка. Материалы V Ежегодной Российской Онкологической Конференции/М.И. Давыдов, М.Д. Тер-Ованесов, И.С. Стилиди//- М. — 2002. 165 — 167.
10. Давыдов, М.И. Идеология расширенных операций по поводу рака желудка./М.И. Давыдов, Б.Е. Полоцкий, И.С. Стилиди и др.//Вестник Московского Онкологического Общества. — Москва. — N 494. — 2003. — С. 2 — 3.
11. Рак желудка. В книге «Энциклопедия клинической онкологии» под редакцией М.И. Давыдова./Давыдов М.И., Тер-Ованесов М.Д., Полоцкий Б.Е. и др. — М: РЛС, 2004. — С. 223 — 230.
12. Давыдов, М.И. Энциклопедия хирургии рака желудка./М.И. Давыдов, И.Н. Туркин, М.М. Давыдов — Москва: ЭКСМО, 2011. — С. 536.
13. Поликарпов, С.А. Актуальные проблемы хирургии рака желудка. Диссертация доктора медицинских наук./С.А. Поликарпов — Москва, 2003. — С. 152.
14. Стилиди, И.С. Современные представления об основных принципах хирургического лечения местно-распространенного рака желудка./И.С. Стилиди, С.Н. Неред//Практическая онкология. — 2009. — Т. 10. — N 1. — С. 20 — 27.
15. Katai, H. Risk factors for pancreas-related abscess after total gastrectomy./H. Katai, K. Yoshimura, T. Fukagawa//Gastric Cancer. — 2005. — N 8 (3). — P. 137 — 141.
16. Yu, W. Randomized clinical trial of splenectomy versus splenic preservation in patients with proximal gastric cancer./W. Yu, G.S. Choi, H.Y Chung//Br. J. Surg. — 2006. — Vol. 93 (5). — P. 559 — 563.
17. Sasako M., Yamaguchi T., Kinoshita T. et al. Randomized phase III trial comparing S 1 monotherapy versus surgery alone for stage II/III gastric cancer patients (pts) after curative D2 gastrectomy (ACTS GC study)/ASCO 2007 Gastrointestinal Cancers Symposium. — 2007. — P. Abstr 8.
18. Cunningham D., Allum W.H., Stenning S.P. et al. Perioperative chemotherapy versus surgery alone for resectable gastroe sophageal cancer//N. Engl. J. Med. — 2006. — Vol. 355. — P. 11 20.
19. Ychou M., Pignon J.P., Lasser P. et al. Phase III preliminary results of preoperative fluorouracil (F) and cisplatin (C) versus surgery alone in adenocarcinoma of stomach and lower esophagus (ASLE): FNCLCC 94012 FFCD 9703 trial//Proc. Am. Soc. Clin. Oncol. — 2006. — Vol. 24 (18S): Abstract 4026.
20. MacDonald J.S., Smalley S., Benedetti J. et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction//N. Engl. J. Med. — 2001. — Vol. 345. — P. 725.
21. Ichikawa H. X ray diagnosis of gastric cancer//Gastric Cancer/Nishi M., Ichikawa H. et al (eds.). — Springer Verlag, 1993. — P. 232 — 245.
22. Tsuda Y. Endoscopic observation of gastric lesions with a dye spraying technique//Endoscopic Gastroenterology — 1987. — Vol. 9. — P. 189 — 195.
23. Yoshida S., Yamaguchi H., Saito D., Kido M. Endoscopic diagnosis: latest trends//Gastric Cancer/Nishi M., Ichikawa H. etal. (eds.). — Springer Verlag, 1993. — P. 246 — 262.
24. Murata Y, Suzuki S., Oguma H. et al., Recent progress in staging gastric cancer by endoscopic ultrasonography//proceeding of 3rd International Gastric Cancer Congress, Seoul, Korea, 1999. — Monduzzi Editore, 1999. — Vol. 1. — P. 109 — 114.
25. Fukuya T., Honda H., Kaneko K. et al. Efficacy of helical CT in T staging of gastric cancer//J. Comput. Assist. Tomography. — 1997. — Vol. 21. — P. 73 — 81.
26. Takao M., Fukuda T., Iwanaga S. et al. Gastric cancer: evaluation of triphasic spiral CT and radiologic-pathologic correlation//J. Comput. Assist. Tomography. — 1998. — Vol. 22. — P. 288 — 294.
27. Staging Laparoscopy in the Management of Gastric Cancer: A Population-Based Analysis/Paul J Karanicolas, MD, PhD, Elena В Elkin, PhD, Lindsay M Jacks, MSc, Coral L Atoria, MPH, Vivian E Strong, MD, FACS, Murray F Brennan, MD, FACS, Daniel G Coit, MD, FACS//J Am Coll Surg 2011; 213: 644 — 651
28. Sawai K., Takahashi T., Suzuki H. New trends in surgery for gastric cancer//Jap. J. Surg. Oncol. — 1994. — Vol. 56. — P. 221 226.
29. Bozzetti, F. Subtotal Versus Total Gastrectomy for Gastric Cancer. Five-Year Survival Rates in a Multicenter Randomized Italian Trial./F. Bozzetti, E. Marubini, G. Bonfanti et al.//Ann. Surg. — 1999. — Vol. 230. — N 2. — P. 170 — 178.
30. Morgagni, P. for the Italian Research Group for Gastric Cancer Study. Does resection line involvement affect prognosis in early gastric cancer patients? An Italian Multicentric Study./P. Morgagni, D. Garcea, D. Marreli et al.//World J. Surg. — 2006. — Vol. 30. — P. 585 — 589.
31. Sano, T. Recurrence of early gastric cancer./T. Sano, M. Sasako, T. Kinoshita et al.//Cancer. — 1993. — Vol. 72. — P. 3174 — 3178. |
32. Sano, T. No advantage of reoperation for positive resection margin in node positive gastric cancer patients./T. Sano, S. Mudan//Jpn. J. Clin. Oncol. — 1999. — Vol. 29. — P. 283 — 284. |
33. Songun, I. Prognostic value of resection line involvement in patients undergoing curative resection for gastric cancer./I. Songun, J.J. Bonencamp, J. Hermans et al.//Eur. J. Cancer. — 1996. — Vol. 32A. — P. 433 — 437. |
34. Murad AM, Santiago FF, Petroianu A, et al. Modified therapy with 5-FU, doxorubicin and methotrexate in advanced gastric cancer. Cancer. 1993; 72: 37 — 41. |
35. Pyrhonen S, Kuitunen T, Nyandoto P, et al. Randomized comparison of fluorouracil, epidoxorubicin and methotrexate (FEM-TX) plus supportive care with best supportive care alone in patients with non-resectable gastric cancer. Br J Cancer. 1995; 71: 587-91. |
36. Scheithauer W., Kornek G., Heina M. et al. Palliative chemotherapy versus best supportive care in patients with metastatic gastric cancer: a randomized trial//Ann. Hematol. 1994. Vol. 73. Suppl. 2. Abstract A181. |
37. Wagner A.D., Grothe W., Haerting J. et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data//J. Clin. Oncol. 2006. Vol. 24. No 18. P. 2903 — 2909. |
38. Van Cutsem E, Chung H, Shen L .EfficacyresultsfromtheToGAtrial: AphaseIIIstduyoftrastuzumab added to standard chemotherapy (CT) in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer (GC) In ASCO Annual Meeting, Orlando, FL, USA. J Clin Oncol 2009; LBA4509. |
39. Di Lauro L, Fattoruso SI, Giacinti L, et al. Second-line chemotherapy with FOLFIRI in patients with metastatic gastric cancer (MGC) not previously treated with fluoropyrimidines [abstract]. J Clin Oncol 2009; 27 (Suppl 15): Abstract 454 |
40. Al-Batran (https://ascopubs.org/author/Al-Batran%2C+Salah-Eddin) SE, Homann (https://ascopubs.org/author/Homann%2C+Nils) N, Schmalenberg (https://ascopubs.org/author/Schmalenberg%2C+Harald) H, et al. Perioperative chemotherapy with docetaxel, oxaliplatin, and fluorouracil/leucovorin (FLOT) versus epirubicin, cisplatin, and fluorouracil or capecitabine (ECF/ECX) for resectable gastric or gastroesophageal junction (GEJ) adenocarcinoma (FLOT4-AIO): A multicenter, randomized phase 3 trial. DOI: 10.1200/JCO.2017.35.15_suppl.4004/oifriia/of Clinical Oncology 35, no. 15_suppl (May 20 2017) 4004 — 4004.
41. Cats A (https://www.ncbi.nlm.nih.gov/pubmed/?term=Cats%20A%5BAuthor%5D&cauthor=true&cauthor_uid=2965036 Jansen EPM (https://www.ncbi.nlm.nih.gov/pubmed/?term=Jansen%20EPM%5BAuthor%5D&cauthor=true&cauthor_uid=29 <…> van Grieken NCT (https://www.ncbi.nlm.nih.gov/pubmed/?term=van%20Grieken%20NCT%5BAuthor%5D&cauthor=true&cautho et al. Chemotherapy versus chemoradiotherapy after surgery and preoperative chemotherapy for resectable gastric cancer (CRITICS): an international, open-label, randomised phase 3 trial. Lancet Oncol, (https://www.ncbi.nlm.nih.gov/pubmed/?term=CRITICS+trial+gastric+lancet) 2018 Apr 9. pii: S1470-2045(18)30132-3. doi: 10.1016/S1470-2045(18)30132-3. [Epub ahead of print]
42. E. Van Cutsem, C Boni, J. Tabernero, et al. Docetaxel plus oxaliplatin with or without fluorouracil or capecitabine in metastatic or locally recurrent gastric cancer: a randomized phase II study. Ann Oncol. (https://www.ncbi.nlm.nih.gov/pubmed/25416687) 2015 Jan; 26(l): 149-56.
43. Shah MA (https://www.ncbi.nlm.nih.gov/pubmed/?term=Shah%20MA%5BAuthor%5D&cauthor=true&cauthor_uid=26438 Jaiijigian YY (https://www.ncbi.nlm.nih.gov/pubmed/?term=Janjigian%20YY%5BAuthor%5D&cauthor=true&cauthor_uid=2(Stoller R (https://www.ncbi.nlm.nih.gov/pubmed/?term=Stoller%20R%5BAuthor%5D&cauthor=true&cauthor_uid=26438 et al. Randomized Multicenter Phase II Study of Modified Docetaxel, Cisplatin, and Fluorouracil (DCF) Versus DCF Plus Growth Factor Support in Patients With Metastatic Gastric Adenocarcinoma: A Study of the US Gastric Cancer Consortium. J Clin Oncol. (https://www.ncbi.nlm.nih.gov/pubmed/26438119) 2015 Nov 20; 33(33): 3874-9.
44. Ajani JA (https://www.ncbi.nlm.nih.gov/pubmed/?term=Ajani%20 JA%5B Author%5D &cauthor=true&cauthor_uid=17664 Moiseyenko VM (https://www.ncbi.nlm.nih.gov/pubmed/?term=Moiseyenko%20VM%5BAuthor%5D&cauthor=true&cauthor_uid Tjulandin S (https://www.ncbi.nlm.nih.gov/pubmed/? term=Tjulandin%20S%5BAuthor%5D&cauthor=true&cauthor_uid=17 <…> (et al. Clinical benefit with docetaxel plus fluorouracil and cisplatin compared with cisplatin and fluorouracil in a phase HI trial of advanced gastric or gastroesophageal cancer adenocarcinoma: the V-325 Study Group. J Clin Oncol. (https://www.ncbi.nlm.nih.gov/pubmed/17664467) 2007 Aug 1; 25(22): 3205-9.
45. Kang JH (https://www.ncbi.nlm.nih.gov/pubmed/? term=Kang%20JH%5BAuthor%5D&cauthor=true&cauthor_uid=22412 <…> Lee SI (https://www.ncbi.nlm.nih.gov/pubmed/?term=Lee%20SI%5BAuthor%5D&cauthor=true&cauthor_uid=2241214 <…> Lim DH (https://www.ncbi.nlm.nih.gov/pubmed/?term=Lim%20DH%5BAuthor%5D&cauthor=true&cauthor_uid=224121 <…> et al. Salvage chemotherapy for pretreated gastric cancer: a randomized phase HI trial comparing chemotherapy plus best supportive care with best supportive care alone. J Clin Oncol. (https://www.ncbi.nlm.nih.gov/pubmed/22412140) 2012 May 1; 30(13): 1513-8.
46. Hironaka S (https://www.ncbi.nlm.nih.gov/pubmed/?term=Hironaka%20S%5BAuthor%5D&cauthor=true&cauthor_uid=241 <…> Ueda S (https://www.ncbi.nlm.nih.gov/pubmed/?term=Ueda%20S%5BAuthor%5D&cauthor=true&cauthor_uid=241901 <…> Yasui H (https://www.ncbi.nlm.nih.gov/pubmed/?term=Yasui%20H%5BAuthor%5D&cauthor=true&cauthor_uid=241901 <…> et al. Randomized, open-label, phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum: WJOG 4007 trial. J Clin Oncol. (https://www.ncbi.nlm.nih.gov/pubmed/24190112) 2013 Dec 10; 31(35): 4438-44.
47. Wilke H (https://www.ncbi.nlm.nih.gov/pubmed/?term=Wilke%20H%5BAuthor%5D&cauthor=true&cauthor_uid=252401 <…> Muro K (https://www.ncbi.nlm.nih.gov/pubmed/?term=Muro%20K%5BAuthor%5D&cauthor=true&cauthor_uid=252408 <…> Van Cutsem E (https://www.ncbi.nlm.nih.gov/pubmed/?term=Van%20Cutsem%20E%5BAuthor%5D&cauthor=true&cauthor_u <…> et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. (https://www.ncbi.nlm.nih.gov/pubmed/25240821) 2014 Oct; 15(11): 1224-35.
48. Fuchs CS (https://www.ncbi.nlm.nih.gov/pubmed/?term=Fuchs%20CS%5BAuthor%5D&cauthor=true&cauthor_uid=24094 <…> Tomasek J (https://www.ncbi.nlm.nih.gov/pubmed/?term=Tomasek%20J%5BAuthor%5D&cauthor=true&cauthor_uid=2409 <…> Yong C J (https://www.ncbi.nlm.nih.gov/pubmed/?term=Yong%20CJ%5BAuthor%5D&cauthor=true&cauthor_uid=240947 <…> et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. (https://www.ncbi.nlm.nih.gov/pubmed/24094768) 2014 Jan 4; 383(9911): 31 — 39.
49. Kang, Y.-K., Boku, N., Satoh, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, 2017, 390(10111): 2461 — 2471.