Клинический случай рак желудка
По материалам:A multidisciplinary approach to an unusual medical case of locally advanced gastric cancer: a case report
Nicola Carlomagno, Fabrizio Schonauer, Vincenzo Tammaro, Annalena Di Martino, Carmen Criscitiello, Michele L. Santangelo
Journal of Medical Case Reports 2015, 9:13
81‑летняя женщина поступила в терапевтическое отделение с жалобами на общую слабость, потерю веса, рвоту и боли в животе. В анамнезе: гипертоническая болезнь и холецистэктомия по поводу острого холецистита. При осмотре обнаружена припухлость на передней брюшной стенке, высказано предположение о послеоперационной грыже. Однако при эндоскопическом исследовании выявлена опухоль антрального отдела желудка. В следующие несколько дней над описанной припухлостью образовалась сначала небольшая кожная язва, а затем сформировался свищ. Пациентка была переведена в хирургическое отделение.
Для справки
Пан-цитокератин (общий цитокератин, цитокератин АЕ1/АЕ3) — смесь моноклональных антител к различным цитокератинам, белкам цитоскелета эпителиальных клеток. Используется для дифференциальной диагностики рака и неэпителиальных опухолей.
Хромогранин А содержится в гранулах большинства нейроэндокринных клеток. Специфичный маркер нейроэндокринных опухолей разного происхождения.
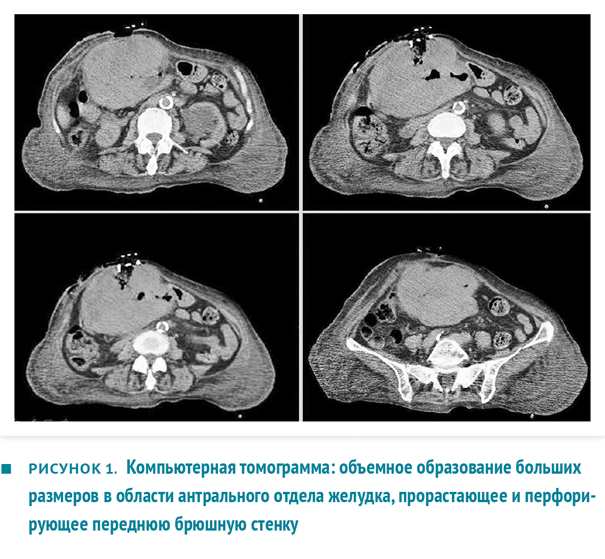
При лабораторном исследовании выявлены гипопротеинемия 46 г/л, гипоальбуминемия 20 г/л и анемия (гемоглобин 83 г/л). При выполнении компьютерной томографии (КТ) описано массивное образование 10×14×15 см в области антрума с центральным некрозом и кровоизлияниями, со слабой васкуляризацией, без четкой границы с левой долей печени (рис. 1). Опухолевая масса врастала в поперечную ободочную кишку и прямую мышцу живота, занимала значительную часть верхнего этажа брюшной полости и формировала наружный свищ. При КТ-исследовании не обнаружено метастазов.
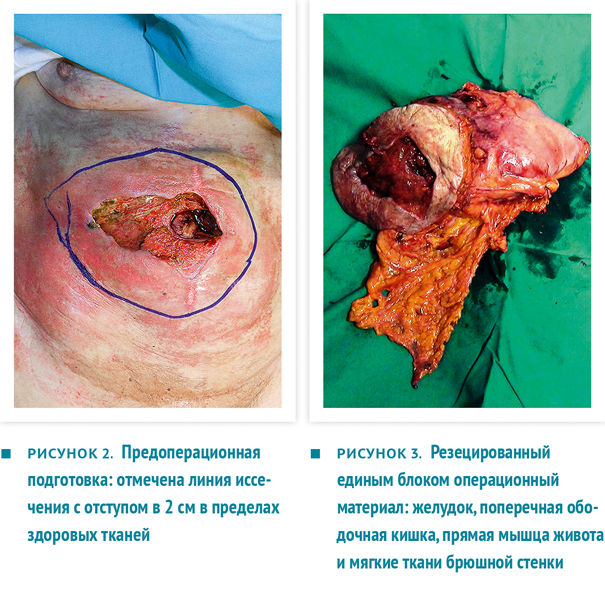
Проведено хирургическое лечение. Вокруг неопластического поражения выполнен эллиптический разрез в пределах 2 см здоровых тканей (рис. 2). Боковые края расширены линейными разрезами.
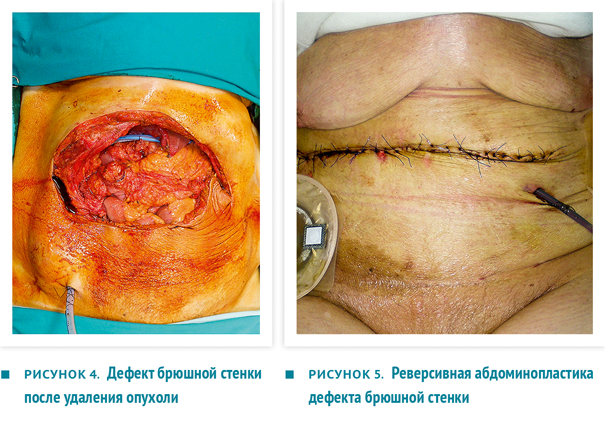
Единым блоком резецированы участок передней брюшной стенки, часть желудка и часть ободочной кишки (рис. 3), проведена систематическая лимфодиссекция, после чего наложен аппаратный гастроеюноанастомоз и ручной тонко-толстокишечный анастомоз. Установлены 2 внутрибрюшных дренажа (рис. 4).
Дефект передней брюшной стенки протезирован сетчатым трансплантатом, рана закрыта методом реверсивной абдоминопластики (рис. 5). Внутрибрюшное давление в ходе оперативного вмешательства и в послеоперационном периоде было
ниже 10 мм. рт. ст.

Для справки
CD56 — молекула клеточной адгезии, в норме экспрессируется на поверхности натуральных киллеров, нейронов, клеток глии, скелетных мышц. Определяется на клетках многих солидных и гематологических опухолей.
Виментин — белок цитоскелета клеток мезодермального происхождения, в частности соединительной ткани. Обнаруживают при фиброзных опухолях, саркомах, мезотелиоме.
Синаптофизин участвует в формировании синаптических пузырьков в нервных клетках. Маркер нейроэндокринных опухолей.
Белок S-100 — семейство кальций-связывающих белков, повышение концентрации наблюдается при прогрессии меланомы.
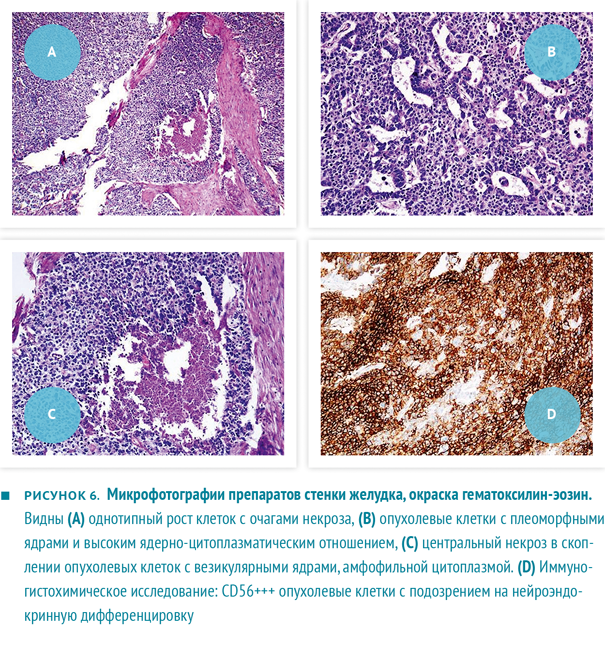
По данным гистологического исследования, удаленная опухоль соответствовала малодифференцированной аденокарциноме с чертами нейроэндокринной дифференцировки с прорастанием до слизистой оболочки поперечной ободочной кишки и мягких тканей до кожи (рис. 6а‑с). При иммуногистохимическом исследовании выявлено позитивное окрашивание к пан-цитокератину, хромогранину и CD56 (рис. 6d), негативное — к виментину, синаптофизину и S-100.
Состояние пациентки в раннем послеоперационном периоде было удовлетворительным. По поводу анемии легкой степени проведены гемотрансфузии в первые 3 дня. Активная перистальтика отмечена с 3‑го дня. С 6-го дня, после контрастного рентгенологического исследования верхних отделов ЖКТ, пациентка начала самостоятельно принимать пищу.
К сожалению, с 10‑го дня у пациентки на фоне пневмонии развился тяжелый респираторный дистресс-синдром. Несмотря на проводимую антибактериальную терапию и перевод в отделение интенсивной терапии, она умерла на 20‑й день после операции.
Обсуждение
Несмотря на то что рак желудка часто обнаруживают только на поздних стадиях [1, 2], прорастание опухолью брюшной стенки с ее деструкцией и формированием наружного желудочного свища встречается редко. Обычно поражение опухолевыми клетками ограничивается серозными оболочками и прилежащими тканями смежных органов [3]. В литературе описаны единичные случаи серьезного поражения кишечника при раке желудка и манифестации болезни с кишечной непроходимости [4–7], прямокишечного кровотечения, запоров и тенезмов [8]. Еще более редки случаи доминирования симптомов массивного прорастания брюшной стенки. Описан 62‑летний пациент с диффузной инвазией опухолевых клеток в переднюю брюшную стенку при раке желудка, однако без ее полного разрушения [9].
Ранее опубликованы случаи гастроинтестинальных стромальных опухолей желудка, достигавших гигантских размеров и отличавшихся быстрым ростом по сравнению со «средними» аденокарциномами [10, 11], но в данном случае описан ранее не представленный тип этой опухоли — нейроэндокринный.
Публикация клинического случая и сопутствующих иллюстраций осуществлялись с одобрения родственников пациентки. Копия подписанного информированного согласия находится у главного редактора журнала «Journal of medical case reports».
В запущенных случаях рака желудка возможности терапии обычно ограничены неоадъювантной химиотерапией с гастростомией или еюностомией. В описанном случае подобная тактика была неприменима из‑за обширного дефекта брюшной стенки и вовлечения поперечной ободочной кишки. Было принято решение о резекции всех пораженных органов единым блоком.
При онкологических операциях во избежание контаминации опухолевыми клетками распространено широкое иссечение больших участков мягких тканей. Устранение кожного дефекта после оперативных вмешательств возможно пластикой на питающей ножке местными и отдаленными тканями, либо с переносом свободного кожного лоскута [1]. Для реконструкции дефекта верхней части передней брюшной стенки могут быть использованы кожно-мышечные лоскуты на основе прямой мышцы живота или широчайшей мышцы спины. При значительном поражении местных тканей может потребоваться свободная кожная пластика. Ее преимущество — лучший косметический эффект, а недостатки — более длительное время операции, возможность отторжения трансплантированного лоскута и большие повреждения донорского участка.
Альтернативой перечисленным методам может быть использованная в описанном случае реверсивная абдоминопластика [12]. Кожу нижнего края операционной раны вместе с поверхностной фасцией отделяют от мышечного футляра. Разрез продолжают до лобковой области, полученный лоскут подтягивают кверху для закрытия дефекта брюшной стенки. Реверсивная абдоминопластика чаще используется в пластической хирургии для коррекции формы живота после значительной потери веса [13, 14] и редко — для реконструктивных операций после резекции опухоли [15–17]. Она может быть использована в комбинации с другими типами лоскутов, а также для покрытия сетчатого эндопротеза.
Стоит отметить особо, что смерть пациентки наступила не из‑за хирургических осложнений. Внутрипузырное измерение внутрибрюшного давления рутинно проводили на всех этапах терапии, наиболее угрожаемых по развитию внутрибрюшной гипертензии и абдоминального компартмент-синдрома. Оперативное вмешательство проведено усилиями хирурга-онколога и пластического хирурга с применением адекватной техники. Авторы статьи убеждены в пользе и важности индивидуального подхода и нестандартных решений в сложных случаях хирургического вмешательства при онкологических заболеваниях.
Список источников
- Santangelo M, et al. Extended total gastrectomy: indications in the 3rd millennium. Minerva Chir. 2001;56 (1):1–6.
- Tammaro V, et al. Prognostic value of splenectomy and lymph-node dissection during gastric cancer resection. Chir Ital. 2006;58 (2):163–70.
- Feczko PJ, et al. Metastatic disease involving the gastrointestinal tract. Radiol Clin North Am. 1993;31:1359–73.
- Tomikashi K, et al. Gastric cancer metastatic to the colon. Gastrointest Endosc. 2002;55:561.
- Kumagai K, et al. Octreotide acetate successfully treated a bowel obstruction caused by peritoneally disseminated gastric cancer, thereby enabling the subsequent use of oral S-1 chemotherapy. Int J Clin Oncol. 2009;14:372–5.
- Fukuda Y, et al. A case of advanced gastric cancer with direct invasion of the transverse colon responding to paclitaxel/5′-DFUR combined therapy. Gan To Kagaku Ryoho. 2005;32:1945–8.
- Yu X, Zhang J. Gastric cancer with large bowel obstruction as the first presentation: a case report. Oncol Lett. 2013;6:1377–9.
- Alegre R, et al. Gastric cancer: an unusual presentation. Acta Gastroenterol Latinoam. 2003;33 (1):29–32.
- Waguri N, et al. A case of gastric cancer with abdominal wall invasion treated by weekly low-dose paclitaxel therapy. Gan To Kagaku Ryoho. 2006;33 (8):1151–4.
- Aomatsu N, et al. A case of emergency resection of a giant gastrointestinal stromal tumor of the stomach associated with hemorrhagic shock. Gan To Kagaku Ryoho. 2013;40 (12):2185–7.
- Okada K, et al. A case of gastrointestinal stromal tumor of the stomach with rapid growth in a short term. Gan To Kagaku Ryoho. 2008;35 (12):2080–2.
- Halbesma GJ, van der Lei B. The reverse abdominoplasty: a report of seven cases and a review of English-language literature. Ann Plast Surg. 2008;61:133–7.
- Akbas H, et al. The combined use of classic and reverse abdominoplasty on the same patient. Plast Reconstr Surg. 2002;109:2595–6.
- Hurwitz DJ. Single-staged total body lift after massive weight loss. Ann Plast Surg. 2004;52:435–41.
- Pantelides NM, et al. Reverse abdominoplasty: a practical option for oncological trunk reconstruction. Eplasty. 2013;13: e2.
- Bury TF, et al. Closure of massive chest wall defects after full-thickness chest wall resection. Ann Plast Surg. 1995;34:409–14.
- Dagregorio G, Darsonval V. Aesthetic surgery techniques after excision of dermatofibrosarcoma protuberans: a case report. Br J Plast Surg. 2005;58:556–60.
Клинический случай терапии 76-летней женщины с раком желудка в больнице Массачусетса (США)
ДЖОН МУЛЛЕН, MD, Больница Массачусетса
ПРЕЗЕНТАЦИЯ ИСТОРИИ БОЛЕЗНИ
76-летняя пациентка поступила в многопрофильную онкологическую клинику, специализирующуюся на лечении патологии желудочно-кишечного тракта, для лечения аденокарциномы тела желудка. Пациентка представила своему лечащему врачу четырехнедельный анамнез заболевания с жалобами на боль и чувство сдавления в грудной клетке с иррадиацией в спину. При обследовании – кардиальной патологии не было выявлено, включая функциональные стресс-тесты и ультразвуковое исследование. Также пациентку беспокоила боль в эпигастральной области, и, учитывая, что в 2003 году у нее была обнаружена инфекция H. pylori, женщина была обеспокоена, что у нее может быть язвенная болезнь желудка. Было проведено эндоскопическое исследование и обнаружена большая изъязвленная опухоль в теле желудка (рис. 1).

Рис.1. Большая изъязвленная опухоль в теле желудка
Патологическое исследование биопсийных образцов показало умеренно- и малодифференцированную аденокарциному. Проведение компьютерной томографии (КТ) грудной клетки, брюшной полости и органов таза показало только увеличенные лимфатические узлы по малой кривизне желудка и желудочно-печеночной связки и отсутствие признаков метастатического заболевания. Болевой синдром в эпигастральной области у пациентки возникал натощак и, как правило, уменьшался после приема пищи. Ухудшения аппетита и снижения веса пациентка не отмечала. У нее не было тошноты, рвоты, раннего чувства насыщения или изменений в работе кишечника. В анамнезе у пациентки — сахарный диабет II типа, гипертония, гиперхолистеринемия, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), дивертикулез, эндометриоз, мочекаменная болезнь и остеопения. Она принимала аторвастатин, индерал, лизиноприл, метформин, омепразол и паксил. У нее отмечены аллергические реакции на диазид, морфин, внутривенный контраст, аспирин и крем триамцинолон. Пациентка замужем, имеет двоих детей, работала ассистенткой в исследовательском институте, сейчас на пенсии. Она никогда не курила и не употребляла алкоголь. Анамнез в плане рака желудка не отягощен, но ее старший брат умер от метастатического рака толстой кишки (с наличием метастазов в печени и легких) в возрасте 90 лет. При обследовании вес пациентки составлял 182 фунта, артериальное давление 182/90 мм рт. ст., пульс 90 ударов в минуту и температура 97,2 градуса по Фаренгейту. При пальпации – умеренная болезненность в эпигастральной области без признаков увеличения печени. Результаты полного анализа крови, уровни электролитов в плазме и тесты функции почек и печени были нормальными.

ОБСУЖДЕНИЕ ТАКТИКИ ВЕДЕНИЯ ПАЦИЕНТКИ
У этой пациентки имеет место рак желудка, который, как представляется при изучении изображений, локально распространенный. Первое решение, касающееся тактики ведения пациентки, заключается в вопросе: следует ли немедленно его резецировать или провести предоперационную химиотерапию с предоперационной лучевой терапией или без нее.
Лечение локорегионального рака желудка поздней стадии
Хотя операция является основой лечения рака желудка, даже после полной резекции более половины пациентов с локально развитыми опухолями имеют рецидив, и менее 40%- выживаемость более 3 лет. Соответственно, исследователи по всему миру изучили целый ряд адъювантных и неоадъювантных мультимодальных методов лечения этого заболевания. В Северной Америке стандартным подходом остается хирургическая операция с последующей адъювантной химиолучевой терапией (выводы основанны на результатах исследования Intergroup 0116, в котором показано, что послеоперационная химиолучевая терапия с флуороурацилом (ФУ) повышает общую выживаемость в сравнение с одной лишь хирургической операцией). Еще один стандарт терапии пациентов с раком желудка после резекции в Северной Америке и Европе появился через несколько лет после публикации исследования MAGIC3 и многоцентрового исследования FNCLCC/FFCD III фазы через несколько лет после этого. В исследовании MAGIC сообщалось об улучшении показателей общей выживаемости при использовании периоперационного эпирубицина, цисплатина и ФУ по сравнению с одной только хирургической операцией, а в исследовании FNCLCC/FFCD было продемонстрировано улучшение показателей резекции R0 и выживаемости при использовании периоперационного ФУ/кальция фолината и цисплатина. Учитывая преклонный возраст и сопутствующую соматическую патологию у пациентки мультидисциплинарной командой хирургической онкологии, медицинской онкологии и радиационной онкологии было принято решение, что самым безопасным подходом была бы оперативная хирургия, а затем послеоперационная химиотерапия и лучевая терапия, хотя пациентка находилась в группе высокого риска осложнений химиотерапии ECF или даже более мягкого режима ФУ, кальция фолината и оксалиплатина (FOLFOX). Т.е., мультидисциплинарная командна не хотела исключать наиболее важный компонент программы лечения — гастрэктомию. Соответственно, пациентка был подготовлена для хирургического вмешательства, осмотрена кардиологом и терапевтом и доставлена в операционную комнату для субтотальной гастрэктомии и D2-лимфаденэктомии. Поскольку рак желудка часто распространяется на региональные лимфатические узлы, и поскольку, по крайней мере, 16 лимфатических узлов должны быть удалены и исследованы патологоанатом для наиболее точной постановки диагноза рака желудка, обычно в клинике удаляются не только лимфатические узлы, непосредственно прилегающие к желудку (так называемые лимфатические узлы D1, на позициях 1-6), но также удаляется и второй ряд лимфатических узлов вдоль основных кровеносных сосудов печени, желудка и селезенки (так называемые лимфоузлы D2, на позициях 7-12 ) (рис. 2А и 2В).




Фактически, с 2006 года мы выполняем эту технически сложную «D2-лимфаденэктомию» с низким риском осложнений и без смертельных исходов, среднее число исследуемых лимфатических узлов составляет 40, и более чем у 90% было исследовано 16 и более лимфоузлов. В ходе конкретной операции этой пациентки мы удалили приблизительно 80% желудка и восстановили желудочно-кишечный тракт с помощью анастомоза Ру-Ан-Y (рис. 3). Эта процедура была выполнена через открытый подход через верхний срединный разрез брюшной полости и была несложной. Ее послеоперационный курс был ничем не примечателен, и ее выписали домой на шестой день после операции с рекомендациями в плане щадящей диеты, состоящей из шести небольших по объему приемов пищи, равномерно распределенных в течение дня.


Результаты биопсии и роль адъювантной химиолучевой терапии
Результаты биопсии показали опухоль 4 см в теле желудка, умеренно- слабодифференцированную, которая была классифицирована как pT3 (опухоль проникает в субсерозный слой) и pN2 (3 узла положительны из 31 исследованного узла), или стадия IIIA1. Все края были отрицательными, и имелись свидетельства как периневральной, так и лимфо-сосудистой инвазии. Основываясь на поздней стадии рака у пациентки и результатах исследования Intergroup 0116, которое показало преимущество в плане показателей выживаемости после адъювантной химиолучевой терапии, ей назначили восемь циклов химиотерапии FOLFOX, а затем пять недель химиолучевой терапии на 5 FU в 45 Гр. Пациентка очень хорошо переносила всю эту терапию и на текущий момент нет активных жалоб и объективных признаков болезни . Ее шансы на долгосрочное выживание составляют порядка 30%, и это в значительной степени из-за скоординированных усилий мультидисциплинарной команды, которая специализируется на раке желудка.
По материалам Massachusetts General Hospital
Ссылки
1. Edge SB, Byrd DR, Compton CC, et al. AJCC cancer staging manual. 7th ed. New York: Springer-Verlag;2009:117-126.
2. Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal
junction. N Engl J Med. 2001;345:725-730.
3. Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355:11-20.
4. Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol. 2011;29:1715-1721.
5. Schmidt B, Chang KK, Maduekwe UN, et al. D2 lymphadenectomy with surgical ex vivo dissection into node stations for gastric adenocarcinoma can be performed safely in Western patients and ensures optimal staging. Ann Surg Oncol 2013;20:2991-2999.
6. Mullen JT. Subtotal gastrectomy for gastric cancer. In: Fischer JE, Bland KI, Callery MP, Clagett GP, Jones DB, editors. Mastery of Surgery. Philadelphia: Lippincott, Williams, and Wilkins; Sixthedition, 2012.
Пациентка Н., 54 года.
Перенесенные заболевания — корь в детстве.
Оперативные вмешательства: 1995 год-фиброма левой молочной железы.
Гинекологический анамнез- климакс 2 года, 1 беременность, 1 роды.
В анамнезе- варикозное расширение вен н/к,, остеохондроз шейного отдела позвоночника.
Аллергологический анамнез не отягощен.
Наследственность- мать — рак желудка, отец — ОНМК.
Обратилась к гинекологу с жалобами на чувство дискомфорта внизу живота, бели, так же обращалась к урологу с жалобами на учащенное мочеиспускание с резью.
Проведенные исследования
УЗИ органов малого таза: эхографическая картина объемного образования правого яичника, миом тела матки, признаки полипов цервикального канала.
Общий анализ крови: Гемоглобин 129.10 г/лЭритроциты 4.30 10^12 / л Гематокрит 36.41
Общий анализ мочи: Эритроциты неизмененные 1,2.
- ЭКГ, рентген органов грудной полости без патологии.
Эзофагогастродуоденоскопия
Выходной отдел желудка выраженно деформирован за счет опухолевидного образования до 3-4 см, осмотр несколько затруднен вследствие локализации и деформации просвета, определяется язвенный дефект в центре до 10 мм с прикрытым фибрином дном.
Выполнена биопсия для гистологического исследования, слизистая при биопсии ригидная, хрящевидной плотности, фрагментируется, выраженно кровоточит.
Заключение: Опухолевидное образование антрального отдела желудка с переходом на привратник с деформацией и незначительным сужением просвета, биопсия
Колоноскопия
В области поперечноободочной кишки определяется крупное стенозирующее циркулярное образование до 5 см, суживающее просвет кишки до 1 см, выраженно контактно кровоточит, с трудом проходимо аппаратом, биопсия на гистологическое исследование (с помощью струны-проводника для лучшего позиционирования аппарата).
При гистологическом исследовании из образования желудка: хронический поверхностный умеренно выраженный неактивный гастрит с фовеолярной периульцерозной гиперплазией, аденомой с изъязвлением. Убедительных признаков злокачественного роста в объеме исследованного материала нет.
При гистологическом исследовании из образования толстой кишки: фрагменты тубуло-ворсинчатой аденомы с фокусами тяжелой дисплазии.
Онкомаркеры:
РЭА 160.6
СА 19.9 884.7
СА-125 156.0
ПЭТ/КТ
Гиперметаболический процесс в утолщенных стенках ободочной кишки и окружающей клетчатке – может соответствовать опухолевому процессу. Гиперметаболические образования по брюшине – вероятнее всего метастатического характера.
В связи с результатами гистологического исследования, было принято решение о повторных исследованиях с биопсией, выполнены через 3 дня.
Гистологическое исследование образования желудка: В пределах доставленного на исследование материала морфологическая картина умеренного хронического гастрита с гиперплазией покровно-ямочного эпителия, участками значительного отека, фокусами фиброза стромы собственной пластинки слизистой. Опухолевого роста в пределах данного материала не обнаружено.
Данный результат гистологического исследования был ожидаем вследствие того, что данная опухоль является прорастанием опухоли поперечноободочной кишки, что видно по снимкам, и, вероятнее всего, на момент осмотра нет прорастания в слизистую оболочку желудка.
Гистологическое исследование образования толстой кишки: в одном из представленных фрагментов — фиброзная ткань с комплексами аденокарциномы.
Данный клинический случай интересен тем, что, несмотря на количество биопсийных фрагментов (в общей сложности взято более 14 фрагментов за два исследования), прицельную биопсию из очагов наиболее измененной бесструктурной слизистой с участками депрессии и нарушением сосудистого рисунка, а так же использование биопсийных щипцов с объемными браншами для множественной биопсии с накопителем, существуют трудности диагностики образований вследствие мозаичности гистологического строения опухоли даже крупных образований органов желудочно-кишечного тракта, иногда требующие повторных эндоскопических исследований.
Рак толстой кишки является одним из наиболее распространенных злокачественных новообразований. Согласно статистическим данным последнего десятилетия, показатели заболеваемости и смертности больных РТК неуклонно растут в России и экономически развитых странах. Так, с 2003 по 2013 г. прирост злокачественных новообразований ободочной кишки составил 23,43 %, прямой кишки, ректосигмоидного отдела, ануса – 17,90 %.
Частота метастатических опухолей яичников (метастаз Крукенберга), по данным различных авторов, колеблется от 4,18 до 63 % всех злокачественных опухолей этого органа. Наиболее часто в яичники метастазируют опухоли женской репродуктивной системы, молочной железы и опухоли органов желудочно-кишечного тракта.
Метастазы в яичники при опухолях толстой кишки составляют по данным различных авторов от 1,7 до 12 % случаев. Частота первично-множественных злокачественных новообразований (ПМЗН) яичников и толстой кишки колеблется от 0,8 до 12,6 %.
Клиническая картина РТК с метастазами в яичники отличается малой выраженностью. При распространенном процессе отмечается нарушение функции яичников, болевые ощущения внизу живота и увеличение его объема, расстройства функции смежных органов (нарушение мочеиспускания), общие нарушения. Для ранней диагностики поражения яичников в диагностический алгоритм необходимо включение определение уровня опухолевых маркеров РЭА, СА 19–9, СА 125, УЗИ органов малого таза и брюшной полости.
ЛИТЕРАТУРА
1.Казакевич В.И., Митина Л.А., Востров А.Н., Гуц О.В. Ультразвуковая диагностика метастатического поражения яичников при раке желудочно-кишечного тракта. Ультразвуковая и функциональная диагностика 2009;5:14. [Kazakevitch V.I., Mitina L.A., Vostrov A.N. Guts O.V. Ultrasound diagnosis of metastatic disorder of ovarian in cancer of the gastrointestinal tract. Ultrazvukovaya i funktsionalnaya diagnostika = Ultrasound and functional diagnostics 2009;5:14 (In Russ.)].
2.Казаков М.П., Поддубная И.В., Любченко Л.Н., Харитонова Т.В. Наслед- ственный рак яичника (литературный обзор). Современная онкология 2012;1(14):47–54. [Kazakov M.P., Poddubnaya I.V., Lubchenco L.N., Kharitonova T.V. Hereditary ovarian cancer (literature review). Sovremennaya onkologiya =Modern oncology 2012;1(14):47–54 (In Russ.)].
3.Паяниди Ю.Г., Сельчук В.Ю., Жордания К.И. и др. Полинеоплазии женского генитального тракта: первичномножественные новообразования или метаста- зы? Архив патологии 2006;4:16–20. [Payanidi Y.G., Selchuk V.Y., Jordania K.I. et al. Polyneoplasia of female genital tract: multiple primary tumors or metastases? Arkhiv patologii = Archives of pathology 2006;4: 16–20 (In Russ.)].
4.Паяниди Ю.Г., Сельчук В.Ю., Жордания К.И. и др. Первично-множественные злокачественные новообразования половых органов у женщин: пути профи- лактики. Опухоли женской репродуктив- ной системы 2010;1:51–4. [ Payanidi Y.G., Selchuk V.Y., Jordania K.I. et al. Multiple primary malignant neoplasms of genital organs in women: the way of prevention. Opukholi zhenskoy reproduktivnoy sistemy = Tumors of the female reproductive system 2010;1: 51–4 (In Russ.)].
5.Попова Т.Н. Диагностика и лечебная тактика у больных с первично-множественными синхронными злокачественными опухолями. Дис. … д-ра мед. наук. М., 2002. [Popova T.N. Diagnosis and treatment strategy in patients with multiple primary synchronous malignant tumors. Thesis … Dr. sci. med. M., 2002 (In Russ.)].
6.Kim D.D., Park I.J., Kim H.C. et al. Ovarian metastases from colorectal cancer: a clinicopathological analysis of 103 patients. Colorectal Dis 2009 Jan;11(1):32–8.
7.Omranipour R., Abasahl A. Ovarian metastases in colorectal cancer. Int J Gynecol Cancer 2009 Dec;19(9):1524–8.
8.Simon M.S., Petrucelli N. Hereditary breast and ovarian cancer syndrome: the impact of race on uptake of genetic counseling and testing. Methods Mol Biol 2009;471:487–500.
La Vecchia C. Epidemiology of ovarian cancer: a summary review. Eur J Cancer Prev 2001;10:125–9.