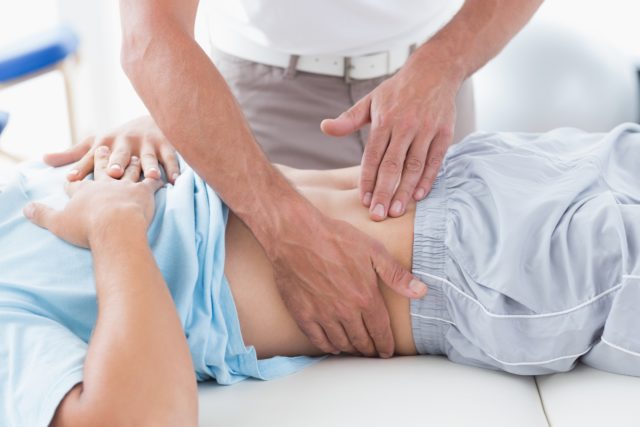
Эндоскопическое удаление рака желудка

Заболеваемость раком желудка не снижается, причём неуклонно, ежегодно больных раком желудка в России становится на 33 тысячи больше, а проживут год чуть более половины. Больные с метастазами — четвёртая стадия, что бы ни делалось в медицине, по-прежнему, как и двадцать лет назад в структуре рака желудка занимают 41,2% от всех. Но отрадно, что доля I–II стадии медленно, но подрастает, составив суммарно 29,6%, и уже перекрыли III стадию — 25,8%.
В конце прошлого столетия, когда рак желудка был в тройке лидеров среди всех злокачественных опухолей, практически не использовали такое понятие как «ранний рак». Сегодня совсем другая картина: ранний рак можно диагностировать, разработаны специальные методики его лечения. Ранний рак — поверхностная опухоль, которая к моменту выявления не только не достигла значительных размеров в желудке, и, возможно, не успела дать метастазов.
При раннем раке желудка метастазы в ближайших к желудку лимфатических узлах находят в 10–15%, если опухолевые клетки не вышли за пределы слизистой, то поражение лимфоузлов выявляется у трёх из сотни оперированных. Видимое только под микроскопом распространение опухолевых клеток из слизистой в подслизистый слой, приводит к семикратному увеличению процента поражённых раковыми клетками лимфатических узлов.
Локализация злокачественных клеток в пределах слизистой оболочки желудка позволяет 90% больных рассчитывать прожить не только 5 лет, но и дольше. Поскольку рак желудка в среднем выявляется в 66,9 лет и преимущественно «мужская» болезнь, то после лечения раннего рака желудка есть возможность жить до самой смерти от чего-то другого, но не от рака.
Где развивается рак желудка?
Рак развивается в эпителии слизистой оболочки желудка. Толщина всей слизистой оболочки от полутора до двух миллиметров, и это вместе эпителий, лежащая под ним собственная пластинка, пронизанная сосудиками, и мышечная пластинка из трёх рядов гладкомышечных клеток. Вот и вся слизистая, под которой находится подслизистый слой.
Что же такое ранний рак желудка?
Это маленькая опухоль, которую можно увидеть. Когда рак локализуется только в эпителии слизистой, не просочился через пластинки — без инвазии, и вообще ещё даже не имеет собственной сосудистой сети, это 0 стадия рака, которая раньше обозначалась как рак in situ.
Стадия I считается ранним раком желудка, который делится на два варианта: стадия Т1а — опухоль занимает только слизистую оболочку, стадия Т1b — опухоль просочилась в подслизистый слой. Это уже рак видимый глазом, он может быть поверхностным или плоским, но не должен быть более 2 см в диаметре, и, конечно же, не вовлекать в раковый процесс ничего кроме слизистой с подлежащим слоем.
Ранний рак обнаруживают, как правило, плановом профилактическом осмотре. Так делают в Японии, жители которой весьма подвержены раку желудка. В России, к примеру, при диспансерном наблюдении или по поводу обострения у язвенника или у пациента с хроническим анацидным гастритом во время эндоскопии выявляется новообразование или берётся биопсия из давней язвы, а там уже рак. Внедряемая Минздравом система диспансеризации населения предусматривает расширенное обследование некоторых категорий населения, но пока проблема скрининга рака желудка остаётся глубоко личной.
Обязательные обследования при раннем раке
Для чего выделяется такая форма как ранний рак? Преимущественно для минимизации лечения, чтобы выполнить сохраняющую орган, оптимальную операцию. С тех пор, как научились оперировать желудок, человечество познакомилось и с весьма тягостными болезнями оперированного желудка, возникающими из-за значительного уменьшения объёма органа и слишком быстрого прохождения пищи по нему. И проблему значительных анатомо-физиологических нарушений не ликвидируешь, принимая пищу малыми порциями.
Не подготовленная из-за недостаточной обработки желудочным соком пища попадает в тонкую кишку, где вызывает огромный биохимический сбой с выбросом биологически активных веществ, стремительным всасыванием углеводов и избыточной выработкой инсулина. Страдания больных с маленьким желудком тягостны и пожизненны. Поэтому хирурги-онкологи готовы бороться буквально за каждый миллиметр, сохраняя желудок, чтобы в дальнейшем пациент не мучился демпинг-синдромом или пептическими язвами оставшейся культи желудка.
При гарантии действительной локальности опухолевого процесса возможно вмешательство небольшого объёма, и прежде всего, это эндоскопическая операция. Только детальное и всестороннее обследование позволяет гарантировать минимальность опухолевого поражения для возможного выбора эндоскопического вмешательства. Поэтому при планировании эндоскопического лечения выполняется эндосонография — совмещённая с УЗИ эндоскопия желудка. С одной стороны эндоскопом исследуется слизистая желудка, с другой — ультразвуком удаётся изучить всю толщину стенки желудка вокруг опухоли, можно увидеть лимфатические узлы и вовлечение других тканей конкретно в проекции патологического очага. Выполняется биопсия из всех подозрительных на неблагополучие мест.
Дополнительно проводится хромоэндоскопия — обработка слизистой желудка специальным красящим веществом, позволяющим лучше видеть патологию. А современная специальная эндоскопическая оптика делает возможной практически микроскопию участка, планируемого на удаление. Ну и сегодня невозможно обойтись без компьютерной томографии брюшной полости, способной рассмотреть самые укромные уголки организма.
Какие больные могут претендовать на эндоскопическое лечение
Во-первых, существует два варианта эндоскопической резекции: это только удаление слизистой и удаление одним блоком слизистой и подслизистой. Второй вариант используется при вовлечении в процесс подслизистого слоя и при опухоли большего размера у пациентов с высоким риском хирургического вмешательства, что следует понимать как наличие у больного тяжёлых сопутствующих заболеваний, ограничивающих возможности оперативного лечения и наркоза. Но соблюдается главное условие — эндоскопическая операция проводится при раке I стадии, без изъязвлений.
Во-вторых, в отборочные критерии, позволяющие не просто попасть на это весьма привлекательное по минимальности операционной травмы, лечение, но и получить надежду на долгую и здоровую жизнь, внесена степень злокачественности опухоли желудка. Степень злокачественности определяется дифференцировкой клеток. Чем меньше клетки опухоли похожи на нормальные клетки эпителия, тем агрессивнее рак. Подпадают под критерии отбора на органосохраняющую операцию высокодифференцированные и умеренно дифференцированные опухоли. Естественно, что метастазы в лимфатические узлы являются противопоказанием.
Когда ранний рак желудка не подходит для эндоскопического лечения, то есть либо большая протяжённость поражения, либо слишком глубокое проникновение в подслизистый слой, либо высокая степень злокачественности, а то и всё сразу, выполняется стандартная операция. Правда, удаляются только самые близкие к желудку лимфатические узлы. Кстати, результаты лапароскопических операций обнадёживают не меньше традиционных вмешательств через брюшную стенку.
Как и всякая операция, даже такое небольшое вмешательство не свободно от осложнений. Поскольку операция ограничена слизистой оболочкой, то могут быть кровотечения и перфорация, то есть прободение — сквозной дефект стенки, открывающийся в брюшную полость. Как правило, осложнения ликвидируют при эндоскопии, а после назначают лекарственную терапию как при обострении язвенной болезни желудка.
Наша команда врачей, проводящих эндоскопические вмешательства
Эндоскопическая хирургия в лечении онкологических пациентов требует от хирурга высокой точности, виртуозного владения методиками и немалого опыта.
Коллективом врачей Европейской онкологической клиники под руководством руководителя отделения эндоскопии, д.м.н. М. С. Бурдюкова выполнено:
- Более 1000 эндоскопических операций на желчных протоках;
- Более 200 эндоскопических стентирований при опухолях пищевода;
- Более 100 стентирований при опухолях желудка;
- Более 150 стентирований по поводу опухолей двенадцатиперстной кишки;
- Более 100 стентирований при опухолях толстой кишки;
- Более 50 эндоскопических операций у пациентов, ранее перенесших серьезное хирургическое вмешательство.
Эндоскопическое лечение отличает высокая эффективность с минимумом осложнений. Пациенты максимально быстро восстанавливаются, существенно улучшается качество их жизни, а функции стентируемого органа сохраняются.
Цены в Европейской онкологической клинике на диагностику рака желудка
- Биопсия желудка с помощью эндоскопии (без стоимости гистологического исследования) — 4 100 руб.
- Полипэктомия верхних отделов ЖКТ (удаление полипов пищевода или желудка до 3 штук) — 19 800 руб.
- Эндопротезирование желудка — 128 600 руб.
- Эндоскопическая хирургия при новообразованиях желудка (резекция слизистой оболочки с подслизистой диссекцией) — 120 200 руб.
Запись
на консультацию
круглосуточно
Рак желудка — это диагноз, который пугает каждого человека. С современной экологией и принципами образа жизни, количество людей с подобным диагнозом растет с каждым годом. В 90% случаев — причина развития злокачественного процесса – хронический гастрит ассоциированный с Helicobacter Pylori.
Как любая онкологическая патология, заболевание имеет 3 типа лечебного воздействия:
- хирургическое – в настоящее время единственный метод способный полностью излечить от рака данной локализации;
- химиотерапевтическое – вид лечения, при котором опухоль «отравляют» фарм препаратами;
- ионизирующее излучение (лучевая терапия) – лечебный эффект достигается благодаря воздействию на опухоль ионизирующим излучением.
Оперативное лечение при раке желудка бывает нескольких видов:
1. Радикальное лечение. Под словом «радикальное» подразумевается полное удаление опухоли. После таких операций, пациент считается полностью излечённым от злокачественного новообразования. Чаще всего, радикальные операции выполняются пациентам с первой, второй и третьей стадией заболевания. Однако есть некоторые аспекты, когда выполнить радикальное лечение невозможно: наличие отдалённых метастазов, местное распространение опухоли (врастание в близлежащие органы), тяжёлое общее состояние пациента.
2. Паллиативное лечение. Попробуем понять значение термина «паллиативный» на конкретном примере. Рассмотрим диагноз: рак желудка, множественные метастазы в лёгкие. В данном случае наличествуют отдалённые метастазы. Если удалить опухоль желудка, то лечение будет паллиативным, так как на лёгочную ткань хирургически воздействовать никак не получится. Данный вид операций при раке желудка выполняется крайне редко, только при развитии у пациента жизнеугрожающих осложнений (например, массивных кровотечений из опухоли желудка).
3. Симптоматическое лечение – лечение направленно на устранение симптомов заболевания, без удаления первичной опухоли. Выполняется пациентам с 4 стадией заболевания, либо при больших местнораспространённых опухолях.

Выбор оперативного вмешательства всегда решается индивидуально для каждого пациента, исходя из множества факторов.
Радикальные хирургические вмешательства
Эндоскопическая резекция
Эндоскопические методики – это одни из самых современных направлений в желудочной хирургии рака, которые впервые совершили прорыв в лечении в Японии. Суть метода заключается в том, что врач — эндоскопист во время проведения ФГДС иссекает опухоль в пределах жизнеспособных тканей. И пациент без выполнения больших и травматичных операций продолжает жить дальше! Но у данного метода существуют значительные ограничения: он показан пациентам только с самым ранним раком желудка, на том этапе, пока опухоль локализуется только в поверхностных слоях эпителия. К сожалению, на данной стадии рак абсолютно не имеет никаких симптомов, а подобные операции в России носят скорее казуистический характер.
Резекция желудка
Резекция (удаление части органа) – является органосохраняющей операцией. Суть состоит в удалении части органа с опухолью и окружающими опухоль лимфоузлами (лимфодиссекция). Резекции желудка бывают двух видов: дистальная и проксимальная. Выбор вида резекции зависит от того в какой части органа растёт опухоль.
Операция завершается восстановлением непрерывности желудочно-кишечного тракта при помощи подшивания тонкой кишки к стенке резецированного органа с формированием анастомоза (искусственного соустья).
Гастрэктомия
Самая объёмная операция на желудке при раке — гастрэктомия. Она заключается в полном удалении органа. Эту операцию выполняют, при наличии хотя бы одного из следующих условий:
- рак тела желудка;
- диффузно-инфильтративный характер роста опухоли;
- недифференцированные формы рака (перстневидноклеточный).
Восстановление непрерывности желудочного – кишечного тракта после удаления органа заключается в подшивании к пищеводу тонкой кишки.
Резекцию желудка и гастрэктомию выполняют также и в качестве паллиативных операций при развитии жизнеугрожающих состояниях для пациента.
Симптоматические хирургические вмешательства
Как уже было сказано, основная цель симптоматического лечения – это повышение качества жизни пациента, вылечить которого уже по тем или иным причинам невозможно. Опухоль на этом этапе разрастается настолько сильно, что перекрывает просвет органа, делая невозможным питание пациента. Наиболее частые жалобы: тошнота, ощущение переполнения желудка даже при приёме незначительного количества пищи, рвота съеденной едой. Главная миссия врачей – восстановить возможность питания.
Итак, рассмотрим наиболее типовые операции.
Гастростомия
Гастростомия – операция, суть которой сводится к формированию соустья (гастростома) между желудком и внешней средой. Показанием для такого вида лечения являются неудалимые опухоли пищеводно-желудочного перехода. Гастростома позволяет пациенту принимать пищу не через рот, а сразу в желудок, что спасает его от истощения.
Формирование гастроэнтероанастомоза
Гастроэнтероанастомоз – это обходной анастомоз, который формируется между непоражённой частью органа и тонкой кишкой при больших опухолях выходного отдела. Таким образом, пища сначала попадает в желудок, затем эвакуируется сразу в тонкую кишку, минуя опухоль.
Этот вид симптоматической операции является наиболее физиологичным для пациента.
Формирование еюностомы
Это, пожалуй, самый последний предел хирургического лечения, применяемый при тотальном поражении желудка раковой опухолью, когда стенка проросла новообразованием во всех отделах, и нет возможности выполнить какую-либо другую операцию. В таком случае начальный участок тонкой кишки подшивается к передней брюшной стенке и формируется соустье между кишкой и внешней средой (еюностома). Питание пациент получает непосредственно в кишку, что позволяет ему не умереть от мучительной голодной смерти.
Стентирование
Одним из самых современных видов симптоматического лечения является расширение опухолевого стеноза. При этом методе врач — эндоскопист раздвигает участок ракового сужения при помощи стента (своеобразная каркасная распорка), позволяя пациенту питаться через рот достаточно длительное время. К сожалению, в настоящее время метод практикуется не во всех лечебных учреждениях.
Консультации врача при появлении первых жалоб и ежегодный скрининг органов ЖКТ помогут выявить рак на начальной стадии. Это сэкономит потраченное на лечение время, деньги, здоровье. И нужно всегда помнить, что рак излечим при своевременном обращении. Необходимость удаления всего органа (или другая операция при раке желудка) и срок жизни после операции напрямую зависит от стадии процесса, когда началось лечение. Рак желудка после операции требует от пациента особого подхода, который заключается в радикальном изменении образа жизни, принципов питания и трудового режима.
Informo, ergo sum!


Московского
Онкологического
Общества
НЕПОСРЕДСТВЕННЫЕ
И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
ЖИЗНЕДЕЯТЕЛЬНОСТИ ОБЩЕСТВА:
ГОТОВНОСТЬ К ОТЧЕТНО-
ВЫБОРНОМУ ЗАСЕДАНИЮ
И ВЫХОД В СВЕТ СБОРНИКОВ ПРОТОКОЛОВ 2000-2010 ГГ.!
ЗАСЕДАНИЕ 582
состоится в четверг 24 ноября 2011 г. в 17:00
в конференц-зале Клиники Российского онкологического
научного центра им. Н.Н. Блохина
Президиум: проф. А.И. Пачес,
проф. Б.К. Поддубный, проф. В.В. Соколов
Повестка дня:
ЭНДОСКОПИЧЕСКАЯ ХИРУРГИЯ ОПУХОЛЕЙ ЖЕЛУДКА
Доклад:
ЭНДОСКОПИЧЕСКАЯ ДИАГНОСТИКА И ЛЕЧЕНИЕ ПРИ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЯХ ЖЕЛУДКА
Перфильев И.Б., Малихова О.А., Делекторская В.В., Кувшинов Ю.П., Унгиадзе Г.В., Поддубный Б.К., Пирогов С.С.
(Российский онкологический научный центр им. Н.Н. Блохина)
Доклад:
ВОЗМОЖНОСТИ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ МНОЖЕСТВЕННЫМИ КАРЦИНОИДАМИ И ПЕРВИЧНО-МНОЖЕСТВЕННЫМ РАННИМ РАКОМ ЖЕЛУДКА
Соколов В.В., Карпова Е.С., Павлов П.В., Погорелов Н.Н.,
Франк Г.А., Белоус Т.А., Вашакмадзе Л.А.
(Московский научно-исследовательский
онкологический институт им. П.А.Герцена)
Навстречу отчетно-выборному заседанию
Московского онкологического общества
ПОЛНОЕ СОБРАНИЕ ПРОТОКОЛОВ ЗАСЕДАНИЙ
МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
(2000-2010)
 Специальные издания трудов Московского онкологического общества, которые выпускаются как сборники протоколов заседаний, выходят в свет начиная с 2000 г. Первый сборник охватывает период 2000-2003 гг.
Специальные издания трудов Московского онкологического общества, которые выпускаются как сборники протоколов заседаний, выходят в свет начиная с 2000 г. Первый сборник охватывает период 2000-2003 гг.
На обложках последующих ежегодников рядом с логотипом издания отражается наиболее значимое событие научно-практической и общественной жизни в профессиональном сообществе онкологов: «50 лет Московскому онкологическому обществу» (2004); «60 лет победы в Отечественной войне 1941-1945 гг.» (2005); «10 лет применения ПЭТ в отечественной онкологии» (2006); «Юбилеи в РОНЦ: 55 лет Онкологическому центру, 95 лет основателю РОНЦ – академику Н.Н.Блохину» (2007); «50 лет актуариальных расчетов выживаемости» (2008); «40 лет современной онкохирургии церебральных метастазов» (2009); «20 лет современной видео-онкохирургии» (2010).
Сборник протоколов 2010 г. «20 лет современной видео-онкохирургии» (2010) передан в типографию и выходит в свет в текущем, 2011-м году. С его содержанием уже возможно ознакомиться на сайте www.ronc.ru.
Проблемам видеохирургии посвящены 2 заседания, протоколы которых опубликованы в сборнике 2010 г. Событием этого года стало 20-летие современной видео-онкохирургии. Материалы сборника протоколов открываются подробной исторической справкой о развитии и достижениях сравнительно нового метода. Публикации иллюстрированы обзором литературы, фотографиями и схемами видео-ассистированных операций.
Материалы текущего, 2011 г., обобщаются для представления на январском (2012 г.) отчетно-выборном заседании. Представляется, что именно в такой творческой атмосфере специалистами, составляющими наше профессиональное сообщество, будет определено наиболее значимое событие текущего года.
Публикации ежегодных сборников протоколов стали важным информационным итогом жизнедеятельности Общества.
ТРУДЫ МОСКОВСКОГО ОНКОЛОГИЧЕСКОГО ОБЩЕСТВА
Рефераты сообщений:
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY #582
(November 24, 2011)
ENDOSCOPY’ SURGERY FOR GASTRIC TUMORS
Report 1: ENDOSCOPY METHODS OF DIAGNOSTICS AND TREATMENT IN PATIENTS WITH GASTRIC NEUROENDOCRINE TUMORS. By Dr. I. Perfiliev, Prof. O. Маlikhova, Prof. V. Delektorskaya, Prof. G. Ungeadze, Prof. Yu. Kuvsinov, Prof. B. Poddubny, Dr. S. Pirogov. (The N.N. Blokhin Russian Cancer Research Center).
Report 2: ENDOSCOPY TREATMENT METHODS FOR MULTIPLE GASTRIC CARCINOIDS AND MUL-TIPLE PRIMARIES OF EARLY GASTRIC CARCINOMA. By Prof. V. Sokolov, Dr. E. Karpova, Dr. P. Pavlov, Dr. N. Pogorelov, Prof. G. Frank, Prof. T. Belous, Prof. L. Vashakmadze. (The P.A. Hertzen Moscow Research Institute of Oncology).
Доклад:
ЭНДОСКОПИЧЕСКАЯ ДИАГНОСТИКА И ЛЕЧЕНИЕ ПРИ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЯХ ЖЕЛУДКА
Перфильев И.Б., Малихова О.А., Делекторская В.В., Кувшинов Ю.П., Унгиадзе Г.В., Поддубный Б.К., Пирогов С.С. (РОНЦ им. Н.Н. Блохина)
Нейроэндокринные опухоли (нейроэндокринные карциномы; НЭО) представляют гетерогенную группу эпителиальных новообразований с эндокринно-клеточной дифференцировкой и наличием ряда антигенов нервной ткани, выполняющих регуляторную функцию и расположенных по всему организму. Большая часть НЭО развивается в органах пищеварительной системы из различных типов нейроэндокринных клеток, образующих диффузную эндокринную систему. Частота нейроэндокринных опухолей желудка составляет 0,3 случая на 100.000 населения в год.
Дополняющие визуальную эндоскопическую диагностику уточняющие методы (увеличительная эндоскопия, эндоскопические УЗИ) позволяют расширить возможности своевременного выявления НЭО, определить распространенность опухолевого процесса, провести радикальное эндоскопическое лечение. Целью нашего исследования стало повышение результативности комплексной эндоскопической диагностики и лечения при нейроэндокринных опухолях желудка.
С 2001 по 2011 гг. проведена эндоскопическая диагностика 85 пациентов, направленных в РОНЦ с предварительным диагнозом НЭО желудка. Из них у 53 диагноз нейроэндокринной опухоли желудка подтвержден данными эндоскопии, а также морфоиммунологическими методами; в остальных 32 случаях выявлена иная как опухолевая, так и не опухолевая патология.
Формы роста НЭО макроскопически определены как полиповидная (36; 67,9%) плосковозвышающаяся (12; 22,7%); инфильтративная (5; 9,4%). Опухоли локализовалось в 62,3% случаев в теле, в 28,3% – в проксимальном отделе желудка. Мультицентричный рост выявлен у 32,1% больных,
Средний возраст пациентов соответствовал 52,3 годам, наиболее часто НЭО желудка выявлялись в возрасте 50-60 лет. Соотношение мужчин и женщин составило 0,7:1,0.
В диагностике нейроэндокринных опухолей желудка общая точность эндоскопического метода составила 77,6%. Возможно утверждать, что визуальное выявление нейроэндокринной опухоли желудка при эндоскопии будет затем подтверждено морфологически в 80,4% случаев; при этом вероятность исключения диагноза нейроэндокринной опухоли составит 52,4%.
Очевидно, что улучшение диагностики достигается применением дополнительных уточняющих методов, таких как осмотр с оптическим увеличением, осмотр в узком спектре света (в режиме NBI – от Narrow Вand Imaging), эндосонография.
Осмотр с оптическим увеличением и осмотр в режиме NBI позволил разработать важные дифференциально-диагностические критерии НЭО желудка. Среди них – расширение границ желудочных полей, инфильтрация участков слизистой оболочки, их возвышение над уровнем неизмененной слизистой желудка, расширение капиллярной сети, ограниченное зоной образования с формированием угловатого рисунка сосудов.
Эндоскопическое ультразвуковое сканирование позволило уточнить глубину инвазии опухолей. Процедура проведена 34 пациентам. В том числе – при плоско-возвышающейся форме нейроэндокринной опухоли желудка у 9 (26,5%), полиповидной – у 22 (64,7%), инфильтративной – у 3 (8,8%) пациентов. Установлено, что диагностическая точность метода составляет 84,3%. В 84,2% при помощи ЭндоУЗИ возможно достоверно предполагать наличие НЭО, а в 84,6% – исключить патологический процесс.
Эндосонографическими критериями НЭО желудка являются следующие: наличие гипоэхогенного образования с четкими ровными контурами, гомогенной структуры, возможно – с гетероэхогенными включениями (в случае больших размеров опухоли). Характер распространения зависит от макроскопической формы новообразования.
Эндоскопический диагноз НЭО подтверждался морфологически результатами множественных повторных ступенчатых биопсий и эндоскопической резекцией слизистой оболочки. Применение морфологического и иммуногистохимического методов при исследовании гастробиоптатов позволило определить клеточный состав и морфоиммунологический вариант НЭО желудка.
Показаниями к эндоскопической резекции слизистой оболочки при нейроэндокринных опухолях являются следующие. Соответствие визуальной эндоскопической картины нейроэндокринной опухоли. Размеры новообразования не более 1,0 см. Подтверждение гистологической структуры как высокодифференцированной нейроэндокринной опухоли желудка (G1-G2). Ограничение глубины инвазии по данным эндосонографического исследования слизистой оболочкой. Количество очагов при мультичентричной форме роста нейроэндокринной опухоли не более 5.
Эндоскопическая резекция слизистой оболочки выполнена 24 пациентам из 53, во всех случаях резекция выполнялась по стандартной методике, единым блоком. Размеры образований, при которых была выполнена эндоскопическая резекция слизистой, различались от 0,4 до 1,2 см. Сроки наблюдения после эндоскопической резекции слизистой оболочки составили от 7,0 мес до 8,5 лет. При этом у 6 пациентов выявлены метахронные очаги НЭО с диапазоном выявления новых очагов от 7 мес до 6 лет. Эндоскопических признаков рецидива в зоне ранее выполненной резекции не было выявлено, что подтверждено морфологически множественными ступенчатыми биопсиями. Повторная эндоскопическая резекция слизистой проведена 5 больным; в 1 случае выполнена гастрэктомия.
Таким образом, использование таких методов уточняющей эндоскопической диагностики как эндоскопия с увеличением и эндосонография позволяет своевременно устанавливать диагноз НЭО желудка, проводить дифференциальную диагностику и динамический контроль.
В качестве диагностического метода эндоскопическая резекция слизистой оболочки позволяет получить достаточное количество материала для проведения имуногистохимических исследований, определения инвазии кровеносных и лимфатических сосудов подслизистого слоя, оценки злокачественного потенциала нейроэндокринной опухоли.
Эндоскопическая резекция слизистой оболочки является радикальным и безопасным методом лечения высокодифференцированных нейроэндокринных опухолей желудка, включая мультицентричную форму роста (при условии резекции не более 5 очагов).
ЭНДОСКОПИЧЕСКАЯ ХИРУРГИЯ ОПУХОЛЕЙ ЖЕЛУДКА
(Наблюдение д.м.н. О.А.Малиховой с соавт.)
 Рис. 1. ЭТАПЫ ЭНДОСКОПИЧЕСКОЙ МУКОЗЭКТОМИИ С ИСПОЛЬЗОВАНИЕМ ДВУХКАНАЛЬНОГО ЭНДОСКОПА.
Рис. 1. ЭТАПЫ ЭНДОСКОПИЧЕСКОЙ МУКОЗЭКТОМИИ С ИСПОЛЬЗОВАНИЕМ ДВУХКАНАЛЬНОГО ЭНДОСКОПА.
А) Подведение эндоскопической петли к опухоли.
В-С) Захват и подтягивание опухоли.
D) Затягивание коагуляционной пели, коагуляция опухоли.
Рис. 2. ЭНДОСКОПИЧЕСКАЯ РЕЗЕКЦИЯ СЛИЗИСТОЙ С ДИССЕКЦИЕЙ ПОДСЛИЗИСТОГО СЛОЯ.
А) Эндофото патологического очага (окраска индигокармином).
В) Маркировка краев резекции. Применение ножа с керамическим наконечником (IT-knife; от Intra Tumor). Отдаление линии резекции от опухоли – более 0,5-0,7 см.
С) Рассечение слизистой оболочки.
D) Этап диссекции подслизистого слоя.
E) Вид пострезекционной язвы желудка. Дно язвы – мышечный слой стенки желудка (срок заживления 1,0-1,5 мес).
F) Удаленный препарат (резецированный участок слизистой оболочки).

Доклад:
ВОЗМОЖНОСТИ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ МНОЖЕСТВЕННЫМИ КАРЦИНОИДАМИ И ПЕРВИЧНО-МНОЖЕСТВЕННЫМ РАННИМ РАКОМ ЖЕЛУДКА
Соколов В.В., Карпова Е.С., Павлов П.В., Погорелов Н.Н.,
Франк Г.А., Белоус Т.А., Вашакмадзе Л.А.
(МНИОИ им. П.А. Герцена)
В 1994-2011 гг. в МНИОИ проведено эндоскопическое лечение 15 больных множественными карциноидными опухолями и 14 больных первично-множественным ранним раком желудка. Показания для внутрипросветной эндоскопической хирургии устанавливались при высоко- и умереннодифференцированных опухолях I и II типа роста; размерах от 0,5 до 2,0 см; инвазии в пределах слизистого (m) и подслизистого (sm1; sm2) слоев стенки желудка; при отсутствии признаков регионарного и отдаленного метастазирования по данным КТ, МРТ, УЗИ; а также у больных преклонного возраста, отягощенных сопутствующими заболеваниями. Увеличение числа подобных случаев достигнуто благодаря совершенствованию методов эндоскопической и морфологической диагностики. Современным эталоном радикального эндоскопического удаления опухоли является мукозэктомия с диссекцией в подслизистом слое. Эта процедура может быть дополнена фотодинамической терапией.
Эндоскопическое лечение 15 больных множественными карциноидами (мукозэктомия, аргоноплазменная коагуляция или их сочетание) позволило удалить 66 из 68 опухолей. В одном случае, при множественных поражениях верхней трети желудка, выполнена проксимальная резекция. Средний возраст пациентов составил 61 год. Размеры опухолей соответствовали 0,2-1,3 см. Согласно классификации Европейского общества эндокринных опухолей множественные поражения желудка квалифицированы как Т1 и Т2. Преобладали опухоли верхней трети желудка.
Во всех случаях множественных карциноидных опухолей выявлены фоновые изменения слизистой оболочки в виде хронического атрофического гастрита с гиперплазией эндокринных клеток. По морфологической структуре 66 из 68 опухолей соответствовали высокодифференцированному карциноиду I типа, выявлены также умереннодифференцированный карциноид I типа и сложный карциноид, размером 4 см, в котором наряду со структурами карциноида, имелись участки тубулярной аденокарциномы.
Осложнений и рецидивов при эндоскопическом лечении не отмечено. Прослежены в сроки от 1 года до 7 лет 11 больных. У 3 пациентов в процессе динамического наблюдения выявлены новые карциноидные опухоли которые были успешно удалены (эндоскопической электрорезекцией или аргоноплазменной коагуляцией).
Таким образом, примененные методики внутрипросветной эндоскопической хирургии при первично-множественных высокодифференцированных кациноидах желудка могут рассматриваться как один из вариантов радикального лечения. Однако, следует учитывать вероятность появления новых метахронных очагов карциноидных опухолей. В связи с этим, лечение должно проводиться при условии длительного динамического наблюдения с эндоскопическим и морфологическим контролем.
При эндоскопическом лечении 14 больных по поводу первично-множественного раннего рака желудка удалена в общей сложности 31 опухоль. Средний возраст пациентов составил 73 года. Морфологически установлен диагноз высокодифференцированной (27), умереннодифференцированной (2), малодифференцированной (1) аденокарциномы и перстневидноклеточного рака (1). У 7 больных диагностированы 2, у 2 больных – 3 синхронные опухоли. Метахронный ранний рак желудка выявлен у 4 пациентов дважды и у 1 – трижды. Метахронные опухоли выявлялись после успешного эндоскопического удаления первой опухоли в сроки от 1 года до 4 лет, благодаря комплексному динамическому наблюдению с применением эзофагогастродуоденоскопии с множественной биопсией.
Перед началом внутрипросветного эндоскопического лечения всем пациентам проведено комплексное обследование, включавшее рентгенологическое исследование, эзофагогастродуоленоскопию с высоким разрешением, осмотр в режиме NBI или FICE, эндосонографию, морфологическое и иммуногистохимическое исследование биоптатов, УЗИ, КТ или МРТ органов брюшной полости.
По данным обследования у всех больных представленной группы, не определялось признаков регионарного и отдаленного метастазирования, а глубина опухолевой инвазии оставалась в пределах слизистого (27 опухолей) и подслизистого (4 опухоли) слоев. Размеры опухолей составляли от 0,5 до 2,2 см. Макроскопически в 24 опухолях из 31 преобладал II тип роста.
Мукозэктомия с диссекцией в подслизистом слое применена для удаления 4 опухолей, метод фотодинамической терапии – для удаления 6 опухолей, различные варианты электрорезекции (петлевая, колпачковая, с использованием 2-канального гастроскопа или двух гастроскопов) в сочетании с фотодинамической терапией были использованы для удаления 21 первично-множественной ранней злокачественной опухоли желудка.
В результате эндоскопического лечения радикальное удаление очагов раннего рака желудка достигнуто в 25 из 31 случая (81,0%). В остальных 6 наблюдениях после эндоскопического лечения выявлены остаточные опухоли. Из них 4 больных оперированы в объеме гастрэктомии с D2-лимфодиссекцией, 2 больным проведено дополнительно несколько курсов фотодинамической терапии; достигнута стабилизация опухолевого процесса. Тяжелых осложнений не отмечено.
Рецидив первого очага раннего рака желудка диагностирован у 1 больной через 9 мес после лечения; проведен курс фотодинамической терапии, достигнута полная регрессия опухоли. Десять пациентов после эндоскопического лечения наблюдаются в сроки от 1 года до 14 лет.
Заключение. Современные эндоскопические методы диагностики с использованием режимов NBI, FICE, ZOOM, аутофлуоресценции, эндосонографиии и иммуногистохимического исследования биоптатов позволяют повысить частоту выявления ранних карциноидных опухолей и раннего рака желудка, для удаления которых может быть с успехом применена внутрипросветная хирургия (мукозэктомия) или сочетание хирургии и фотодинамической терапии.
Клинический опыт эндоскопического лечения и последующего многолетнего наблюдения подтверждает не только возможность успешного удаления этих опухолей, но и вероятность первичной множественности опухолевого процесса. что требует дальнейшего совершенствования диагностических и лечебных программ.