Эмбриональное развитие желчного пузыря
Формирование печени у плода — эмбриогенез, морфогенезПеченочный вырост (дивертикул) появляется на сроке гестации около 4 нед в области передней кишки, расположенной каудально, непосредственно ниже желудка. Первоначально печень определяется как утолщение на брюшной поверхности двенадцатиперстной кишки. Формирование печени начинается посредством определенной стимуляции энтодермы вентрального отдела передней кишки сердечной мезодермой. В сериях экспериментов было установлено несколько сигнальных путей, вовлеченных в процесс развития печени. Появление в клетках энтодермы печеночного выроста матричной рибонуклеиновой кислоты (РНК), необходимой для синтеза специфического белка печени альбумина, является признаком, указывающим на стимуляцию роста гепатоцитов. Стимулирующее воздействие оказывают факторы роста фибробластов, секретируемые сердечной мезодермой, которые, в свою очередь, связываются со специфическими рецепторами энтодермы. Фактически культура клеток энтодермы in vitro может образовывать гепатобласты при инкубации с FGF. Для ответа на воздействие FGF необходимо наличие компетентной энтодермы. Экспрессия гена Fox а в энтодерме возникает раньше индуцированного FGF формирования печеночных клеток. В настоящее время продемонстрирована роль Fox а-1 и Fox а-2 в индукции развития печени. При отсутствии Fox а-1 и Fox а-2 энтероциты не формируют почку печеночного выроста, однако сердечная мезенхима остается нормальной. После формирования почки печеночного выроста для дальнейшей пролиферации гепатоцитов необходимо присутствие фактора роста гепатоцитов. Печеночный вырост врастает в поперечную мембрану и дает начало печеночным тяжам, которые трансформируются в гепатоциты. В данном процессе для развития печени необходима комбинация сигнальных факторов, поступающих от клеток мезодермы поперечной мембраны, включая BMP. Во время миграции в поперечную мембрану клетки печеночной энтодермы окружаются клетками-предшественниками эндотелия сосудов, которые представляют собой источник важного для развития печени фактора роста. Если формирования кровеносных сосудов не происходит, то развитие печеночного эпителия также нарушается. Следовательно, для формирования печени необходимо взаимодействие печеночного эпителия с эндотелием сосудов. Необходимый эффект обеспечивают именно сами клетки эндотелия, а не циркулирующие в крови факторы. Эпителиальные клетки желчных протоков, по-видимому, развиваются из бипотенциальных гепатобластов, способных дифференцироваться либо в гепатоциты, либо в клетки желчных протоков, однако происхождение этих клеток долгое время было предметом научных дискуссий. Эксперименты по выделению и трансплантации полипотентных стволовых клеток из печени эмбрионов мыши подтверждают происхождение эпителия желчных протоков из гепатобластов, однако необходимы дальнейшие исследования данной популяции клеток. Формирование желчных протоков в печени человека и грызунов происходит одинаково.
Изначально субпопуляция гепатобластов, рассматриваемых в качестве предшественников эпителиальных клеток желчных протоков, локализуется вблизи мезенхимы формирующихся портальных сосудов, которая, в свою очередь, экспрессирует желчеспецифические цитокератины. Слой гепатобластов впоследствии формирует непрерывную однослойную кольцевую структуру, называемую протоковой пластинкой, окружающую портальную мезенхиму. Протоковая пластинка в дальнейшем частично становится двухслойной. Локальные расширения протоковой пластинки в местах, где она двухслойная, дают начало желчным протокам. Оставшаяся часть протоковой пластинки в дальнейшем регрессирует. У человека регресс протоковой пластинки идет за счет апоптоза (запрограммированной гибели клеток). Развитие желчных протоков происходит по градиенту в направлении от ворот печени к периферии органа. Первичный зачаток печени человека, возникший из энтодермы, состоит из двух отделов — головного (краниального) и хвостового (каудального). Из хвостового отдела развиваются также внепеченочные желчные протоки и желчный пузырь. При исследовании молекулярной регуляции формирования протоковой пластинки были установлены некоторые ключевые факторы этого процесса. Транскрипционный HNF6 определяет количество клеток, вовлеченных в процесс формирования эпителия желчных путей, а также расположение желчных путей вблизи портальной мезенхимы. Мезенхимный фактор транскрипции FoxF1 необходим для формирования желчного пузыря. При делеции гена HNF1b возникают аномалии развития внутрипеченочных желчных протоков. У человека описано много заболеваний, возникающих вследствие аномального развития протоковой пластинки. Наличие при данных заболеваниях сочетанных аномалий производных воротной мезенхимы и воротных кровеносных сосудов свидетельствует о функциональном взаимодействии всех компонентов портальной системы. Синдром Алажилля представляет собой доказательство подобного функционального взаимодействия и характеризуется гаплоидной недостаточностью по системе Jagged-1 — наличием парных генов, каждый из которых не способен полностью реализовать себя в гетерозиготном организме. Jagged-1 представляет собой лиганд для Notch-рецепторов. Гистологические изменения при данном синдроме представлены недостаточным количеством внутрипеченочных желчных протоков и холестазом. Кроме того, наблюдаются увеличение числа артерий и фиброз в воротной системе, недостаточное количество желчных протоков. Синдром, возникающий у человека, не может быть полностью воспроизведен на лабораторных животных, например на мышах. Хотя у гомозиготных мышей с делецией Notch2 проявляется комплекс аномалий, характерных для заболевания у человека. Представленные данные свидетельствуют, что развитие желче-выводящих путей — результат сложного взаимодействия мезенхимы, протоков и кровеносных сосудов. Учебное видео по развитию желудочно-кишечного тракта (эмбриогенезу)
— Также рекомендуем «Формирование поджелудочной железы у плода — эмбриогенез, морфогенез» Оглавление темы «Эмбриогенез желудочно-кишечного тракта»:
|
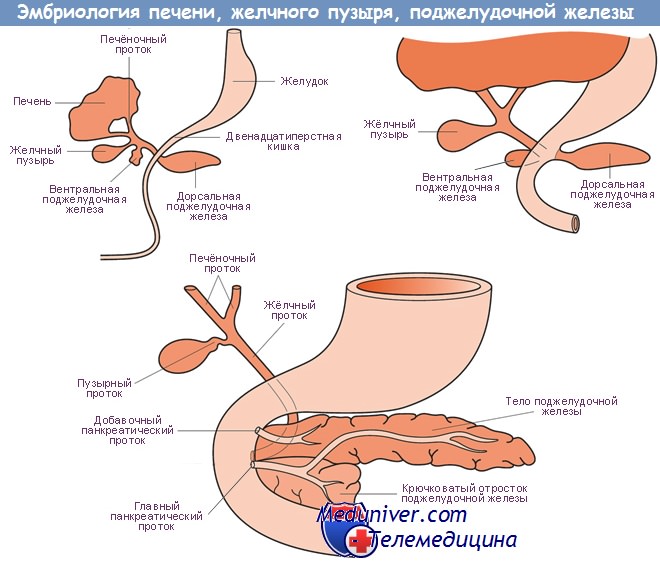
Печень с системой протоков и желчный пузырь развиваются из печеночного дивертикула вентрального отдела энтодермы первичной средней кишки. Начало развития печени — 4-я неделя внутриутробного периода. Из проксимального отдела дивертикула формируются будущие желчные протоки, из дистального — печеночные балки.
Быстро размножающиеся энтодермальные клетки краниальной части (pars hepatica) внедряются в мезенхиму брюшной брыжейки. Мезотермальные листки брюшной брыжейки по мере роста печеночного дивертикула формируют соединительнотканную капсулу печени с ее мезотелиальным покровом и междольковой соединительной тканью, а также гладкие мышцы и каркас протоков печени На 6-й неделе становятся заметны просветы печеночных балок — «желчные капилляры». В месте слияния протоков каудальная часть первичного выроста расширяется (ductus cystica), образуя закладку желчного пузыря, которая быстро удлиняется, принимая форму мешочка. Из узкой проксимальной части этой ветви дивертикула развивается проток пузыря, куда открывается множество печеночных протоков.
Из участка первичного дивертикула между местом впадения печеночных протоков и двенадцатиперстной кишкой развивается общий желчный проток {ductus choledochus). Дистальные быстро размножающиеся участки энтодермы ветвятся по ходу желчно-брыжеечных вен ранних эмбрионов, пространства между печеночными балками заполняются лабиринтом широких и неправильных капилляров — синусоидами, количество же соединительной ткани мало.
Чрезвычайно развитая сеть капилляров между тяжами печеночных клеток (балок) и определяет структуру формирующейся печени. Дистальные части ветвящихся печеночных клеток превращаются в секреторные отделы, а осевые тяжи клеток служат основой системы протоков, по которым из данной дольки происходит отток жидкости но направлению к желчному пузырю. Развивается двойное афферентное кровоснабжение печени, имеющее существенное значение для понимания ее физиологических функций и клинических синдромов, возникающих при нарушении ее кровоснабжения.
На процесс внутриутробного развития печени большое влияние оказывает формирование у 4-6-недельного эмбриона человека филогенетически более позднего, чем желточный, аллантоисного круга кровообращения.
Аллантоисные, или пупочные, вены, проникая в тело эмбриона, охватываются растущей печенью. Происходит срастание проходящих пупочных вен и сосудистой сети печени, и через нее начинает проходить плацентарная кровь. Именно поэтому во внутриутробном периоде печень получает наиболее богатую кислородом и питательными веществами кровь.
После регрессии желточного мешка парные желточно-брыжеечные вены соединяются друг с другом перемычками, причем некоторые части запустевают, что и приводит к образованию воротной (непарной) вены. Дистальные протоки начинают собирать кровь из капилляров развивающегося ЖКТ и направляют ее через воротную вену к печени.
Особенностью кровообращения в печени является то, что кровь, уже однажды прошедшая через капилляры кишечника, собирается в воротную вену, вторично проходит через сеть капилляров-синусоидов и только затем через печеночные вены, расположенные проксимальнее тех частей желточно-брыжеечных вен, где в них вросли печеночные балки, идет непосредственно к сердцу.
Итак, между железистой печеночной тканью и кровеносными сосудами имеются тесная взаимообусловленность и зависимость. Наряду с портальной системой, развивается и артериальная система кровоснабжения, отходящая от ствола чревной артерии.
Как у взрослого человека, так и у эмбриона (и плода) пищевые вещества после всасывания из кишечника сначала поступают в печень.
Объем крови воротного и плацентарного кровообращения значительно больше, чем объем крови, поступающей из печеночной артерии.
Масса печени в зависимости от срока развития плода человека (по В.Г. Власовой и К.А. Дреть, 1970)
Возраст, нед | Число исследовании | Масса сырой печени, г |
5-6 | 11 | 0,058 |
7-8 | 16 | 0,156 |
9-11 | 15 | 0,37 |
12-14 | 17 | 1,52 |
15-16 | 15 | 5.10 |
17-18 | 15 | 11,90 |
19-20 | 8 | 18,30 |
21-23 | 10 | 23,90 |
24-25 | 10 | 30,40 |
26-28 | 10 | 39,60 |
29-31 | 16 | 48,80 |
31-32 | 16 | 72,10 |
40 | 4 | 262,00 |
Увеличение массы печени особенно интенсивно в первой половине антенатального развития человека. Масса печени плода удваивается или утраивается каждые 2-3 нед. В течение 5-18 нед внутриутробного развития масса печени увеличивается в 205 раз, в течение второй половины этого периода (18-40 нед) она увеличивается только в 22 раза.
В эмбриональный период развития масса печени составляет в среднем около 596 массы тела. В ранние периоды (5-15 нед) масса печени составляет 5,1%, в середине внутриутробного развития (17-25 нед) — 4,9, а во второй половине (25-33 нед) — 4,7%.
К рождению печень становится одним из самых крупных органов. Она занимает 1/3-1/2 объема брюшной полости, а ее масса составляет 4,4% массы тела новорожденного. Левая доля печени к рождению очень массивна, что объясняется особенностями ее кровоснабжения. К 18 мес постнатального развития левая доля печени уменьшается. У новорожденных дольки печени нечетко отграничены. Фибринозная капсула тонкая, имеются нежные коллагеновые и тонкие эластиновые волокна. В онтогенезе скорость увеличения массы печени отстает от массы тела. Так, масса печени удваивается к 10-11 мес (масса тела утраивается), к 2-3 годам утраивается, к 7-8 годам увеличивается в 5 раз, к 16-17 годам — в 10 раз, к 20-30 годам — в 13 раз (масса тела увеличивается в 20 раз).
Масса печени (г) в зависимости от возраста (no Е. Boyd)
Возраст | Мальчики | Девочки | ||
n | X | n | X | |
Новорожденные | 122 | 134,3 | 93 | 136,5 |
0-3 мес | 93 | 142,7 | 83 | 133,3 |
3-6 мес | 101 | 184,7 | 102 | 178,2 |
6-9 мсс | 106 | 237,8 | 87 | 238,1 |
9-12 мес | 69 | 293,1 | 88 | 267,2 |
1 -2 года | 186 | 342,5 | 164 | 322,1 |
2-3 года | 114 | 458,8 | 105 | 428,9 |
3-4 года | 78 | 530.6 | 68 | 490.7 |
4-5 лет | 62 | 566,6 | 32 | 559,0 |
5-6 лет | 36 | 591,8 | 36 | 59 U |
6-7 лет | 22 | 660,7 | 29 | 603,5 |
7-8 лет | 29 | 691,3 | 20 | 682,5 |
8-9 лет | 20 | 808,0 | 13 | 732,5 |
9-10 лет | 21 | 804,2 | 16 | 862,5 |
10-11 лет | 27 | 931,4 | 11 | 904,6 |
11-12 лет | 17 | 901,8 | 8 | 840,4 |
12-13 лет | 12 | 986,6 | 9 | 1048,1 |
13-14 лет | 15 | 1103 | 15 | 997,7 |
14-15 лет | 16 | 1L66 | 13 | 1209 |
Диафрагмальная поверхность печени новорожденного выпуклая, левая доля печени по размерам равна правой или превосходит ее. Нижний край печени выпуклый, под ее левой долей располагается нисходящая ободочная кишка. Верхняя граница печени по правой среднеключичной линии находится на уровне V ребра, а по левой — на уровне VI ребра. Левая доля печени пересекает реберную дугу по левой средне ключичной линии. У ребенка 3-4 мес место пересечения реберной дуги с левой долей печени в связи с уменьшением се размеров находится уже на окологрудинной линии. У новорожденных нижний край печени по правой среднеключичной линии выступает из-под реберной дуги на 2,5-4,0 см, а по передней срединной линии — на 3,5-4,0 см ниже мечевидного отростка. Иногда нижний край печени достигает крыла правой подвздошной кости. У детей 3-7 лет нижний край печени находится ниже реберной дуги на 1,5-2,0 см (по среднеключичной линии). После 7 лет нижний край печени из-под реберной дуги не выходит. Под печенью располагается только желудок: начиная с этого времени ее скелетотопия почти не отличается от скелетотопии взрослого человека. У детей печень очень подвижна, и ее положение легко изменяется при изменении положения тела.
У детей первых 5-7 лет жизни нижний край печени всегда выходит из-под правого подреберья и легко прощупывается. Обычно он выступает на 2-3 см из-под края реберной дуги по среднеключичной линии у ребенка первых 3 лет жизни. С 7-летнего возраста нижний край не пальпируется, а по срединной линии не должен выходить за, верхнюю треть расстояния от пупка до мечевидного от ростка.
Формирование долек печени происходит в эмбриональном периоде развитая, но окончательное их дифференцирование завершается к концу первого месяца жизни. У детей при рождении около 1,5% гепатоцитов имеют 2 ядра, в то время как у взрослых — 8%.
Желчный пузырь у новорожденных, как правило, скрыт печенью, что затрудняет его пальпацию и делает нечетким его рентгенологическое изображение. Он имеет цилиндрическую или грушевидную форму, реже встречается веретенообразная или S-образная форма. Последняя обусловлена необычным расположением печеночной артерии. С возрастом размеры желчного пузыря увеличиваются.
У детей после 7 лет проекция желчного пузыря находится в точке пересечения наружного края правой прямой мышцы живо га с реберной дугой и латеральнее (в положении лежа). Иногда для определения положения желчного пузыря применяют линию, соединяющую пупок с верхушкой правой подмышечной впадины. Точка пересечения этой линии с реберной дутой соответствует положению дна желчного пузыря.
Срединная плоскость тела новорожденного образует с плоскостью желчного пузыря острый угол, в то время как у взрослого они лежат параллельно. Длина пузырного протока у новорожденных сильно варьирует, и он обычно длиннее общего желчного протока. Пузырный проток, сливаясь с общим печеночным протоком на уровне шейки желчного пузыря, образует общий желчный проток. Длина общего желчного протока очень вариабельна даже у новорожденных (5-18 мм). С возрастом она увеличивается.
Средние размеры желчного пузыря у детей (Мазурин А. В., Запруднов А. М., 1981)
Возраст | Длина, см | Ширина у основания, см | Ширина шейки, | Объем, мл |
Новорожденный | 3,40 | 1.08 | 0,68 | — |
1-5 мсс | 4.00 | 1,02 | 0,85 | 3,20 |
6- 12 мес | 5,05 | 1,33 | 1,00 | 1 |
1 -3 года | 5,00 | 1,60 | 1,07 | 8,50 |
4-6 лет | 6.90 | 1,79 | 1,11 | — |
7-9 лет | 7,40 | 1,90 | 1,30 | 33,60 |
10-12 лет | 7,70 | 3,70 | 1,40 | |
Взрослые | — | — | — | 1 -2 мл на 1 кг массы тела |
Выделение желчи начинается уже во внутриутробном периоде развития. В постнатальном периоде, в связи с переходом на энтеральное питание, количество желчи и ее состав претерпевают значительные изменения.
В течение первого полугодия ребенок преимущественно получает жировую диету (около 50% энергетической ценности женского молока покрывается за счет жира), довольно часто выявляется стеаторея, что объясняется, наряду с ограниченной липазной активностью поджелудочной железы, в значительной степени недостатком солей желчных кислот, образуемых гепатоцитами. Особенно низка активность желчеобразования у недоношенных. Она составляет около 10-30% желчеобразования у детей в конце первого года жизни. Этот дефицит в какой-то мере компенсируется хорошим эмульгированием жира молока. Расширение набора продуктов питания после введения прикорма и затем при переходе на обычный рацион предъявляет все большие требования к функции желчеобразования.
В желчи у новорожденного (до возраста 8 нед) воды содержится 75-80% (у взрослого — 65-70%); белка, жира и гликогена больше, чем у взрослых. Лишь с возрастом происходит увеличение содержания плотных веществ. Секрет гепатоцитов представляет собой золотистую жидкость, изотоничную плазме крови (pH 7,3-8,0). она содержит желчные кислоты (преимущественно холевую, меньше — хенодезоксихолевую), желчные пигменты, холестерин, неорганические соли, мыла, жирные кислоты, нейтральные жиры, лецитин, мочевину, витамины А, В С, в небольшом количестве некоторые ферменты (амилазу, фосфатазу, протеазу, каталазу, оксидазу). Величина pH пузырной желчи обычно уменьшается до 6,5 против 7,3-8,0 печеночной желчи. Окончательное формирование состава желчи завершается в желчных протоках, где из первичной желчи реабсорбируется особенно много (до 90%) воды, также реабсорбируются ионы Мg, Сl, НСO3, но в относительно меньших количествах, что ведет к росту концентрации многих органических компонентов желчи.
Концентрация желчных кислот в печеночной желчи у детей первого года жизни высокая, затем она снижается к 10 годам, а у взрослых увеличивается вновь Это изменение концентрации желчных кислот объясняет развитие подпеченочного холестаза (синдром сгущения желчи) у детей периода новорожденности.
Кроме того, у новорожденных изменено соотношение глицин/таурин по сравнению с детьми школьного возраста и взрослыми, у которых преобладает гликохолевая кислота. У детей раннею возраста в желчи не всегда удается обнаружить дезоксихолевую кислоту
Высокое содержание таурохолевой кислоты, обладающей выраженным бактерицидным свойством, объясняет относительно редкое развитие бактериального воспаления желчевыводящих путей у детей первого года жизни.
Хотя к рождению печень относительно велика, она в функциональном отношении незрела. Выделение желчных кислот, играющих важную роль в процессе пищеварения, невелико, что, вероятно, нередко служит причиной стеатореи (в копрограмме выявляется большое количество жирных кислот, мыла, нейтрального жира) вследствие недостаточной активации поджелудочной липазы. С возрастом нарастает образование желчных кислот с увеличением от ношении глицина к таурину за счет последнего; в то же время печень ребенка первых месяцев жизни (особенно до 3 мес) обладает большей «гликогенной емкостью», чем у взрослых.
Содержание желчных кислот в дуоденальной содержимом у детей (Мазурин A.B., Запруднов А.М., 1981)
Возраст | Содержание желчных кислот, мг-экв/л | Соотношение | С оотношенне кислої холевая/ хеноде-зоксихолевая/ дезокенхолевая | ||
среднее | пределы | среднее | пределы | ||
Печеночная желчь | |||||
1-4 дня | 10,7 | 4,6-26,7 | 0,47 | 0,21-0,86 | 2,5:1:- |
5-7 дней | 11,3 | 2.0-29,2 | 0.95 | 0,34-2.30 | 2,5:1:- |
7- 12 мес | 8,8 | 2,2-19,7 | 2,4 | 1,4-3,1 | 1,1:1:- |
4-10 лет | 3,4 | 2,4-5,2 | 1,7 | 1,3-2,4 | 2,0-1:0,9 |
20 лет | 8,1 | 2,8-20,0 | 3,1 | 1,9-5,0 | 1,2:1:0,6 |
Пузырная желчь | |||||
20 лет | 121 | 31,5-222 | 3,0 | 1,0-6,6 | 1:1:0,5 |
Функциональные резервы печени также имеют выраженные возрастные изменения. В пренатальном периоде формируются основные ферментные системы. обеспечивающие адекватный метаболизм различных веществ. Однако к рождению не все ферментные системы достаточно зрелы. Лишь в постнатальном периоде происходит их созревание, причем отмечается выраженная гетерогенность активности ферментных систем. Особенно варьируют сроки их созревания. При этом имеется отчетливая зависимость от характера вскармливания. Наследственно запрограмированный механизм созревания ферментных систем обеспечивает оптимальное течение обменных процессов при естественном вскармливании. Искусственное вскармливание стимулирует более раннее их развитие, одновременно возникают и более выраженные диспропорции последнего.
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13]




