Что такое диссеминированный рак желудка

Пациент: больная К., рак желудка с метастазами
Возраст: 45 лет
28.10.2002 г. больная поступила в клинику с диагнозом рак желудка (пилорического отдела) T4N3M1, осложненный декомпенсированным стенозом, метастазы в яичники, лимфоузлы брюшной полости и забрюшинного пространства.
Из анамнеза: в 2002 году отметила прогрессирующее снижение веса на 19 кг. В августе 2002 года у больной выявлен рак желудка (пилорического отдела) T4N3M1, осложненный декомпенсированным стенозом, метастазы в яичники, лимфоузлы брюшной полости и забрюшинного пространства.
Цитология № 7751/53 – низкодифференцированная аденокарцинома желудка.
10.09.2002 г. произведена операция – лапаротомия, ревизия органов брюшной полости. Наложение переднего впередиободочного гастроэнтероанастомоза с анастомозом Брауна. Проведение полихимиотерапии не планировалось, учитывая большую распространенность опухоли и низкую эффективность химиотерапии.
При поступлении в клинику “К-тест” состояние удовлетворительное, ослабленное, определяется асцит. При рентгеноскопии подтвержден рак дистальной половины желудка с метастазами. На КТ определяется асцит, двусторонний плеврит, увеличение отдельных забрюшинных лимфоузлов до 10 мм (рис. 3а). При ультразвуковом исследовании в малом тазу лоцируется метастаз Крукенберга размером 50 × 40 мм.
30.10.2002 г. проведен первый сеанс общей гипертермии с полихимиотерапией (5-фторурацил, лейковорин, доксорубицин). Максимальная температура составила 42,45 °С. В постгипертермическом периоде отмечалась транзиторная гипербилирубинемия (49,6 ммоль/л).
Повторно больная поступила в клинику 02.12.2002 г. через 4 недели после первого сеанса гипертермии. Состояние при поступлении удовлетворительное, жалоб нет, прибавила в весе 3 кг. При ультразвуковом исследовании органов малого таза отмечено уменьшение размеров метастазов в яичниках до 45 × 35 мм, что соответствует стабилизации.
05.12.2002 г. проведен второй сеанс общей гипертермии с полихимиотерапией, максимальная температура составила 42,58 °С. Постгипертермический период протекал гладко, и больная была выписана в удовлетворительном состоянии на пятые сутки после сеанса гипертермии.
Обследована в январе 2003 года через 1 месяц после второго сеанса общей гипертермии. При КТ брюшной полости асцита, плеврита и увеличения забрюшинных лимфоузлов не отмечается (рис. 3б). При ультразвуковом исследовании размеры яичников уменьшились до 30 × 28 мм, что соответствует частичной регрессии.
В марте 2003 года больная чувствует себя удовлетворительно, за период с октября 2002 года по март 2003 года прибавила в весе 16 кг, ремиссия сохраняется.
Оперативное лечение рака желудка с метастазами стало возможным
Учитывая выраженный клинический эффект, достигнутый после двух сеансов общей гипертермии с полихимиотерапией, 22.04.2003 г. выполнена операция – верхне-срединная лапаротомия: в брюшной полости – спаечный процесс, по всей брюшной полости – разрастание фиброзной ткани, метастазы в оба яичника. Выполнена субтотальная резекция желудка по Ру, резекция обоих яичников. Гистологически: в желудке – на фоне выраженного фиброза, эластоза единичные рассеянные комплексы атипичных клеток с гиперхроматозом и пикнозом ядер. Картина терапевтического патоморфоза III степени по Г.А. Лавниковой. В обоих яичниках на фоне фибротекоматоза и фиброза – комплексы опухолевых клеток с «целлюлярными» очагами некроза, пикнозом и рексисом ядер. Заключение: рак желудка (малодифференцированная аденокарцинома) с термохимиотерапевтическим патоморфозом III степени. Метастатическое поражение обоих яичников с терапевтическим регрессом.
Данный пример показывает возможность достижения частичной регрессии при использовании общей гипертермии у больной диссеминированным раком желудка. В приведенном примере объективный эффект был получен после второго сеанса общей гипертермии с полихимиотерапией, что дало возможность выполнить радикальную операцию.
Ист. болезни: 526/586
© 2020 Онкологическая клиника «К-тест» · Копирование материалов запрещено. *Цены, указанные на сайте, не являются офертой. Стоимость услуг устанавливается и оплачивается согласно прейскуранту Клиники, действующему на момент оказания услуги. Подробности по тел.8 (831) 439-15-14. Имеются противопоказания. Необходима консультация специалиста. Лицензия ЛО-52-01-005717 от 16.02.2017. ОГРН 1025203029763. ИНН 5260013184
Появление препарата тегафур+гимерацил+отерацил (ТГО), перорального производного фторпиримидинов, позволило по-новому взглянуть на лечение больных диссеминированным раком желудка. Интерес к препарату подтверждается массой международных исследований, в которых изучается его эффективность в комбинациях с различными препаратами. Комбинация ТГО с цисплатином оказалась равной по эффективности с режимом 5-фторурацил+цисплатин (различия в медианах общей и безрецидивной выживаемости статистически незначимы) при существенно значимой меньшей токсичности. Именно лучший профиль безопасности позволяет рассматривать его как перспективный препарат для лечения больных.
Рак желудка – высокоагрессивная опухоль с неблагоприятным прогнозом. Каждый год в мире диагностируется 1 млн новых случаев заболевания и 750 тыс. смертей. Рак желудка занимает 2-е место в структуре мировой онкологической смертности, поэтому остается важной медико-социальной проблемой. Более чем 70% (677 тыс.) случаев зарегистрировано в развивающихся странах, при этом половина приходится на страны Восточной Азии (в особенности Китай). Наибольшая частота смертности также отмечается в странах Восточной Азии (24:100 000 среди мужчин, 9,8:100 000 среди женщин), наименьшая – в Северной Америке (2,8 и 1,5 соответственно).
На сегодняшний день примерно у 65% пациентов рак желудка обнаруживается на 3–4-й стадиях, т.к. заболевание очень часто протекает бессимптомно. Такая статистика справедлива для стран всего мира, кроме Кореи и Японии, где реализуются систематические скрининговые программы, позволяющие выявлять рак желудка на ранних стадиях [1].
У 85% пациентов выявляются метастазы в лимфатических узлах и у 30% – в печени. Несмотря на успехи противоопухолевой лекарственной терапии, медиана общей выживаемости пациентов на стадии метастатической болезни составляет менее 12 месяцев [2].
Очень часто в химиотерапии рака желудка используются фторпиримидины. Новый препарат этой группы (тегафур+гимерацил+отерацил –ТГО), представляет собой комбинацию тегафура (который после абсорбции из желудочно-кишечного тракта трансформируется в противоопухолевое средство 5-фторурацил – ФУ), гимерацила (ингибитор дигидропиримидиндегидрогеназы, который предотвращает разрушение 5-ФУ) и отерацила (ингибитор оротатфосфорибозилтрансферазы), обладает большим периодом полувыведения и лучшим профилем безопасности, чем 5-ФУ. Гимерацил пролонгирует период полувыведения 5-ФУ, а отерацил улучшает переносимость препарата.
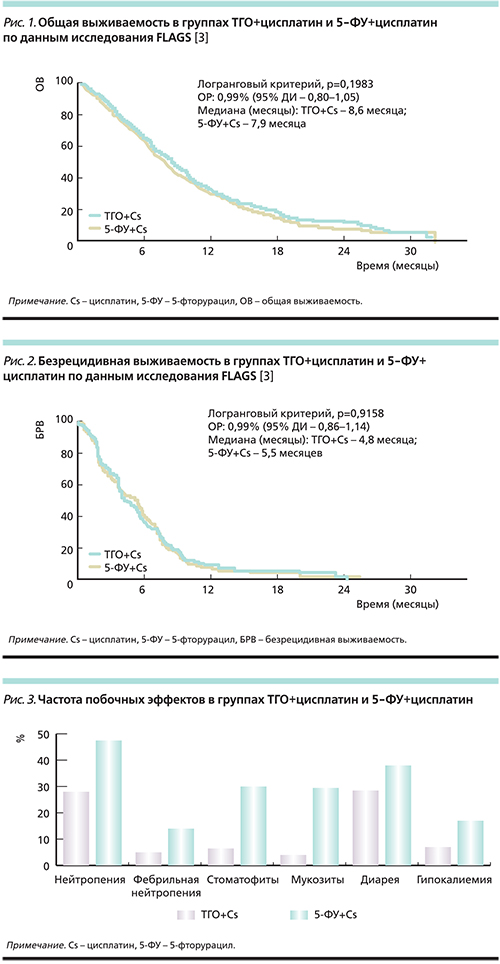
Одним из самых больших многоцентровых исследований ТГО стало таковое третьей фазы FLAGS (сравнение режимов цисплатин/ТГО и цисплатин/5-ФУ в лечении распространенного рака желудка и пищевода). В исследование были включены пациенты с нерезектабельным раком желудка [3].
Больные (n=1053) были рандомизированы в две группы. Первая группа (n=527) получала лечение в режиме: ТГО 25 мг/м2 внутрь 2 раза в сутки, 1–21 день, цисплатин 75 мг/м2 в/в 1-й день, каждые 4 недели. Вторая группа (n=526): 5-ФУ 1000 мг/м2/24 часа, дни 1–5, цисплатин 100 мг/м2 в/в 1-й день каждые 4 недели. Частота объективного ответа составила 29,1% в группе ТГО+цисплатин и 31,9% в группе цисплатин+5-ФУ (p=0,4). Медиана продолжительности общего ответа составила 6,5 и 5,8 месяца соответственно (р=0,08).
Медиана общей выживаемости в группе пациентов, получавших ТГО+цисплатин, составила 8,6 месяца против 7,9 в группе 5-ФУ+цисплатин (p=0,1983; рис. 1). Безрецидивная выживаемость составила 4,8 и 5,5 месяцев соответственно (p=0,9158; рис. 2).
Частота побочных эффектов в группе ТГО+цисплатин была значительно ниже (рис. 3). В группе ТГО+цисплатин отмечена значительно меньшая гематологическая токсичность: частота нейтропении в группе ТГО+цисплатин составила 28,6% (3–4-й степеней 18,6%) против 47,2% (3–4-й степеней 40,0%) в группе 5-ФУ+цисплатин. Фебрильная нейтропения отмечена у 5,0 и 14,4% пациентов соответственно. Смертность в результате токсичности составила 2,5% (n=13) в группе пациентов, получавших ТГО+цисплатин, и 4,9% (n=25) в группе 5-ФУ+цисплатин.
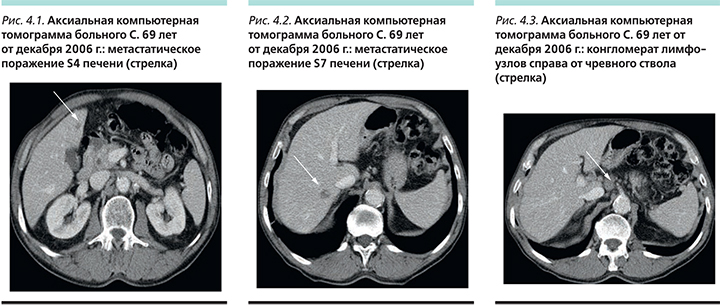
Также ТГО показал меньшую негематологическую токсичность. Частота стоматитов 6,3% (3–4-й степеней 1,3%) и 30,1% (3–4-й степеней 13,6%), мукозитов 3,8% (3–4-й степеней 0,8%) и 29,9% (3–4-й степеней 8,1%), частота диареи составила 29,2% (3–4-й степеней 4,0%) и 38,4% (3–4-й степеней 4,5%) соответственно. Гипокалиемия выявлялась у 6,9% (3–4-й степеней 3,6%) пациентов в группе ТГО+цисплатин и у 16,7% (3–4-й степеней 10,8%) в группе 5-ФУ+цисплатин.
Таким образом, исследователи пришли к выводу о равной эффективности режима ТГО+цисплатин по сравнению с режимом 5-ФУ+цисплатин (различия в медианах общей и безрецидивной выживаемости статистически незначимы) при существенно меньшей токсичности.
Ниже приводится клинический случай длительного и эффективного лечения пациента с метастатическим раком желудка с применением ТГО в рамках исследования FLAGS.
Клинический случай
Больной С. 69 лет. С апреля 2006 г. отметил появление болевого синдрома в эпигастральной области. Обратился к врачу в августе 2006 г. При эзофагогастродуоденоскопии (ЭГДС) выявлен рак желудка, при гистологическом исследовании – картина низкодифференцированной аденокарци-номы.
В сентябре 2006 г., по данным компьютерной томографии (КТ) органов брюшной полости, выявлены множественные метастазы в паренхиме печени (контрольные очаги: в S7 3,9×3,2 см, S4 2,0×1,9 см), метастазы в лимфатических узлах брюшной полости и забрюшинного пространства (справа от чревного ствола конгломерат 5,8×5,8 см, за селезеночной артерией 3,0×2,3 см).
При ЭГДС в октябре 2006 г. в желудке в средней трети передней стенки при переходе на малую кривизну отмечается язвенный дефект 4×2 см с дном, покрытым некротическим налетом на фоне опухолевой инфильтрации. Дистальная граница опухолевой инфильтрации – на уровне границы нижней трети и антрального отдела желудка по большой кривизне, проксимальная граница – на уровне середины верхней трети желудка по малой кривизне и задней стенке. Складки большой кривизны инфильтрированы.
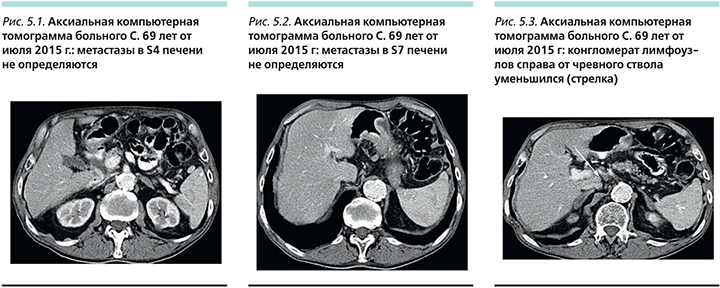
С октября 2006 г. в рамках протокола TPU-S1301 начата химиотерапия по схеме: ТГО 25 мг/м2 2 раза в сутки в течение 21 дня, цисплатин 75 мг/м2 – 144 мг, день 1-й. Интервал между курсами химиотерапии составил 4 недели.
После 2-го курса отмечена положительная динамика по данным КТ: уменьшение болевого синдрома, уменьшение размеров метастазов в печени до 1,7×1,5 в S7 и 0,8×0,6 в S4, (рис. 4). Общий эффект по критериям RECIST (Response Evaluation Criteria In Solid Tumors ) частичный.
В соответствии с протоколом проведено 6 курсов химиотерапии по схеме ТГО+цисплатин с дальнейшей терапией ТГО в монотерапии. С апреля 2007 г. продолжена монохимиотерапия ТГО 25 мг/м2 с 1-го по 21-й дни каждые 4 недели.
Всего проведено 111 циклов химиотерапии в рамках протокола. При контрольных обследованиях сохранялся частичный эффект.
После 100 циклов химиотерапии, по данным КТ (рис. 5) органов брюшной полости, метастазы в паренхиме печени не определяются, лимфоузлы справа от чревного ствола уменьшились до 0,9 см, за селезеночной артерией отчетливо не визуализировались.
По данным ЭГДС, все еще определялась первичная опухоль: В области угла желудка определялся неглубокий язвенный дефект с неровным дном, покрытым фибринозно-некротическим налетом. Края инфильтрированы, бугристы. Инфильтрат распространялся на нижнюю треть тела по малой кривизне и задней стенке. Стенка на этом участке была ригидной, слизистая оболочка плотная, бугристая. В остальных отделах стенки желудка эластичные, слизистая оболочка атрофичная с очаговой гиперемией. Заключение: инфильтративно-язвенный рак нижней трети тела желудка. Отмечалось уменьшение размеров опухоли, положительная динамика.
Переносимость лечения была очень хорошей. Лечение проводилось амбулаторно. За все время лечения отмечена гематологическая токсичность, в связи с которой проведение химиотерапии откладывалось на неделю (тромбоцитопения 2-й степени 4 раза), и негематологическая (периферическая сенсорная полиневропатия 1-й степени, появившаяся после цисплатина).
Впервые госпитализирован после 109-го цикла в связи с анемией и необходимостью гемотрансфузии. Вероятной причиной стало кровотечение из опухоли желудка на фоне приема ривароксабана, назначенного в связи с мерцательной аритмией.
Рост первичной опухоли без прогрессирования отдаленных метастазов отмечен после 110-го цикла в октябре 2015 г., в связи с чем лечение в рамках протокола TPU-3101 завершено.
Таким образом:
- Длительность лечения в режиме ТГО+цисплатин составила 108 месяцев, в 10 раз превысив медиану общей выживаемости при диссеминированном раке желудка.
- Хорошая переносимость ТГО в монотерапии позволила провести весь курс химиотерапии амбулаторно.
- Высокая эффективность химиотерапии позволила длительно проводить лечение метастатического рака желудка без удаления первичной опухоли.
- На фоне химиотерапии отмечен полный регресс метастазов в печени, лимфатических узлах и частичный регресс первичной опухоли.
- Частичный регресс первичной опухоли контролировался по ЭГДС с повторными биопсиями. Прогрес-сирование первичной опухоли отмечено только через 108 месяцев.
1. Globocan. Stomach cancer. Estimated incidence, mortlaity and prevalence worlwide https://globocan.iarc.fr/old/FactSheets/cancers/stomach-new.asp#INCIDENCE1.
2. Sanford M. S-1 (Teysuno): A Review of Its Use in Advanced Gastric Cancer In Non-Asian Populations. Drugs 2013;73(8):845–55.
3. Ajani J., Rodrieguez W., Bodoky G., Moiseyenko V., Lichinitser M., Gorbunova V., Vynnychenko I., Garin A., Lang I., Falcon S. Multicenter Phase III Comparison of Cisplatin/S-1 With Cisplatin/Infusional Fluorouracil in Advanced Gastric or Gastroesophageal Adenocarcinoma Study: The FLAGS Trial. J. Clin. Oncol. 2010;28(9):1547–53.
М.Е. Абрамов – к.м.н., ст. науч. сотр. отделения химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России, Москва
Опубликовано: 21 мая 2015 в 10:09
 Среди онкологических заболеваний тотальный рак желудка занимает одно из первых мест в «черном» списке. От этой патологии страдает сотни тысяч человек, и, к сожалению, зачастую исход болезни летальный. Лучшие специалисты тратят силы, крупные средства для поиска панацеи от смертоносного недуга.
Среди онкологических заболеваний тотальный рак желудка занимает одно из первых мест в «черном» списке. От этой патологии страдает сотни тысяч человек, и, к сожалению, зачастую исход болезни летальный. Лучшие специалисты тратят силы, крупные средства для поиска панацеи от смертоносного недуга.
При тотальном раке желудка различают несколько типов: экзофитный, эндофитный и смешанный. В первом случае новообразование имеет форму бляшки, гриба, полипа и выступает наружу органа с четко выраженным очертанием. Второй тип относится к более опасным видам и процент выживаемости довольно низок. Опухоль прорастает внутрь полости желудка и распространяется на весь орган по его поверхности. Смешанный тип сочетает в себе экзофитный и эндофитный рак и считается самым злокачественным образованием. К сожалению, прогнозы в данном случае неутешительны.
Симптомы тотального рака желудка
Раковые заболевания в начальной стадии проходят незаметно, в чем и заключается проблема преждевременного выявления онкологии. Только у 5% пациентов на ранних стадиях ощущают приступы тошноты, рвоты, отрыжки. Остальная часть не чувствует никакого дискомфорта. Именно по этой причине следует проходить профилактические проверки всего организма со сдачей онкомаркеров каждые полгода – год. Также на начальных стадиях тотального рака у 75% присутствует болевой синдром. 15% больных чувствует дисфагию, то есть проблемы с глотанием, воспалительные процессы в пищеводе, попадание пищи в ротовую полость, в нос, сухость дыхания.
Рак желудка с распадом
 Одним из самых тревожных симптомов при онкологическом заболевании желудка является перфорация органа. На стенках образуется перфорация, через которую поглощенная пища или желудочный сок проникает в полость живота. У больного развивается воспаление, отравление и причиняет острую боль, рвоту, тошноту. Врачи называют такое состояние термином «острый живот» и в таких случаях следует немедленно вызывать неотложку и прибегнуть к помощи квалифицированных специалистов. Также при онкологии с распадом доктора настоятельно рекомендуют не пользоваться обезболивающими средствами, так как временное снятие боли приведет к более тяжелым последствиям.
Одним из самых тревожных симптомов при онкологическом заболевании желудка является перфорация органа. На стенках образуется перфорация, через которую поглощенная пища или желудочный сок проникает в полость живота. У больного развивается воспаление, отравление и причиняет острую боль, рвоту, тошноту. Врачи называют такое состояние термином «острый живот» и в таких случаях следует немедленно вызывать неотложку и прибегнуть к помощи квалифицированных специалистов. Также при онкологии с распадом доктора настоятельно рекомендуют не пользоваться обезболивающими средствами, так как временное снятие боли приведет к более тяжелым последствиям.
Диссеминированный рак желудка
 Диссеминированный рак может распространяться на другие органы брюшной полости, на почки, печень, и другие системы. Опасность данного вида онкологического заболевания заключается в его быстром прорастании метастаз на другие органы организма. Любой вид поражения может сопровождаться мощным «выбросом» токсичных клеток и распространятся на всю полость пораженного органа. Вследствие воздействия тотального рака происходит распад органа, то есть обрыв желудка на несколько и более фрагментов.
Диссеминированный рак может распространяться на другие органы брюшной полости, на почки, печень, и другие системы. Опасность данного вида онкологического заболевания заключается в его быстром прорастании метастаз на другие органы организма. Любой вид поражения может сопровождаться мощным «выбросом» токсичных клеток и распространятся на всю полость пораженного органа. Вследствие воздействия тотального рака происходит распад органа, то есть обрыв желудка на несколько и более фрагментов.
Обширный рак желудка
 Обширный рак желудка включает в себя различные типы онкологических новообразований: экзофитный, эндофитный, опухоли с метастазами в другие органы брюшной полости. Данный тип заболевания сопряжен с большими трудностями при лечении. Болезнь выявляется на поздних стадиях.
Обширный рак желудка включает в себя различные типы онкологических новообразований: экзофитный, эндофитный, опухоли с метастазами в другие органы брюшной полости. Данный тип заболевания сопряжен с большими трудностями при лечении. Болезнь выявляется на поздних стадиях.
Опытные специалисты, ведущие онкологи всего мира настоятельно рекомендуют проходить тщательное обследование организма как минимум каждые полгода. В то же время, для профилактики онкологических и других видов заболеваний, для поднятия иммунитета, укрепление общего состояния организма следует вести здоровый образ жизни, отказаться от алкогольных напитков, курения. Ежедневные прогулки по свежему воздуху, здоровое питание, крепкий сон, обход стрессовых ситуаций – прямой путь к одолению серьезных заболеваний, в том числе и тотальных.
Новости онкологии
07.04.2016
 Тюляндин Сергей Алексеевич
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Имеет ли клиническое значение удаление первичной опухоли у больного с метастатическим процессом? Это не праздный вопрос. Нефрэктомия у больных раком почки с наличием отдаленных метастазов улучшает качество жизни больного, повышает эффективность последующего лекарственного лечения и достоверно увеличивает продолжительность жизни. А как насчет рака желудка? Сегодня показанием к выполнению гастрэктомии у больных метастатическим раком желудка является кровотечение из распадающейся опухоли или угроза его повторения, а также стеноз кардиоэзофагеального или пилорического отделов. Можно ли надеяться, что выполнение плановой гастрэктомии у больных с метастатическим процессом улучшит прогноз больного? Теоретически возможно. Гастрэктомия существенно уменьшит объем опухолевой массы и иммуносупрессию, элиминирует потенциальный источник новых метастазов и симптомы болезни, обусловленные первичной опухолью. Все это может способствовать повышению эффективности последующей химиотерапии. С другой стороны, выполнение гастрэктомии может сочетаться с послеоперационными осложнениями, откладывает начало и повышает токсичность лекарственной терапии, что негативно отразится на результатах лечения.
На этот вопрос попыталось ответить исследование REGATTA, выполненное в Японии и Корее. В это исследование включались больные с подтвержденным диагнозом рака желудка в возрасте 20-75 лет и наличием первичной опухоли Т1-3 и лишь одного проявления метастатического процесса по данным КТ и диагностической лапароскопии из следующих: H1 – наличие 2-4 метастазов в печени с размером >1 cм и <5 см; P1 – метастазы по диафрагме и брюшине выше поперечноободочной кишки без массивного асцита и кишечной обструкции; L1 – метастазы в забрюшинные параортальные лимфоузлы выше чревного ствола или ниже а. inferior mesenterica (16a1/b2). В исследование не разрешалось включать больных с клинически значимым плевритом или асцитом, инвазией пищевода 3 см и более, затрудненным питанием и признаками кровотечения из первичной опухоли, ранее проведенной химиотерапией или лучевой терапией. Больные были рандомизированы в группу гастрэктомии с последующим проведением химиотерапии или группу только химиотерапии. Стратификация осуществлялась по характеру N (N0-1 vsN2-3) и локализации метастатического процесса (H1 vs P1 vs L1). Всем больным в группе операции выполняли гастрэктомию с D1 лимфодиссекцией, после чего в течение 8 недель после ее выполнения начинали химиотерапию. Все больные в данном исследовании получали S-1 80 мг/м2 ежедневно в 1-21 дни и цисплатин 60 мг/м2 в день 8, лечение повторяли каждые 5 недель до признаков прогрессирования или непереносимой токсичности. Основным критерием эффективности была медиана продолжительности жизни, вторичными критериями – медиана времени до прогрессирования и токсичность.
За период 2008-2013 гг. в исследование было включено 175 больных: 86 – в группу химиотерапии и 89 – в группу операции и химиотерапии. Запланированное лечение не было проведено 12 и 13 больным соответственно, эти больные вошли в анализ продолжительности жизни, но у них не производилась оценка токсичности. Медиана возраста больных составила 60 лет, 30% из них были женщины, Т3 составляли 90% всех опухолей, а N2-3 – 53%, основной локализацией метастазов была P1 – 75%. Тотальная гастрэктомия была выполнена у 64%, дистальная и проксимальная – у 30%, пробная лапаротомия – у 2%.
Исследование было остановлено после промежуточного анализа, который показал равную эффективность лечения в обеих группах и низкий шанс того, что гастрэктомия улучшит результаты лечения, если в исследование будут включены запланированные 330 больных. При медиане наблюдения 14,5 месяца медиана продолжительности жизни в группе химиотерапии составила 16,6 мес. и 14,3 мес. в группе операции и химиотерапии (HR=1,09 p=0,7). При исключении 25 больных, не получивших запланированного лечения, результаты не изменились (HR=1,01). Показатель 2-летней общей выживаемости составил в группах 31,7% и 25,1%, а 2-летняя безрецидивная выживаемость – 8,4% и 13% соответственно. Подгрупповой анализ показал, что выполнение гастрэктомии достоверно ухудшает прогноз больных с локализацией первичной опухоли в верхней трети желудка и с N0-1. Число проведенных курсов химиотерапии составило 7 в группе химиотерапии и 4,5 в группе хирургического лечения и химиотерапии. Частота побочных эффектов, особенно лейкопении, анорексии, тошноты и гипермагниемии, была выше в группе операции и химиотерапии.
Таким образом, это исследование показывает, что выполнение гастрэктомии с последующей химиотерапией у больных раком желудка с ограниченным метастатическим процессом не приводит к улучшению прогноза по сравнению с проведением стандартной химиотерапии. Более того, у больных с локализацией опухоли в верхней трети желудка или N0-1 хирургическое лечение и химиотерапия приводят к ухудшению результатов лечения по сравнению с только химиотерапией. Проведение химиотерапии оперированным больным сопровождалось большей токсичностью и худшей переносимостью, что частично объясняет меньшее число проведенных курсов лечения по сравнению с группой химиотерапии. Таким образом, для больных с метастатическим процессом химиотерапевтическое лечение остается стандартным подходом. Гастрэктомия, даже у больных с ограниченным метастатическим поражением, не улучшает отдаленные результаты лекарственной терапии.
Ключевые слова: рак желудка, метастазы, оперативное лечение, гастрэктомия.
Литература:
- Fujitani K, Yang H-K, Misuzawa J, et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single-curable factor (REGATTA): a phase 3, randomized controlled trial. Lancet Oncol. 2016, 17: 309-18.
Узнать больше о лечении опухолей ЖКТ можно на
Большой конференции RUSSCO 14-15 апреля 2016 в Москве
![]()
![]()
![]()
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.



