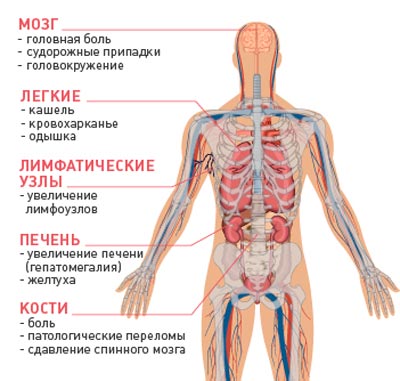
Схема elf при раке желудка
Химиотерапия часто применяется при лечении рака желудка. Метод заключается во вводе в организм специальных противоопухолевых медицинских препаратов, способных остановить разрастание онкологического процесса. Назначают химиотерапию при онкологии и в других участках тела. Врачи считают способ эффективным для остановки роста опухоли и уменьшения метастазного разрастания. Химиотерапия в лечении онкологического процесса применяется совместно с облучением гамма-лучами и оперативным вмешательством. Применяется ряд видов и схем применения лекарственных препаратов. Из-за агрессивного воздействия средств на организм у химиотерапии есть противопоказания, часто проявляются побочные эффекты.
Показания для химиотерапии в лечении рака желудка
Рак желудка в первые 3 стадии лечится при помощи хирургического способа. 4 стадия считается неоперабельной. Здесь применяется химиотерапия, чтобы продлить жизнь пациенту на несколько лет и купировать неприятные симптомы.
После операции химиотерапия требуется для предотвращения рецидива, т.к. онкологический процесс в тканях желудка отличается стремительным и агрессивным разрастанием. С метастазами злокачественные клетки проникают в отдалённые участки тела, что может спровоцировать повторное появление опухоли в других органах. Химиотерапия предотвращает проникание онкологии через кровоток.
Известны случаи, когда курсы химиотерапии могут назначаться до операции. Противоопухолевые лекарства приостанавливают злокачественный процесс, предотвращается распространение метастазов, операция проходит без тяжёлых последствий, снижается риск рецидива.
Показания для применения данного метода:
- Пациенту отказано в проведении операции по удалению злокачественного новообразования из-за обширного метастазирования.
- Для операции требуется уменьшить объём опухоли.
- В целях профилактики после удаления онкологического образования, чтобы предотвратить рецидив болезни.
Курсы и дозировку онколог подбирает индивидуально. Делают химиотерапию в условиях стационара, в домашних условиях либо амбулаторно. Зависит выбор от перечня факторов:
- общее самочувствие больного;
- присутствует индивидуальная непереносимость применяемых лекарств;
- способ проведения ввода противораковых препаратов.
Есть показания, когда использовать противоопухолевые средства не стоит, но врач настаивает, поясняя, что метод не принесёт сильного вреда. Такими случаями считаются следующие:
- больной лечился антибактериальными средствами;
- проходило лечение эпилепсии;
- человек болен СПИДом;
- имеется хроническое заболевание – ревматоидный артрит;
- детям до 6 лет курсы назначают с осторожностью;
- пациентам после 65 лет проведение процедуры рекомендуется в случае крайней необходимости.
Противопоказания к применению метода
У химиотерапии есть ряд противопоказаний, когда использовать её опасно для человека. В этих случаях врач может отказаться от применения данного метода и остановиться на хирургическом методе и облучении.
Химиотерапия при раке желудка запрещена в следующих случаях:
- присутствуют патологии в почках и печени хронического характера;
- онкология диагностирована неинвазивного типа;
- у больного есть тяжёлые заболевания инфекционного характера;
- отсутствует положительный эффект от процедуры;
- присутствует закупорка в желчных протоках;
- у пациента диагностировано тяжёлое состояние;
- нервные расстройства;
- при беременности процедура не рекомендована до момента родов;
- нахождение опухоли во внутренних слоях органа.
При наличии подобных факторов врач подбирает другие варианты лечения. Введение противоопухолевых препаратов способно проявить неприятные последствия.
Особенности воздействия химии на организм при всех стадиях рака желудка
Курс противораковыми лекарствами может назначаться перед проведением операции, совместно с оперативным вмешательством либо после резекции в виде профилактики. На начальных 3 стадиях онкологию помогает вылечить приём комплекса лекарственных препаратов, останавливающих рост злокачественных клеток. Эффективность способа зависит от скорости проникания медикаментов по организму. Больному прописываются соответствующие препараты в виде таблеток либо инъекций.
На 3 и 4 стадии болезни применение химии учащается. Используется системный способ введения цитостатиков либо в брюшную полость через надрез. Онкология на 3 стадии лечится куративной или излечивающей химиотерапией. Курс проводится, если сохраняется возможность провести оперативное вмешательство. На последней стадии патологии используется паллиативный метод как основной. На этом этапе опухоль не реагирует на хирургический способ лечения и радиоактивное облучение, остановить рост возможно лишь при помощи средств из группы цитостатиков.
Эффективность метода в лечении патологии
Положительный эффект от химии можно получить при совместном применении с операцией по удалению злокачественного новообразования. Полностью вылечить рак желудка можно только при помощи полной или частичной резекции патологического узла. Большое влияние оказывает степень поражения организма злокачественными метастазами. При распространении опасного процесса на небольшой участок повышается шанс на полное излечение. Органы с метастазными ростками удаляются совместно с опухолью.
На 2 и 3 стадии патологии возможно продлить жизнь больному до 5 лет и дольше. В случае глубокого поражения организма цитостатики помогают продлить срок жизни пациента на несколько лет. Указанный метод на 4 стадии особенно востребован, чтобы позволить человеку прожить ещё 3 – 5 лет.
Разновидности химиотерапии
Сейчас разработано несколько разновидностей введения препарата в организм. Выделяются виды:
- Самостоятельный метод используется редко из-за сложности воздействия на ткани желудка лекарств. Применяют при серьёзных противопоказаниях к оперативному удалению. При распространении метастазов лекарства помогут остановить распространение злокачественных клеток по организму и купировать неприятные симптомы. Данный вид позволяет продлить жизнь больного и улучшить качество последних дней. Вылечить болезнь полностью не удастся.
- Адъювантная химиотерапия применяется после проведения резекции опасного новообразования. Оставшиеся патогены уничтожаются под воздействием препаратов – это помогает предотвратить рецидив. Сложность в проведении курса заключается в побочных эффектах, которые организму тяжело перенести после полной резекции опухоли. Возможно развитие опасных для жизни последствий. В этом случае решение принимает лечащий врач на основании медицинских показателей и физическом самочувствии больного.
- Неоадъювантный вид заключается во вводе лекарств в организм до операции – это увеличивает шанс больного на положительный результат оперативного вмешательства. Новообразование уменьшается в размерах и распространение метастазов останавливается, что увеличивает шансы пациента на выздоровление.
- Паллиативная химиотерапия применятся на последней стадии заболевания, когда метастазы проникли в большую часть тела. Лекарства позволяют купировать неприятные признаки и продлить срок жизни пациенту до 3-5 лет. Препарат вводят при помощи капельницы. Курс проходит совместно с радиоактивным облучением. После этого проводят процедуру резекции части больного органа. Вторая часть соединяется с кишечником. Медикаменты используются с сильным наркотическим действием.
- Внутрибрюшинный вид используется достаточно редко. Применяют при наличии жидкости и раковых клеток в брюшной полости. Постороннюю жидкость откачивают и вводят химпрепараты через катетер. Дополнительно назначаются для приёма внутрь лекарства противорвотного действия.
Виды лекарств, применяемые в химиотерапии
Противоопухолевые средства относятся к высокотоксичным лекарствам. Чаще всего используют Доцетаксел, 5-фторурацил, Митомицин, Лейковорин, Эпирубицин и Цисплатин. Курс длится 5 дней. При лечении болезни Ходжкина используют Винкристин, Преднизолон, Эмбихин и Кармазин.
Медикаменты делятся на следующие группы:
- Метаболиты состоят из фторпиримидинов. Препараты останавливают рост злокачественного образования, снижают распространённость по телу и уничтожают часть патогенов. Сюда относят 5-фторурацил, Гемцитабин, Кселоду и Фторафур.
- Антибиотики требуются для предотвращения воспаления внутри организма или чтобы остановить присутствующий процесс. Действующее вещество таких медикаментов – Нитрозомочевина. К данному типу относят Эпирубицин, Доксорубицин и Митомицин.
- Топоизомеразы являются активными противоопухолевыми препаратами. Чаще всего применяют UFI.
Схемы ввода лекарств при раке желудка
Любая схема имеет специальное название, помогающее медперсоналу определить курс приёма медикаментов. Выделяют перечисленные варианты приёма:
- МЕР используется у молодых людей с хорошей защитной функцией организма. Не допускается наличие внутренних кровотечений и индивидуальной непереносимости на вводимые вещества. Курсы чередуются каждый месяц. В 1 и 7 день вводят Митомицин. В 5 и 6 день – Этопозид и на 2 с 8 днем – Цисплатин.
- ELF подходит для людей после 55 лет. Лекарства вводят 1 раз каждые 27 дней. Внутривенно пациенту вводят Этопозид, Лейковорин и 5-фторурацил первые 3 дня. Это помогает снять высокую нагрузку с ослабленного организма.
- ТС относится к предельно эффективным, но отличается тяжёлыми побочными проявлениями. Поэтому применяют редко. Однократное введение повторяют через 21 день. Внутривенно вводятся Доцетаксел с Цисплатином по 75 мг каждый.
- TCF характеризуется более тяжёлым воздействием на опухоль и организм больного. По схеме приёма схожа со схемой ТС, дополнительно применяют 5-фторурацил (вводят ежедневно в течение 5 дней по 750 мл).
- ECF используется часто из-за отсутствия тяжёлых последствий и лёгкой переносимости пациентами. Применяют Эпирубицин, Цисплатин однократно. Затем только через 21 день. 5-фторурацил используют ежедневно на протяжении 20 недель.
- FLOT (флот) характеризуется приёмом Доцетаксела с Оксалиплатином, Лейковорин, 5-фторурацил. Курс повторяется каждые 14 дней.
В каждом случае врач индивидуально подбирает схему и вид лекарств для лечения опасного заболевания. Препараты используются в таблетках, внутривенно либо в виде суспензии.
Подготовка к процедуре
Для ввода сильнотоксичных средств требуется тщательно подготовить организм – это позволит снизить проявление побочных эффектов и повысить положительный результат курса.
За месяц до процедуры больному рекомендована специальная диета. Режим требуется для снижения побочных явлений со стороны желудочно-кишечного тракта. Также правильно подобранное питание снимет лишнюю нагрузку с органов пищеварения. Рацион составлен из большого количества белка с витаминами и микроэлементами. Кушать нужно часто и маленькими порциями. Разрешается однократно принять до 150 г пищи.
Рекомендуется полностью исключить жирные блюда, острые приправы, солёные и маринованные продукты, а также копчёности. Употреблять стоит пищу тёплую – холодная и горячая раздражает слизистую желудка, что негативно сказывается на самочувствии пациента.
Для химиотерапии требуется предварительный приём инфузионных препаратов и гепатопротекторов, эффективно влияющих на метаболические процессы внутри организма.
Проявление побочных эффектов после процедуры
После химиотерапии страдает защитная функция организма, что проявляется соответствующими симптомами. Некоторые признаки удаётся купировать приёмом медикаментов. Известны проявления, которые невозможно снять таблетками, рекомендуется ждать.
Частые побочные проявления:
- Выпадение волос в больших объёмах.
- В ротовой полости развиваются тяжёлые воспаления – стоматиты.
- Снижается или полностью отсутствует аппетит.
- Пациента постоянно мучают приступы тошноты.
- В некоторых случаях могут присутствовать рвотные позывы.
- Ослабевает костная ткань, что приводит к образованию остеопороза.
- Часто диагностируются различные заболевания сердечно-сосудистой системы.
- Может развиться лейкемия из-за нарушенного кровяного состава.
- Слёзные железы работают в усиленном режиме, что приводит к повышенному слезотечению.
- Снижается слуховая функция ушной раковины.
- На поверхности кожи появляются посторонние высыпания.
- Верхние и нижние конечности периодически немеют или ощущается покалывание.
- Снижается масса тела.
- Возможно заражение крови.
- Стремительно развивается нейтропения из-за отсутствия необходимых кровяных телец в костном мозге.
- Появляются проблемы с глотанием, может наступить спазм глотки.
- Формирование внутренних или внешних кровотечений.
Проявление неприятных симптомов индивидуально. Влияет физическое состояние пациента и правильно проведённая подготовительная процедура.
Возможные осложнения метода
Как и любой метод воздействия на организм при помощи высокотоксичных лекарственных препаратов химиотерапия обнаруживает ряд осложнений, негативно влияющих на здоровье человека. Погибают не только злокачественные патогены, страдают и здоровые клетки тела.
Чаще всего диагностируют следующие осложнения после приёма препаратов из группы цитостатиков:
- вторичное метастазирование с формированием новых онкологических очагов в других участках тела;
- у людей в зрелом возрасте резко снижается половая активность;
- внутренние кровотечения, связанные с неполной резекцией злокачественного новообразования и образованием рецидива патологии;
- полное отсутствие аппетита, требующее дополнительного лечения;
- острая реакция кишечного отдела на лекарства в виде тяжёлой диареи;
- развитие миелосупрессии – снижение уровня основных элементов в составе крови (лейкоцитов с тромбоцитами и эритроцитами);
- формируются опасные заболевания крови – тромбоцитопения или анемия;
- луковицы волос меняют структуру, что проявляется выпадением старого покрова и заменой на новый с другим цветом и структурой;
- качественно меняется состав крови, что характеризуется сильным переутомлением, частой усталостью после небольших нагрузок и кровоизлияниями верхние слои кожи;
- страдают слизистые желудка, что проявляется соответствующими расстройствами в переваривании пищи и метаболических процессах.
Во время проведения курсов химиотерапии требуется регулярно сдавать кровь в лаборатории на контроль основных элементов. В основном это проводится каждые 3 недели.
При появлении рвотных масс с примесью крови либо коричневого оттенка выделяемых масс курс приёма цитостатиков приостанавливается. Также следует поступить при наличии таких признаков в каловых выделениях. Здесь требуется применение симптоматической терапии с переливанием крови. При выявлении распада опухоли после кровотечения желудок вырезается полностью.
При резком снижении массы тела процедура также останавливается до момента набора нужного веса, чтобы продолжить лечение. Расхождение веса в 10% считается опасным для жизни человека.
Питание при лечении противоопухолевыми средствами
Восстановление желудка после рака и химиотерапии идёт быстрее при правильно подобранном и сбалансированном питании. Приём продуктов, содержащих витамины и микроэлементы, восполняет дефицит полезных веществ.
Потребуется исключить из рациона животные жиры – сметану, молоко и кисломолочные продукты, яйца, мясо, рыбу и т.п. Сахар и соль использовать редко, по необходимости. Копчёности и маринованные блюда полностью убрать. Запрещено употреблять соленые, консервированные салаты и другие заготовки – это раздражает слизистую желудка, что негативно влияет на процесс лечения. Не стоит готовить блюда при помощи жарки, даже на гриле. Сладкую выпечку, сдобу, пирожные и торты, пирожки не стоит употреблять.
Организму требуется большое количество растительной клетчатки, стоит увеличить потребление таких продуктов. Врачи советуют обогатить готовые блюда оливковым или льняным маслом. Брать лучше холодного отжима. Рекомендуется обогатить питание кашами из цельного зерна на воде. Хлеб разрешается с отрубями, приготовленный без использования дрожжей. Овощи и фрукты нужно кушать ежедневно в сыром виде и в большом количестве. Все готовые блюда подавать к столу с зеленью в достаточном объёме.
Готовить рекомендуется пищу на пару, варить, тушить без острых приправ и запекать в духовке. Количество употреблений нужно увеличить до 5-6 раз. Порции не должны превышать 150 г – это снизит отдачу необходимой энергии организмом.
Диета заключается в приёме следующих продуктов:
- Мясо нужно заменить на бобовые продукты – это богатый источник белка, который не требует высоких затрат организма на переваривание и усвоение.
- Рыбу можно принимать редко и заменить на морскую нежирных сортов.
- Продукты из молока должны быть обезжиренными.
- Пригоревшую пищу употреблять нельзя.
- Кофе, сладкие газировки и алкогольные напитки запрещены.
- На время химиотерапии и восстановления можно пить простую воду без газа.
- Массу тела нужно контролировать каждый день.
Восстановление слизистой после процедуры
Препараты из группы цитостатиков обладают высокотоксичным действием, поэтому оказывают на организм угнетающее действие. После курсов химии требуется индивидуальная программа восстановления пострадавшего органа. Здесь подбирается специальная диета, очищение лекарственными травами, ароматерапия, лечебное плавание и т.п.
Купировать осложнения, связанные с расстройством слизистой органов желудочно-кишечного тракта, можно при помощи отваров из лечебных трав. Остановить рвотные позывы можно полынью, горечавкой и др. Расстройство стула лечится: понос настойками из бадана, калгана и сабельника болотного; запор – сенной, укропом, фенхелем, крушиной и анисом.
Курс восстановления заключается в следующих мероприятиях:
- Снять признаки общей интоксикации можно употреблением большого количества жидкости – отвар из ягод шиповника, рябины, ягодные морсы из брусники и клюквы.
- Назначаются мочегонные травы – корень пырея и хвощ полевой.
- Вывести токсины помогут Полифепан, Активированный уголь, Зостерин, из трав можно взять – дягиль, семечки льна, алтей.
- Приготовить отвар из багульника болотного, чабреца ползучего и цетрарииисландской.
Правильно проведённая процедура с набором эффективных препаратов поможет вылечить рак желудка без появления опасных побочных эффектов и осложнений.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди:
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Несмотря на мировые тенденции снижения заболеваемости раком желудка, этот вариант злокачественных опухолей продолжает терзать человечество. По данным ВОЗ, 755 000 новых случаев рак желудка (РЖ) диагностируется в мире ежегодно, чаще регистрируется только рак легкого. В России рак желудка встречается более чем в 2,5 раза чаще, чем в западноевропейских странах и более чем в 6 раз чаще, чем в США. По показателям смертности от РЖ Россия занимает 1–е место в мире у обоих полов, на 2–ом месте Казахстан, Япония на 4–м месте у мужчин, США на 44–м месте у мужчин и женщин [1].
По показателям смертности от рака желудка Россия занимает 1-е место в мире.
Хирургия – пока единственный метод, способный излечить больных РЖ в I и II (редко в III) стадиях. Лучевая терапия имеет подсобное значение.
Агрессивное течение рака желудка, ранняя диссеминация требуют разработки системных методов лечения этого заболевания.
Прогресс лекарственной терапии РЖ пока весьма скромен, хотя считается, что аденокарциномы желудка в большей степени чувствительны к химиопрепаратам, чем все прочие опухоли желудочно–кишечного тракта. Трагедия состоит в том, что обусловленные химиотерапией ремиссии длятся 3–4 месяца, полные эффекты регистрируются редко.
Набор препаратов, применяемых для лечения рака желудка, включает в себя производные фторпиримидинов (5–фторурацил, фторафур, UFT, S1, капецитабин), метотрексат, этопозид, тенипозид, доксорубицин, эпирубицин, митомицин С, кампто, топотекан, цисплатин, оксалиплатин, таксол, таксотер, производные нитрозомочевины. Эффекты в режиме монотерапии регистрировались в диапазоне 5–25%. Общепринятым подходом к лечению больных РЖ является назначение комбинаций противоопухолевых препаратов, эффект при этом суммируется и достигает 40–50%.
В химиотерапии РЖ развивается четыре направления:
• адъювантное применение препаратов после радикальных операций;
• послеоперационная интраперитонеальная терапия, неоадъювантное назначение лекарств до операций;
• химиотерапия диссеминированного РЖ.
Адъювантная химиотерапия
Целью адъювантной химиотерапии является воздействие на микрометастазы РЖ, оставшиеся после хирургического удаления первичной опухоли и макрометастазов (главным образом в лимфоузлах). Критериями эффекта считаются медиана выживаемости и 5–летняя выживаемость в исследуемой группе и контроле.
Адъювантные комбинированные программы строились на основе фторурацила, митомицина С, нитрозомочевин.
По существу отрицательные результаты получены при адъювантном назначении следующих комбинаций: семустин + фторурацил, митомицин + UFT, митомицин + фторурацил + цитозар, фторурацил + адриамицин + митомицин. Мета–анализ, выполненный в 1993 и 1999 гг., свидетельствовал лишь о небольшом, маргинальном значении вышеуказанных комбинаций для профилактики рецидивов болезни [2, 3].
Из работ с позитивным результатом следует указать на исследование Neri et al., применявших в качестве адъювантной терапии комбинацию фторурацила, лейковорина и эпирубицина. В контроле медиана выживаемости составляла 13,9 мес, в химиотерапевтической группе 20,4 мес; 5 лет выжили соответственно 13 и 25%. Разница была статистически достоверна [4].
В крупном итальянском исследовании (137 больных) было показано, что 2 цикла по схеме ЕАР (этопозид + адриамицин + цисплатин), а затем 2 цикла по схеме фторурацил + лейковорин улучшили пятилетнюю выживаемость по сравнению с контролем всего на 4%. В группе с адъювантной терапией выжили 52%, в чисто хирургической – 48%. Однако при раздельном анализе, в случае наличия метастазов в 6 лимфоузлах и менее (N1) и метастазах в 7 и более лимфоузлах (N2) разница была очевидной [5]. При N1 распространении (144 больных) пятилетняя выживаемость составила 61% в группе получавших химиотерапию и 60% в чисто хирургической, при N2 распространении (77 больных) выжили 5 лет после химиотерапии 42% больных (в контрольной группе 22%) [5].
В мета–анализе 2000 г. (Floriani et al. рассматривали 19 исследований адъювантной химиотерапии на 3510 больных РЖ) утверждается, что противоопухолевые лекарственные режимы на 17% уменьшили риск смерти по сравнению с хирургическим контролем [6].
Впечатляющие результаты были получены от сочетанной химиолучевой адъювантной терапии. Macdonald et al. в 2000 году представили итоги международного исследования SWOG 9008/Int 0116. на 603 резектабельных больных РЖ. Пациенты в лечебной группе получали 5 циклов химиотерапии фторурацилом и лейковорином и облучение 45 Гр. Медиана выживаемости составила 27 мес в контроле и 42 мес в группе с химиолучевым лечением; 3 года выжили 41 и 52% [7]. Увеличение медианы продолжительности жизни на 15 месяцев – серьезная заявка на признание стандартным такого вида адъювантной терапии РЖ.
Внутрибрюшинная адъювантная химиотерапия
При инвазии серозы и опухолевом поражении регионарных лимфоузлов высок риск перитонеальной диссеминации. В абдоминальных смывах находят опухолевые клетки соответственно в 12,4% и 7,5% [8]. В связи с повышением риска при таких находках разрабатывается внутрибрюшинная адъювантная химиотерапия.
Австрийские исследователи Rosen et al. в 1998 г. в результате послеоперационного введения в брюшную полость митомицина добились увеличения медианы выживаемости с 515 дней в контроле до 738 дней [9].
Yu et al. улучшили 2–х годичную выживаемость при резектабельном раке желудка с 29,3% в контроле до 38,7% в группе получавших внутрибрюшинно после операции фторурацил и митомицин [10].
Метод внутрибрюшинной профилактики требует дальнейшей разработки.
Неоадъювантная терапия
Предоперационная или неоадъювантная терапия рациональна, поскольку в принципе доказана химиочувствительность раковых клеток желудка. Реалистичной является задача уменьшения стадии заболевания. Толерантность химиотерапии лучше до операции, чем после. Более осмысленным может быть выбор лекарств для последующей адъювантной химиотерапии. Сохраняется также цель воздействия на микрометастазирование. Критериями неоадъювантной терапии являются непосредственный эффект на опухоль, резектабельность, медиана выживаемости, процент одно– и двухгодичной выживаемости, отдаленные результаты. В крупных японских и американских онкологических центрах ранним маркером эффекта считается уменьшение накопления меченой по F–18 фтордезоксиглюкозы, определяемое на ПЭТ (позитронно–эмиссионной томографии) [11].
Большинство исследований по неоадъювантной терапии РЖ носили пилотный характер. Приводим в таблице 1 некоторые результаты таких исследований.
В 2000 и 2001 гг. появились сообщения об успешном использовании в неоадьювантных режимах таксола и цисплатина, таксотера с цисплатином и фторурацилом, кампто и цисплатина. Однако выполнены они на малом числе больных.
Лечение диссеминированного РЖ
Этап диссеминации РЖ – самый трудный для больных. Существует точка зрения у части онкологов, что применение химиопрепаратов в этой фазе заболевания бесполезно. Между тем выполнено несколько кооперированных исследований, в которых сравнивались качество жизни и ее продолжительность при современной поддерживающей терапии и химиотерапии. Поддерживающее лечение включало в себя парентеральное питание, обезболивание, уход и т.д. Медиана выживаемости в этой группе составила 4–5 мес, а в химиотерапевтических группах (использовались фторурацил, лейковорин, митомицин) медиана выживаемости была вдвое больше [15].
Ниже приведены стандартные схемы химиотерапии, применяемые в настоящее время для лечения метастатического РЖ:
ELF. Этопозид 120 мг/м2, лейковорин 300 мг/м2, фторурацил 500 мг/м2. Препараты вводятся в 1–3 дни каждые 28 дней. Режим показан для применения у ослабленных больных и пожилых людей. Непосредственный эффект – до 48%, полный – в 12%, медиана выживаемости – 10 мес. [16].
VLF. Тенипозид 60 мг/м2, 5–фторурацил 500 мг/м2, лейковорин 20 мг/м2 1–3 дни. Лечение повторяли каждые 3 недели. Эффективность составила 23,5%, стабилизация – у 52,9% больных. Время до прогрессирования 20 нед. Более года жили 23,5% больных (собственные данные).
ЕАР. Адриамицин 20 мг/м2 1, 7 дни; этопозид 100 мг/м2 в 4–6 дни; цисплатин 40 мг/м2 во 2 и 8 дни. Цикл повторяется каждые 28 дней. Средняя эффективность 34%, полный ответ – до 15%, медиана выживаемости – 6–13 мес [17].
FAMTX. Метотрексат 1500 мг/м2 в/в струйно после гидратации день 1–й; фторурацил 1500 мг/м2 в/в инфузия 4 часа через 1 час после введения метотрексата, лейковорин 15 мг/м2 внутрь через 24 часа после метотрексата, каждые 6 часов 3 дня, адриамицин 30 мг/м2 15 день. Цикл повторяют каждые 4 нед. Эффект – до 40% больных, в 12% полный. Медиана выживаемости – 10 мес [17].
PELF. Цисплатин 40 мг/м2 1 и 5 дни, эпирубицин 30 мг/м2 1 и 5 дни, лейковорин 100 мг/м2 1 и 4 дни, фторурацил 300 мг/м2 1 и 4 дни. Цикл повторяют каждые 28 дней. Общий эффект 51%, в том числе полный 13%. 1 год выжили 30,8%, два года – 15,7% больных [18].
MVP и MEP. Митомицин С 5 мг/м2 в 1 и 7 дни, цисплатин 40 мг/м2 2, 8 дни и с 4 по 5–й дни вводили тенипозид 60 мг/м2 или этопозид 100 мг/м2. Интервал между курсами 4 нед. Объективный ответ регистрируется в 42,7 и 32,7% случаев. Медиана выживаемости – 54 и 44 нед (собственные данные).
TFP. Таксотер 80 мг/м2 1 день, 5–фторурацил 300 мг/м2 2–4 дни, цисплатин 60 мг/м2 5–й день. Лечение проводилось каждые 3 нед. Эффективность – 46,6%, стабилизация – 20% больных. Время до прогрессирования 22 недели. Медиана выживаемости – 48 нед. Одногодичная выживаемость была у 26,6% больных (собственные данные)
На ежегодных конференциях ASCO в 2000 и 2001 гг. докладывался опыт комбинированного применения таксотера с цисплатином и фторурацилом (эффект в диапазоне 36–52%, 48% – по нашим данным, медиана выживаемости 10,4 мес); таксола с фторурацилом в инфузиях, лейковорином и цисплатином (эффект до 70%, медиана выживаемости 11–14 мес); кампто с митомицином, цисплатином, фторурацилом и лейковорином (эффект до 50%, медиана выживаемости – 8 мес); оксалиплатина с фторурацилом и лейковорином (эффект 46% леченных ранее больных, медиана выживаемости до 11 мес); UFT с цисплатином (эффект у 51,2% больных, медиана выживаемости – 8,3 мес); S1 с цисплатином (эффект 76%, медиана выживаемости 8 мес) [19,20].
Заканчивая обзор о современных возможностях химиотерапии рака желудка, обозначим ближайшие ориентиры и цели для развития терапевтических подходов к этой проблеме:
1) В исследованиях по адъювантной терапии следует чаще включать в испытываемые комбинированные режимы таксаны, кампто, оксалиплатин, капецитабин. Чаще нужно практиковать химиолучевые методы.
2) Неоадъювантные схемы, построенные на основе фторурацила и цисплатина, должны стандартно применяться при местно–распространенном РЖ, т.к. они достоверно повышают медиану выживаемости и 2–хгодичную выживаемость.
3) Фторурацил, лейковорин, цисплатин, или митомицин остаются основой для создания новых комбинаций для лечения РЖ, которые наращиваются за счет таксанов, кампотецинов или модифицируются за счет оксалиплатина или кселоды.
4) Реальной представляется задача увеличения медианы выживаемости у этой сложной категории больных до 18 месяцев с увеличением одно– и двухгодичной выживаемости и улучшения качества жизни.
Литература:
1. Mortality database 1994 – 1997. World Health Organization 1999.
2. Hermans J., Bonenkamp J., Boon M.C. et al. – J. Clin. Jncol 1993: 11: 1441.
3. Earle C.C., Maroun J.A. – Eur. J. Cancer 1999; 35: 1059.
4. Neri B., de Leonardis V.,Romano S. et al. – Br. J. canc. 1996; 73: 549.
5. Di Bartolomeo M.E., Bajetta E., Bordogna E. et al. – Proc. ASCO 2000, ab. 934.
6. Floriani I., Mari E., Cascinu S., et al. – Proc. ASCO 2000, AB. 1017.
7. Macdonald J.S., Smalley S., Benedetti J. et al. – Proc. ASCO 2000, ab. 1.
8. Hartgrink H.H., Bonenkamp H.J. Van de Velde C.J.H., et al. – ESMO–EONS Symp. p. 107, Budapest, 2001.
9. Rosen H.R., Jatzko G., Repse S. et al. – Clin. Oncol. 1998, 16: 2733.
10. Yu W., Whang I., Suh I. et al. Ann. Surg. 1998; 228: 347.
11. Ichiya Y., Kuwabara Y., Sasaki M. et. al. – Ann. Nucl. Med. 1996; 10: 193.
12. Ajani J.A., Ota D.M., Jesup J.M., et al. –Cancer 1991;68:1501
13. Siewert R., Bottcher K., Roder J.D. et al. – Br. J. Surg. 1993; 80: 1015.
14. Mansfield P.F., Lowy A.M.,Feig B.W. et. al. Proc. ASCO 2000, ab. 955.
15. Van Cutsem E. ESMO – EONS Educational Symp. Budapest, 2001.
16. Kim. G.P., Takimoto CH., – Gastric cancer « Bethesda Handbook of Clinical Oncology». 2001, p. 71.
17. Karpen M.S., Kelsen D.P.,Teppes J.A., et al. Cancer of the stomach in «Cancer Principles a Practice of Oncology», 6 ed. 2001, 1092–1126.
18. Cocconi G., Garlini P., Gamboni A. et. al. – Proc. ASCO 2001, ab. 501.
19. Proc. ASCO 2000, abs. 957, 1030, 1031, 1058, 1074, 1087, 1130, 1147, 1194,1280.
20. Proc. ASCO 2001, abs. 531, 647, 654, 655, 656, 657, 662, 2264, 2284, 2285, 2219, 2320.