Рибоксин при лечении желудка
ВЛИЯНИЕ РИБОКСИНА НА СЛИЗИСТУЮ ОБОЛОЧКУ ЖЕЛУДКА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХРОНИЧЕСКОМ АТРОФИЧЕСКОМ ГАСТРИТЕ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Жураковский И.П.
1
Сергеева Я.С.
1
Аутеншлюс А.И.
1
1 ГБОУ ВПО Новосибирский государственный медицинский университет Министерства здравоохранения Российской Федерации
Проведено морфологическое исследование желудка крыс-самцов Wistar после получения модели хронического атрофического гастрита с помощью введения 2 % раствора салицилата натрия в 30 % растворе спирта в течение 8 недель и содержания на альтернативном посту, а также введения раствора рибоксина в дозе 20 мг/кг. Показано, что введение рибоксина приводит к снижению выраженности воспалительного процесса (отсутствует слущивание эпителиальных клеток и расширение венозных сосудов, значительно уменьшается инфильтрация клеточными элементами собственной пластинки слизистой желудка); восстанавливается слизистая оболочка желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и восстановлением до исходного уровня количества клеток, секретирующих кислые муцины).
хронический атрофический гастрит
модель
рибоксин
морфология
1. Effects of He-Ne laser irradiation on chronic atrophic gastritis in rats / X.H. Shao [et al.] // World J. Gastroenterol. – 2005. – Vol. 25, № 11. – P.3958-3961.
2. Gallo Rolanía F.J. Ultrastructural study of the kidney subjected to warm ischemia and perfused with inosine / F.J. Gallo Rolanía, A.J. Álvarez-Morujo Suarez, F.P. Collía Fernandez // Arch. Esp. Urol. – 2013. – Vol. 66, № 10. – P.945-955.
3. Gastric cancer: prevention, screening and early diagnosis / V. Pasechnikov [et al.] // World J. Gastroenterol. – 2014. – Vol. 20. – P.13842–13862.
4. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading / M. Rugge [et al.] // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P.1249–1259.
5. Haskó G. Trends Immunomodulatory and neuroprotective effects of inosine / G. Haskó, Sitkovsky M.V., Szabó C. // Pharmacol. Sci. – 2004. – Vol. 25, № 3. – P.152-157.
6. Mucin histochemistry of stomach in metaplasia and adenocarcinoma: An observation / P.K. Mandal [et al.] // Indian J. Med. Paediatr. Oncol. – 2013. – Vol. 34, № 4. – P.229-233.
7. Non-invasive diagnosis of gastric mucosal atrophy in an asymptomatic population with high prevalence of gastric cancer / A. Rollan [et al.] // World J. Gastroenterol. – 2006. – Vol. 12. – P.71–72.
8. Serum gastrin 17, pepsinogen I and pepsinogen II in atrophic gastritis patients living in North-East of Iran / M. Hosseini [et al.] // J. Res. Med. Sci. – 2013. – Vol. 18. – P.225.
9. Siegel R. Cancer statistics 2013 / R. Siegel, D. Naishadham, A. Jemal // Cancer J. Clin. – 2013. – Vol. 6. – P.11–30.
Хронический атрофический гастрит (ХАГ), являющийся одним из наиболее распространенных заболеваний органов пищеварения, представляет собой хронический воспалительный процесс, характеризующийся потерей желудочных железистых структур, которые заменяются либо соединительной тканью, либо железистыми структурами, не свойственными для данной локализации [4].
В многочисленных исследованиях показано, что хронический атрофический гастрит является предраковым заболеванием [7;8] и что его лечение имеет важное значение для предотвращения желудочного канцерогенеза [3], приводящего к раку желудка, что является одной из основных причин смертности от онкологических заболеваний во всем мире [9].
Рибоксин (инозин) – относится к группе лекарственных средств, регулирующих метаболические процессы. Этот препарат является предшественником синтеза пуриновых нуклеотидов: аденозинтрифосфата и гуанозинтрифосфата, которые обеспечивают антигипоксический и цитопротекторный эффект [2], что послужило основанием для начала его применения в лечении хронического атрофического гастрита. Вместе с тем механизм влияния рибоксина на данный патологический процесс практически не изучен.
Целью настоящей работы являлось изучение влияния рибоксина на процессы, происходящие в слизистой оболочке желудка при экспериментальном хроническом атрофическом гастрите.
Материал и методы исследования
Эксперимент проведен на 24 половозрелых крысах-самцах Wistar с исходной массой 180–220 г. Для получения модели ХАГ 18-ти экспериментальным животным внутрижелудочно вводили 2 % раствор салицилата натрия в 30 % растворе спирта в течение 8 недель, кроме того, крысы содержались на альтернативном посту (сутки – пост, 2 дня – кормление) со свободным доступом к воде [1]. Экспериментальным животным группы «ХАГ2+Р» в течение третьего месяца внутрижелудочно вводили раствор рибоксина в дозе 20 мг/кг. В качестве контроля использовали интактных животных (группа «Инт»), а также животных, которых не подвергали никакому воздействию в течение 1 месяца после воспроизведения у них модели ХАГ (группа «ХАГ2+1»).
Желудки крыс фиксировали в 12 % формалине. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Морфология слизистой желудка оценивалась при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Общий муцин выявляли муцикармином с последующей докраской ядер гематоксилином Эрлиха. Кислые муцины выявляли альциановым синим при рН 1,0 с последующей докраской ядер кармалюмом Майера.
Анализ относительной площади, занимаемой железами желудка, а также клеточных элементов, относительной площади окрашивания общих и кислых муцинов проводился с помощью светооптического микроскопа и морфометрического комплекса на базе микроскопа Micros MC 300A, цифровой камеры CX 13c («Baumer Electric GmbH», Германия) и программного обеспечения ImageJ 1.42g (Национальный институт здоровья, США). Для каждой группы оценивалось по 48 изображений.
Статистическую обработку результатов исследования проводили с использованием программного пакета для статистической обработки SPSS v 13.0 for Windows. Для сравнения независимых групп использовали критерий Крускала – Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна – Уитни. Различия между значениями сравниваемых параметров расценивали как статистически значимые при р< 0,05. Полученные в ходе исследования данные представлены как медиана (Me) и интерквартильный размах (Q1; Q3).
Результаты исследования и обсуждение
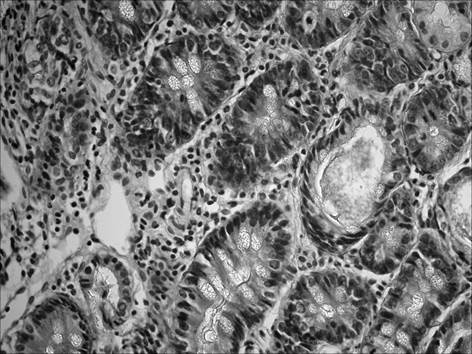
При морфологическом исследовании срезов желудка через 2 месяца после начала введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ 2») было отмечены признаки, характерные для хронического атрофического гастрита. Так, наблюдалось истончение слизистой оболочки желудка, уменьшение желез в размерах с увеличением расстояния между ними, развитие склеротических изменений (рис. 1), отмечалась инфильтрация слизистой желудка как нейтрофильно-лейкоцитарными, так и макрофагальными элементами (таблица 1). При этом выраженность инфильтрации возросла по сравнению с интактными животными в пилорическом отделе в 16,5 раза, в фундальном – в 6,7 раза. Соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2,7 : 1 : 1,3 : 0,3, в фундальном отделе – 2,5 : 1 : 1 : 0. Исследование срезов пилорического отдела желудка позволило выявить, дополнительно к описанным выше изменениям, наличие очагов кишечной метаплазии с бокаловидными клетками (рис. 2).
Найденные при морфологическом исследовании патологические изменения подобны изменениям, наблюдаемым при хроническом атрофическом гастрите у человека [4], что позволяет сделать заключение о правильности воспроизведения модели.
Таблица 1
Морфометрический анализ клеточных элементов инфильтратов слизистой оболочки желудка в % Me (Q1;Q3)
Показатель | Относительная площадь | |||||
Инфильтратов | Нейтрофилов | Лимфоцитов | Моноцитов | Плазматических клеток | ||
Пилорический отдел | инт | 0,77 (0,19;1,54) # | 0,00 (0,00;0,77) # | 0,00 (0,00;0,77) # | 0,00 (0,00;0,00) # | 0,00 (0,00;0,00) # |
ХАГ2 | 12,69 (10,77;15,19) *# | 6,15 (4,62;7,69) *# | 2,31 (1,54;3,08) *# | 3,08 (2,31;3,85) * | 0,77 (0,00;0,77) *# | |
ХАГ2+1 | 10,77 (10,00;13,08) * | 4,62 (3,85;6,15) * | 2,31 (1,54;2,31) * | 3,08 (2,31;3,85) * | 0,77 (0,77;1,54) * | |
ХАГ2+Р | 8,46 (6,92;9,81) *# | 4,62 (3,85;5,38) * | 1,54 (0,77;1,54) *# | 2,31 (1,54;2,31) *# | 0,00 (0,00;0,77) *# | |
Фундальный отдел | инт | 2,31 (1,54;3,08) # | 0,88 (0,77;1,54) # | 0,77 (0,19;1,54) # | 0,77 (0,00;0,77) # | 0,00 (0,00;0,00) # |
ХАГ2 | 15,38 (13,08;16,73) *# | 7,69 (6,15;8,46) *# | 3,08 (2,50;3,85) *# | 3,08 (2,31;3,85) * | 0,77 (0,77;1,54) *# | |
ХАГ2+1 | 12,31 (10,77;13,65) * | 5,38 (4,62;6,15) * | 3,08 (2,31;3,65) * | 3,08 (2,31;3,08) * | 0,77 (0,00;0,77) * | |
ХАГ2+Р | 9,23 (7,88;10,00) *# | 4,62 (3,85;5,38) *# | 1,54 (1,54;2,31) *# | 2,31 (1,54;3,08) *# | 0,77 (0,00;0,77) * | |
Примечание:
* – достоверные отличия по сравнению с группой Инт при p < 0,05;
# – достоверные отличия по сравнению с группой ХАГ2+1 при p < 0,05.
Отмеченное существенное увеличение общих муцинов, и в частности кислых их фракций, как в фундальном, так и пилорическом отделах желудка (таблица 2), что наблюдается при ХАГ [6] также может служить дополнительным признаком адекватности полученной модели.
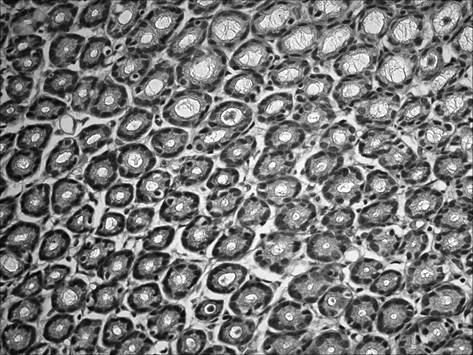
Рис. 1. Слизистая фундального отдела желудка через 2 мес. после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: развитие склеротических изменений. Окр. гематоксилином и эозином, ув. 400

Рис. 2. Слизистая пилорического отдела желудка через 2 мес. после начала введения салицилата натрия на фоне содержания животных на альтернативном посту: наличие очагов кишечной метаплазии с бокаловидными клетками. Окр. гематоксилином и эозином, ув. 400
Таблица 2
Относительная площадь желез, общих и кислых муцинов в % Me (Q1;Q3)
Показатель | Относительная площадь | |||
Желез | Общих муцинов | Кислых муцинов | ||
Пилорический отдел | инт | 70,0 (66,9;71,5)# | 7,5 (5,4;10,7)# | 4,1 (3,1;4,8)# |
ХАГ2 | 13,5 (10,8;16,2) *# | 58,7 (33,2;61,9) *# | 16,5 (13,0;21,1)*# | |
ХАГ2+1 | 31,5 (30,0;33,7) * | 20,4 (18,7;22,8) * | 9,7 (7,3;15,0) * | |
ХАГ2+Р | 47,3 (42,5;49,2) *# | 26,1 (23,0;27,9) *# | 5,0 (3,1;7,3) *# | |
Фундальный отдел | инт | 65,8 (62,3;71,3) *# | 20,7 (18,4;22,9) # | 3,5 (2,4;6,6) # |
ХАГ2 | 27,7 (24,6;35,2) *# | 61,0 (53,3;64,0) *# | 18,0 (14,3;21,1) *# | |
ХАГ2+1 | 43,8 (40,8;47,5) * | 25,0 (22,6;30,8) * | 11,5 (8,2;14,6) * | |
ХАГ2+Р | 50,0 (47,7;51,5) *# | 17,9 (15,2;20,1) *# | 4,1 (2,5;6,6) # | |
Примечание:
* – достоверные отличия по сравнению с группой Инт при p < 0,05;
# – достоверные отличия по сравнению с группой ХАГ2+1 при p < 0,05.
При морфологическом исследовании объектов как фундального, так и пилорического отделов желудка через 1 месяц после окончания введения салицилата натрия на фоне содержания животных на альтернативном посту (группа «ХАГ2+1»), по сравнению с группой «ХАГ2», отмечалось некоторое снижение активности хронического атрофического гастрита. Прежде всего, было отмечено отсутствие фокусов кишечной метаплазии в пилорическом отделе желудка. Кроме того, отмечалось частичное восстановление желез фундального и пилорического отделов желудка, заключающееся как в достоверном увеличении относительной площади самих желез, так и имеющей место тенденции к восстановлению популяций их клеточных элементов, что подтверждалось достоверным уменьшением относительной площади общего и кислых муцинов (таблица 2). Вместе с тем сохранялась признаки склеротических изменений. Выраженность инфильтрации собственной пластинки слизистой желудка, по сравнению с группой «ХАГ2», была достоверно ниже как в пилорическом, так и в фундальном отделах (таблица 1). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 2 : 1 : 1 : 0,33, а в фундальном — 1,75 : 1 : 1 : 0,25.
Данные результаты, вероятно, следует расценивать как подтверждение того, что исключение раздражающего этиологического фактора приводит к некоторому уменьшению воспалительного процесса в слизистой оболочке желудка, однако полного восстановления не происходит, что дает возможность использовать данную модель для изучения длительного приема препаратов.
В отличие от группы «ХАГ2+1», при применении рибоксина (группа «ХАГ 2+Р») отмечалось существенное уменьшение признаков хронического атрофического гастрита. Так, выраженность инфильтрации собственной пластинки слизистой желудка снизилась в пилорическом отделе в 1,5 раза, в фундальном в 1,3 раза (рис. 3). При этом соотношение клеточных элементов (нейтрофилы, лимфоциты, моноциты/макрофаги, плазматические клетки), образующих инфильтраты в пилорическом отделе, составило 3 : 1 : 1,5 : 0, в фундальном отделе – 3 : 1 : 1,5 : 0,5.
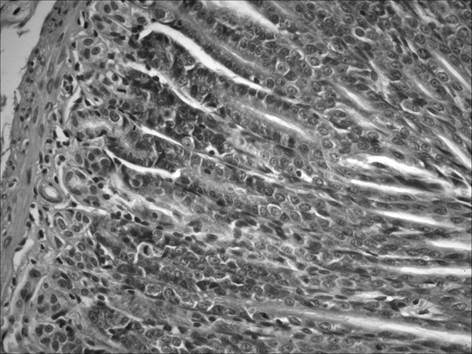
Рис. 3. Слизистая фундального отдела желудка через 1 месяц после окончания введения рибоксина: снижение инфильтрации собственной пластинки нейтрофильно-лейкоцитарными и макрофагальными элементами. Окр. гематоксилином и эозином, ув. 400
Не исключено, что данный эффект рибоксина может быть связан с его способностью влиять на продукцию провоспалительных цитокинов [5]. Кроме того, отмечалось более выраженное, по сравнению с группой «ХАГ2+1», восстановление слизистой оболочки желудка (таблица 2). При применении рибоксина в пилорическом отделе желудка отмечалось достоверное увеличение секреции общего муцина на фоне уменьшения его кислых фракций, а также уменьшение как общего, так и кислых муцинов в фундальном отделе (рис. 4).
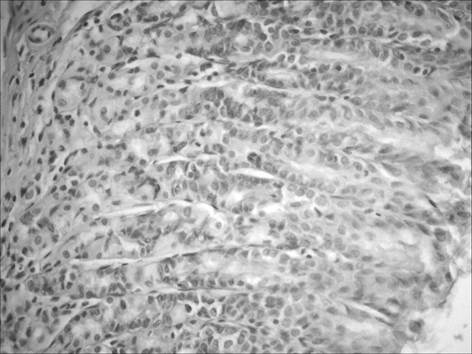
Рис. 4. Слизистая фундального отдела желудка через 1 месяц после окончания введения рибоксина: уменьшение мукоцитов, секретирующих кислый муцин. Окр. альциановым синим при рН=1,0 с последующей докраской ядер кармалюмом Майера, ув. 400
Заключение
Результаты проведенного исследования показали, что применение рибоксина приводит к уменьшению признаков хронического атрофического гастрита, а именно – к снижению выраженности воспалительного компонента ХАГ (отсутствует слущивание эпителиальных клеток и расширение венозных сосудов, значительно уменьшается инфильтрация клеточными элементами собственной пластинки слизистой желудка, преимущественно за счет уменьшения количества лимфоцитов и моноцитов/макрофагов); восстанавливается слизистая оболочка желудка (наблюдается увеличение размеров желез и уменьшение расстояния между ними, снижение выраженности признаков склеротических изменений, приобретение эпителием желез более высокоспециализированного строения, обусловленного восстановлением пула клеток, вырабатывающих желудочный сок и соляную кислоту, и восстановлением до исходного уровня количества клеток, секретирующих кислые муцины).
Библиографическая ссылка
Жураковский И.П., Сергеева Я.С., Аутеншлюс А.И. ВЛИЯНИЕ РИБОКСИНА НА СЛИЗИСТУЮ ОБОЛОЧКУ ЖЕЛУДКА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХРОНИЧЕСКОМ АТРОФИЧЕСКОМ ГАСТРИТЕ // Современные проблемы науки и образования. – 2016. – № 4.;
URL: https://science-education.ru/ru/article/view?id=24941 (дата обращения: 31.01.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Рибоксин – лекарство, которое зарядит клетки энергией
Рибоксин – это лекарственный препарат, активно воздействующий на обмен веществ в клетках различных органов. Особую чувствительность проявляют к нему клетки сердечной мышцы, печени и желудочно-кишечного тракта. Применяется в составе комплексного лечения многих заболеваний.
Как действует рибоксинРибоксин (активное действующее вещество – инозин) является нуклеизидом – веществом, которое входит в состав клеток человека. Поэтому, поступая в организм в виде лекарственного препарата, он очень быстро попадает в клетки и активизирует там обменные процессы. Он является предшественником аденозинтрифосфата (АТФ) – вещества, от которого легко отделяется энергия, поэтому заряжает этой энергией клетку. Кроме того, он легко превращается в нуклеотиды, из которых в клетках строятся нуклеиновые кислоты.
Рибоксин оказывает антигипоксическое действие, то есть повышает переносимость различными тканями недостатка кислорода.
Он активно воздействует на все обменные процессы в клетке (метаболическое действие), улучшает коронарное кровообращение и восстанавливает нормальный сердечный ритм. При травматическом поражении почек (например, при операции на почках) он предупреждает развитие необратимых изменений к ткани почек на фоне нарушения кровообращения.Положительно воздействует рибоксин также на клетки печени и желудочно-кишечного тракта, предупреждая их разрушение или восстанавливая после различных поражений. Применяется рибоксин также при глаукоме, некоторых видах порфирии (тяжелых врожденных нарушениях обмена веществ) и некоторых других заболеваниях.
Рибоксин и сердечно-сосудистые заболевания
В основе многих сердечно-сосудистых заболеваний лежит нарушение функции сердечной мышцы – миокарда. Это может быть нарушение его сократительной способности или нарушение проведения электрических импульсов, которые задают ритм сердцу. В любом случае такие изменен я возникают при нарушении обменных процессов в клетках миокарда. Сердцу недостает энергии для правильной работы. Поступление в клетки миокарда рибоксина, который способен значительно повысить их энергетический потенциал, способно активизировать все виды обмена веществ, а значит и работу органа в целом.
Рибоксин применяют при самых разных сердечных заболеваниях, но особое значение он приобрел при ишемической болезни сердца – ИБС.
Это заболевание развивается на фоне атеросклероза, когда атеросклеротические бляшки покрывают стенки коронарных (несущих кровь к сердечной мышце) сосудов и значительно суживают их просвет. Малейший спазм измененных коронарных артерий перекрывает поступление к миокарду крови, которая несет с собой питательные вещества и кислород. А клетки такого постоянно работающего органа, как миокард, не могут существовать без постоянного притока крови, они погибают, что и возникает при инфаркте миокарда.При поступлении в организм рибоксина он устремляется к наиболее чувствительным к нему органам, в первую очередь к миокарду. Активизируя обмен веществ в клетках, он повышает их способность переносить недостаток кислорода. Кроме того, под действием рибоксина улучшается коронарное кровообращение. Все вместе это предупреждает необратимые изменения в клетках сердечной мышцы при нарушении ее кровоснабжения, то есть инфаркт миокарда.
А если инфаркт миокарда (то есть омертвение какой-то группы клеток) уже произошел, то рибоксин способствует быстрому восстановлению функции сердца и сокращает реабилитационный период.
Широко применяют рибоксин и при других заболеваниях сердца, особенно, если они связаны с работой сердечной мышцы. Например, его применяют при миокардитах и миокардиодистрофиях – воспалительных и обменных нарушениях в сердечной мышце. Нарушения сердечного ритма также могут уменьшаться на фоне применения рибоксина.
Рибоксин при заболеваниях других органов
Рибоксин часто применяют при самых разных острых и хронических заболеваниях печени, так как он способен повышать энергетический потенциал гепатоцитов (клеток печени) и восстанавливать их правильное функционирование. Поэтому рибоксин назначают при острых и хронических гепатитах, циррозах печени, различных видах алкогольного поражения печени, в том числе жировой дистрофии печени и так далее.
При язвенной болезни желудка и двенадцатиперстной кишки рибоксин назначают в составе противорецидивного лечения. Восстанавливая нормальное состояние клеток стенки желудка, этот препарат повышает их устойчивость перед факторами, провоцирующими обострение. Если обострение уже началось, то применение рибоксина способствует быстрому рубцеванию язвы.
Применяют рибоксин и при других заболеваниях, если клетки того или иного органа нуждаются в «подпитке» энергией. Рибоксин – это нетоксичный препарат, который может улучшить состояние больных.
Галина Романенко



