Ранний рак желудка эндоскопическая диагностика

УДК 616 – 072.1
Корсун Е.Н., 2011
Поступила 09.06.2011 г.
Е.Н. КОРСУН
ЭНДОСКОПИЧЕСКАЯ ДИАГНОСТИКА РАННЕГО РАКА ЖЕЛУДКА
ПРИ СКРИНИНГЕ ТРАВМАТОЛОГИЧЕСКИХ БОЛЬНЫХ
Федеральный центр травматологии, ортопедии и эндопротезирования
министерства здравоохранения и социального развития, Чебоксары
Применение современного эндоскопического оборудования значительно повышает эффективность выявления опухолевой и предопухолевой патологии желудка при скрининговом обследовании травматологических больных. Своевременная диагностика данной патологии позволяет начать лечение пациентов на более ранних стадиях заболевания.
Ключевые слова: рак желудка, эндоскопическое исследование, скрининговый осмотр.
Рак желудка по заболеваемости и смертности занимает одно из первых мест среди всех злокачественных новообразований человека. Ежегодно в мире регистрируется 798 тыс. новых случаев (9,9%) заболевания и 628 тыс. смертей (12,1%) от рака желудка. Однако его распространенность в различных странах неравномерна. Так, наиболее высокая заболеваемость (114,7) зарегистрирована у мужчин Японии, а наименьшая (3,1) – у белых женщин США [1]. В России рак желудка является второй по частоте злокачественной опухолью. В структуре общей заболеваемости злокачественными новообразованиями в Чувашской Республике новообразования желудка в 2010 г. заняли 3-е место (22,4 на 100000 населения).
В России от 60 до 90% больных с впервые выявленным раком желудка имеют III-IV стадии, что определяет соответствующий прогноз. По мнению Е.М. Аксель, это обусловлено трудностями организации профилактических осмотров, слабой онкологической настороженностью врачей общей лечебной сети, недостаточным обеспечением современной диагностической аппаратурой [2].
Ранний рак желудка выделяется онкологами в отдельную категорию, потому что результаты его лечения значительно эффективнее, чем при более распространенных формах, и в отношении него могут быть применены органосберегающие технологии лечения. Так, показатель пятилетней выживаемости после операции по поводу раннего рака желудка составляет 80-100%, десятилетней — 75%, а у радикально оперированных в более поздних стадиях – в среднем 40% [7, 9, 11-13].
Впервые понятие раннего рака желудка было введено в практику Японским исследовательским обществом по раку желудка в 1963 г. К нему отнесли те формы, когда опухоль ограничена слизистой оболочкой и подслизистым слоем независимо от наличия или отсутствия метастазов в регионарные лимфоузлы [3, 5, 8, 10]. Другие авторы под ранним раком подразумевают опухоль, ограниченную пределами слизистой желудка без прорастания в подслизистый слой и без регионарных метастазов [7, 9]. Большинство же исследователей ранним раком желудка считают первичную опухоль в пределах слизистого и подслизистого слоев (Т1 или Т2a/b при N 0) до 2 см в диаметре, без метастазов.
В Японии среди всех оперированных больных раком желудка пациенты с ранним раком составляют 50-55%. Это объясняется тем, что категории населения, предрасположенные к раку желудка, проходят там регулярное обследование. В Европе и США частота обнаружения ранних форм рака желудка не превышает 15% [12]. В России этот показатель находится в пределах 10-20% от общего числа заболевших [9]. По другим данным, даже в специализированных хирургических и онкологических учреждениях своевременная диагностика рака желудка (I и II стадии) составляет не более 20-25%, а ранняя форма рака выявляется только в 5-10% случаев. Частота выявления раннего рака желудка наиболее высока у пациентов в возрасте 50-69 лет. Организация скринингового обследования всего населения пока невозможна ввиду чрезвычайно высокой его стоимости, к тому же из общей массы обследованных лишь у 0,15- 0,2% удается выявить рак желудка [6].
Клиническая дифференциальная диагностика отличается низкой чувствительностью и специфичностью. Симптомы опухоли проявляются, как правило, слишком поздно. Поэтому ориентация в диагностике на клинические проявления рака желудка (по принципу обращаемости) неизбежно приводит к тому, что в подавляющем большинстве выявляют распространенные формы заболевания, уже мало зависящие от мастерства эндоскописта. Лабораторные методы (исследование желудочной секреции, кала на скрытую кровь, выявление анемии) малоинформативны при ранней форме рака желудка, а обнаруживаемые изменения также не являются специфическими. Рентгенологическое исследование позволяет заподозрить рак желудка в ранней стадии примерно у 40% больных.
Использование волоконного эндоскопического оборудования подняло диагностику рака желудка на новый уровень, но даже и эндоскопическая диагностика раннего рака желудка является непростой задачей. Так, в 18% наблюдений с помощью одной эндоскопии был уверенно диагностирован ранний рак, в 58,8% злокачественная опухоль заподозрена и в 25,5% макроскопическая картина была скорее характерна для доброкачественного процесса. Все потому, что рак желудка длительное время имеет микроскопические размеры, ничем визуально не отличается от здоровых тканей. Время удвоения размеров раннего рака составляет 2-10 лет, а распространенных форм — 2-12 мес.
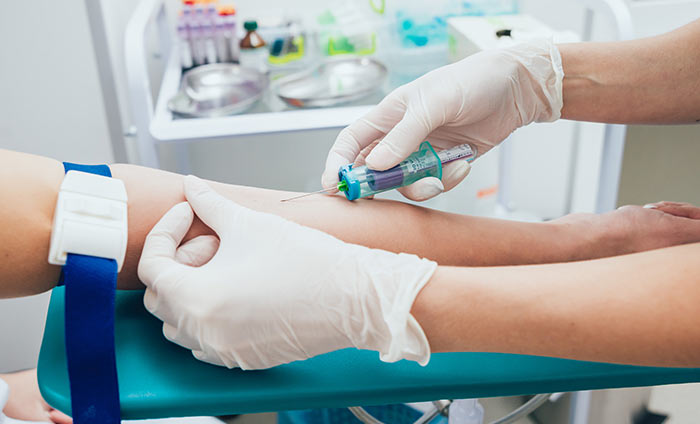
Таким образом, использование современной фиброволоконной оптики является «золотым стандартом» в диагностике опухолевой и предопухолевой патологии желудка. Этот метод вошел в отечественную клиническую практику с 70-х г. прошлого столетия и на сегодняшний день является важнейшим компонентом организации деятельности любого современного ЛПУ (рис. 1).

Рис. 1. Проведение эзофагогастродуоденоскопии на видеоэндоскопической стойке
«EVIS EXERA II»
Кабинет эндоскопии входит в состав консультативной поликлиники ФГУ «Федеральный центр травматологии, ортопедии и эндопротезирования Министерства здравоохранения и социального развития» («ФЦТОЭ») и оснащен видеоэндоскопами с видеосистемой «EVIS EXERA II» японской фирмы «Olympus» (рис. 1). Цифровые видеосистемы значительно расширяют возможности диагностических и лечебных процедур. Примененная в них передача видеосигнала высокой четкости HDTV, встроенная система электронного увеличения изображения, функция структурной детализации многократно повышают информативность изображения, обеспечивая высокую достоверность диагностики. И, наконец, специальные светофильтры данной эндоскопической системы позволяют проводить осмотр в режиме NBI (narrow band imaging), т.е. в узком спектре световой волны 415 нм, проникающей в слизистый и подслизистый слои стенки исследуемого органа и избирательно поглощаемой гемоглобином [4]. Данная система повышает контрастность изображения, создавая эффект «виртуальной хромоскопии», что позволяет выявлять очаги метапластических, диспластических изменений слизистой и ранние формы рака. Данные функции эндоскопической системы определяют наиболее точную зону биопсии и объективизируют постановку диагноза (рис. 2).

Рис. 2. Очаги кишечной метаплазии в верхней трети тела желудка
(эндоскопия в белом свете и в режиме NBI)
Эндоскопические исследования входят в обязательный перечень обследований ортопедических больных, готовящихся к оперативному лечению. Это связано с увеличением объема и сложности хирургических вмешательств, с расширением показаний к оперативному лечению больных с тяжелой сопутствующей патологией, с длительным приемом ими нестероидных противовоспалительных препаратов, антикоагулянтов, а также с высокой долей эрозивно-язвенных поражений в общей структуре заболеваемости.
С момента начала работы консультативной поликлиники ФГУ «ФЦТОЭ» по март 2011 г. в кабинете эндоскопии пациентам было проведено 2274 эндоскопических исследования, из них: 2101 эзофагогастродуоденоскопия (92,4%), 60 колоноскопий (2,6%) и 113 фибробронхоскопий (5%). На догоспитальном этапе осмотрено 1325 пациентов (58%), в условиях стационара – 949 (42%). Возраст больных колебался от 10 до 93 лет, средний возраст составил 57,5 года. Мужчин — 35,4%, женщин — 64,6%. При этом при ФГДС в 9,9% (207 случаев) отмечена нормальная эндоскопическая картина, в 36% (759) выявлены эрозивно-язвенные изменения пищевода, желудка или луковицы двенадцатиперстной кишки, в 29% (613) хронический атрофический и неатрофический гастриты, в 4% (86) — полипы пищевода, желудка или двенадцатиперстной кишки, в 0,9% (21) — неэпителиальные опухоли, в 0,4% (8) — рак желудка, 20% больным эндоскопическое обследование было выполнено впервые в жизни.
Несмотря на то, что пациенты, направленные в наш Центр для оказания высокотехнологичной медицинской помощи, были осмотрены предварительно основными специалистами по месту жительства и имели на руках значительный перечень проведенных анализов и исследований, тем не менее, обращают на себя внимание случаи выявления среди них злокачественных новообразований (рис. 3).

Рис. 3. Инвазивный рак тела желудка. T3N0M0
Возраст пациентов с выявленным и подтвержденным раком желудка находился в пределах от 53 до 72 лет, средний возраст составил 65 лет. Мужчин было — 5, женщин — 3. У одной пациентки опухоль локализовалась в верхней трети тела желудка, в других — в его дистальных отделах. Аденокарцинома умеренной степени дифференцировки преобладала над низкодифференцированными видами опухолей. В одном случае у пациента из Нижегородской области с распространенной распадающейся опухолью пилородуоденальной зоны не удалость верифицировать процесс ввиду недостаточной подготовки к исследованию. Однако известно, что впоследствии он перенес эксплоративную операцию на желудке по месту жительства.
Следует отметить, что «желудочные» жалобы отсутствовали у 5 пациентов, у остальных жалобы не были специфичными (отрыжка, тяжесть в эпигастрии, суставной синдром, слабость). Важно, что в 5 случаях выявленного рака фиброгастроскопия была первой в жизни. Размер и форма коррелировали со стадией процесса. У половины пациентов с выявленным раком желудка (4 случая) размеры опухоли не превышали 2 см и у троих из них послеоперационный материал соответствовал так называемому раннему раку (рис. 4). В трех случаях размер опухоли находился в пределах 2-4 см и у одного пациента — более 4 см.

Рис. 4. Ранний рак антрального отдела желудка. T1N0M0
Группировка по стадиям имеет следующий вид: I — 3 случая, II — 3, III — 1, IV — 1. Таким образом, своевременная диагностика рака желудка (I и II стадия) составила 6 случаев из 8.
Среди выявленных макроскопических типов раннего рака желудка встретились: I тип (возвышающийся), IIb тип (поверхностный плоский) и IIc тип (поверхностный углубленный).
Таким образом, в условиях активного использования эндоскопических методов исследования выявляемость рака желудка составила 0,4% от общего количества обследованных, увеличив относительное число пациентов с начальной стадией развития заболевания. Полученные результаты подтверждают высокую эффективность выявления онкопатологии при скрининговом осмотре ортопедических пациентов. По нашему мнению, это связано с оснащенностью кабинета эндоскопии современнейшим эндоскопическим оборудованием, онкологической настороженностью персонала и преимущественно пожилым контингентом наших пациентов.
СПИСОК ЛИТЕРАТУРЫ
Аксель Е.М. Статистика рака легкого, желудка и пищевода: состояние онкологической помощи, заболеваемость и смертность / Е.М. Аксель, М.И. Давыдов, Т.И. Ушакова // Вестн. РАМН 2001. — № 9. – С. 61 — 65.
Аксель Е.М. Злокачественные новообразования желудочно-кишечного тракта: основные статистические показатели и тенденции / Е.М. Аксель, М.И. Давыдов, Т.И. Ушакова // Современная онкология. М., 2001. — Т. 3. — № 4. — С. 141 — 145.
Арутюнян В.А. Расширенная лимфаденэктомия в объеме D2, D3 в хирургическом лечении рака желудка I-II стадий: дис. … канд. мед. наук / В.А. Арутюнян. – М.-Красноярск, 2000. -24с.
Креймер В.Д. Атлас цифровой гастроинтестинальной эндоскопии. / В.Д. Креймер, В.П. Тюрин, Е.А. – М.: Коган Бином, 2011. С. 8 — 9.
Кузьмин-Крутецкий М.И. Возможности эндоскопии в лечении малигнизированнных полипов и поверхностных типов раннего рака желудка и толстой кишки / М.И. Кузьмин-Крутецкий // Новые технологии в неотложной хирургии и гинекологии. – СПб., 1999. – С. 114 — 121.
Мерабишвили В.М. Рак желудка: эпидемиология, профилактика, оценка эффективности лечения на популяционном уровне / В.М. Мерабишвили // Практ. онкология. – 2001. — № 7 (3). – С. 3 — 8.
Одинцов С.В. Сравнительные результаты оказания онкологической помощи больным раком желудка за два пятилетия (1988-1992 и 1993-1997 гг.). / С.В. Одинцов, В.М. Лукьянов, А.П. Николаев // Кремлевская медицина: клин. вестн. – 1999. — № 1. – С. 19 — 22.
Поддубный Б.К. Современное состояние эндоскопической диагностики и лечения ранних форм рака пищевода и желудка / Б.К. Поддубный [и др.] // Современная онкология. — 2000. – Т. 2. — № 3. – С. 68 — 72.
Симонов Н.Н. Проблемы диагностики и рационального лечения раннего рака желудка (Tis N0M0 и T1N0Mo) / Н.Н. Симонов [и др.] // Практическая онкология. – 2001. – Т. 3. — № 7. – С. 25 — 29.
Черноусов А.Ф. Расширенная лимфаденэктомия при раке желудка / А.Ф. Черноусов, С.А. Поликарпов // Анналы хирургии. – 1996. – № 1. — С. 20 — 27
Чиссов В.И. Состояние онкологической помощи населению России в 2005 году (заболеваемость и смертность) / В.И. Чиссов, В.В. Старинский, Г.В. Петрова. — М., 2006. – С. 246.
Nogueira C. Early Gastric Cancer: Ten years of Experience / C. Nogueira [et al.] // Wоrld J Surg. – 2002. – Vol. 26. — № 3. — Р. 330 — 334.
Ocamura T. Lymphadenectomy for cure in patients with early gastric cancer and lymph node metastasis / T. Ocamura [et al.] // Am J Surg. – 1998. — Vol. 155. – Р. 476 — 480.
СВЕДЕНИЯ ОБ АВТОРАХ:
Корсун Елена Николаевна
врач-эндоскопист, ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования»
Адрес для переписки:
428000, Чувашская Репсублика, г. Чебоксары, Ф. Гладкова, 33
Тел. +7 (8352) 30-58-05
E-mail: korsun@orthoscheb.com
E.N. KORSUN
ENDOSCOPIC DIAGNOSTICS OF EARLY GASTRIC CANCER
IN TRAUMA PATIENTS’ SCREENING
The federal centre of traumatology, orthopaedics and endoprosthesis replacement of Healthcare
and Social Development Ministry, Cheboksary
Use of modern endoscopic equipment significantly increases efficiency of tumorous and pretumor gastric pathology in screening of trauma patients. Timely diagnosis of this pathology let start patients’ therapy at the early stages of the disease.
Key words: stomach cancer, endoscopic examination, screening
© Все права защищены. Использование материалов без письменного согласия — запрещено.


Тип I
Выступающий тип

Тип II
Поверхностный тип

А. Поверхностный
приподнятый


В. Поверхностный
плоский




С. Поверхностный
углубленный

Тип III
Подрытый









Эндоскопическая
дифференциальная диагностика.
Трудности возникают при дифференциальной
диагностике ранних форм РЖ и
доброкачественных новообразований –
полипов.
Внешне они очень похожи и определить
характер полипоидного образования без
гистологического исследования невозможно.
Но дело в том, что биопсия, выплненная
с поверхности полипа не отражает
изменений в его теле и основании. Поэтому
все полипоидные (полиповидные) образования
подлежат удалению с помощью
электрокоагуляционной петли и тока
высокой частоты и тотальному
морфологическому изучению. При
множественных полипах электроэксцизию
начинают с наиболее крупных, в которых
вероятность развития рака максимальна.
Ещё сложнее
дифференциальная диагностика изъязвленного
рака и язвы
желудка.
Сказать «на глаз» в каком участке стенки
язвы могут быть злокачественные клетки
практически невозможно. Поэтому
рекомендуют выполнять множественные
биопсии из разных участков по краю язвы
(биопсия в области дна язвы малоинформативна
из-за наличия некротического детрита
и опасна из-за возможности кровотечения).
Таких биопсий нужно выполнить не менее
пяти. Только тогда можно быть более или
менее уверенным в доброкачественности
изязвления. Существует четкая
закономерность: чем выше по желудку
находится язва, тем больше вероятность
её злокачественного характера. Даже
рубец на месте зажившей язвы желудка
не исключает наличия рака и требует
обязательной биопсии, ибо первично
изъязвленные раки могут рубцеваться
под влиянием противоязвенной терапии.
Весьма непросто
отличить диффузно растущий рак антрального
отдела от т.н. ригидного
антрального гастрита.
В обоих случаях обращает на себя внимание
отсутствие перистальтики в антральном
отделе желудка, изменение его складчатости,
инфильтративное утолщение слизистой.
Решают вопрос повторные биопсии,
выполненные ступенчатым образом (каждая
последующая биопсия выполняется в месте
предыдущей, углубляясь в толщу стенки
желудка). Такие биопсии позволяют
верифицировать рак даже в случае его
подслизистого роста.
Дополнительные
методы исследования.
После установления диагноза РЖ необходимо
определить его операбельность. Истинные
границы опухоли и распространение рака
по лимфатической системе не всегда
возможно уточнить не только в
предоперационном периоде, но даже во
время операции. Ответ на этот вопрос
может дать только морфолог, производящий
исследование резецированного желудка,
удаленных вместе с ним тканей и
регионарных лимфатических узлов. Однако
и до операции можно выявить признаки
неоперабельности. При общеклиническом
обследовании
можно выявить отдаленные метастазы
(метастаз Вирхова, метастаз в область
пупка, метастаз Шницлера, метастаз
Крукенберга у женщин, увеличенную печень
с плотным бугристым краем, асцит,
плевральный выпот. Признаки метастазов
в печень и поджелудочную железу помогает
выявить ультразвуковое
сканирование и КТ,
а для определения перехода РЖ на соседние
органы и распространение его по брюшине
можно перед операцей выполнить
диагностическую
лапароскопию.
Лечение РЖ.
В настоящее время основным методом
лечения РЖ, как раннего, так и далеко
зашедшего, является хирургическая
операция.
Первым успешную
резекцию желудка по поводу рака выполнил
профессор хирургической клиники в Вене
Теодор Бильрот в 1881 году (рис 18). С этой
даты началось быстрое развитие желудочной
хирургии. Бильрот предложил два способа
резекции желудка: наложение анастомоза
между остающимися отделами конец-в-конец
(Бильрот I)
и ушивание культей желудка и
двенадцатиперстной кишки с наложением
анастомоза между желудком и начальной
петлей тощей кишки бок-в-бок (Бильрот
II).
Дальнейшие модификации этих операций
связаны с именами таких известных
хирургов первой половины 20 века, как
Кохер, Гофмейстер, Финстерер, Ру, Хаберер
и др.
Вопрос об объеме
операции при РЖ до настоящего времени
однозначно не решен (рис 19). По мнению
одних хирургов, методом выбора является
субтотальная резекция желудка с
обязательным удалением регионарных
лимфатических узлов единым блоком.
Другие считают возможным выполнение
экономных резекций, но с лимфоаденодиссекцией
в максимальном объеме, третьи допускают
возможность обширных комбинированных
операций с удалением соседних с желудком
органов при распространении на них
рака. Трудность в выработке рациональной
хирургической тактики у каждого
конкретного больного заключаются в
том, что до настоящего времени нет
точного метода интраоперационного
определения распространенности опухоли
как по желудку, так и по лимфатическим
путям. Экспресс-методы исследования
биоптатов, взятых во время операции, не
всегда точны и значительно увеличивают
продолжительность операции. Размеры
опухоли не могут считаться критерием,
так как даже при малых раках встречаются
не только регионарные, но и отдалённые
метастазы.
Наиболее часто
выполняемыми при РЖ радикальными
операциями являются: 1) Дистальная
субтотальная резекция желудка
– удаление большей части желудка с
большим и малым сальником и оставлением
кардиальной части и купола с небольшим
участком большой кривизны (при раке
выходного отдела желудка); анастомоз
между культей желудка и двенадцатиперстной
кишкой;
2) Проксимальная
субтотальная резекция желудка
– то же, но с оставлением части
пилорического отдела (при раке
проксимальной части желудка); анастомоз
между пищеводом и культей желудка);
3) Тотальная
гастрэктомия
– удаление всего желудка с большим и
малым сальником, желудочными связками
и прилегающими к желудку участками
двенадцатиперстной кишки и пищевода,
(при поражении большей части желудка и
высокой локализации рака, а так же при
диффузном росте раковых опухолей);
эзофагоеюноанастомоз.
При любой из
этих операций с онкологической точки
зрения целесообразно выполнение
лимфоаденодиссекции
– максимально
возможное удаление регионарных
лимфатических узлов по ходу левой
желудочной, селезёночной, кишечной
(a.celiaca)
и общей печёночной артерий
Объем операции
при ранних РЖ определяется в зависимости
от локализации опухоли и опыта хирурга.
Противопоказаниями
к радикальной операции при РЖ по мнению
большинства хирургов и онкологов,
являются: чрезмерное распространение
опухоли за пределами желудка (переход
на поджелудочную железу, печень,
забрюшинную клетчатку), метастазы в
отдаленные органы, диссеминация рака
по брюшине или тяжелое состояние
больного, вызванное серьёзными
сопутствующими заболеваниями или
преклонным возрастом. В этих случаях
возможно выполнение той или иной
паллиативной операции, направленной
на сохранение нарушенного пассажа пищи
по пораженному желудку или предупреждении
осложнений: кровотечения, перфорации,
непроходимости.
Самым частым
паллиативным вмешательством является
гастроэнтеростомия,
предпринимаемая для ликвидации или
предупреждения непроходимости выходного
отдела желудка. При сужении или закрытии
входа в желудок накладывают
эзофагогастростомию
или вводят трубку для питания
непосредственно в желудок через
гастростому.
При тотальном поражении желудка
приходится прибегать к еюностомии.
При кровотечении из распадающейся
опухоли или опастности перфорации
возможно выполнение паллиативной
резекции желудка.
В послеоперационном
периоде у больных РЖ возможно проведение
химиотерапии
современными противоопухолевыми
препаратами, что наиболее показано при
низкодифференцированных опухолях.
Отдаленные
результаты хирургического лечения.
По данным
G.Davis
(1983), подвергшего анализу результаты
нескольких крупных серий наблюдений
в США, хирургическое вмешательство
выполняется у 86 из каждых 100 человек с
диагностированным РЖ (рис 20). Из них у
41 пациента операция оказывается
паллиативной или носит диагностический
характер. 10 человек из этой группы
погибают в послеоперационном периоде
от различных осложнений. Из 31 больного,
перенесшего вмешательство, через 5 лет
в живых не остается никого. У 45 из 86
оперированных больных (чуть больше
половины) удается выполнить радикальную
операцию. Из них 5 человек погибают от
послеоперационных осложнений. Из 40
пациентов, перенесших операцию, спустя
пять лет продолжают жить 10 человек.
Таким образом, 5-летняя выживаемость
при хирургическом лечении РЖ составляет
лишь 10%.
А каковы результаты
хирургического лечения раннего РЖ? В
1976 году Т.Takasugi
с оавт. были опубликованы результаты
хирургического лечения 732 больных с
гистологически доказанным ранним раком
желудка (рис 21). В течение 5 лет после
операции прожили 715 человек (97,7%), а
спустя 10 и 15 лет — 705 человек (96.4%). Несколько
менее впечатляющими, но всё же очень
высокими являются результаты другой
серии наблюдений японских авторов
(T.Iwanaga
et
al.,1979):
из 510 оперированных больных ранним РЖ
5-летний барьер выживаемости преодолели
457 человек (89,6%), а 10-летний – 370 больных
(72,6%).
Таким образом,
раннее выявление опухоли служит ключом
к улучшению результатов лечения РЖ.
Методы раннего
выявления РЖ.
Опыт последних десятилетий показывает,
что наиболее эффективным средством
диагностики РЖ на начальных стадиях
является выявление среди условно
здорового населения «групп риска» по
РЖ (путём анкетирования и опроса) и
обследование их с помощью современных
рентгенологических и эндоскопических
методов, а так же активное выявление,
обследование и лечение больных
предраковыми заболеваниями желудка
(рис 22). Существенную помощь в раннем
выявлении онкологических заболеваний
могли бы оказать т.н. скрининговые методы
исследования (screening
– просеивание, отсев, отбор), которые
можно выполнять массово, среди широких
контингентов населения или в больших
по объему группах риска. В настоящее
время к скрининговым методикам по РЖ
можно отнести только крупнокадровую
флюорографию желудка, да и то лишь
условно, в связи с высокой её стоимостью.
В последние
десятилетия активно ведутся поиски
специфических раковых маркеров. Маркеры
– гликопротеиды с антигенными свойствами
часто обнаруживаются в тканях и жидкостях
плодов, но потом они исчезают и появляются
лишь при развитии опухолевых процессов.
Они являются признаком дедифференциации
тканей с возвратом к эмбриональному
состоянию, что особенно характерно при
низкодифференцированных опухолях.
Онкофетальные антигены могут служить
признаком появления злокачественной
опухоли и ранних предраковых изменений.
К ним относится
карциноэмбриональный
антиген (КЭА).
Его обнаруживают в крови у 4-5% и в
желудочном соке у 50% больных ранним
раком желудка. Однако его нельзя считать
строго специфическим для РЖ, т.к. он
определяется и у больных раком толстой
кишки. Для массового скрининга используют
фетальный
сульфогликопротеиновый антиген (ФСА).
При РЖ его обнаруживают в 90-95% наблюдений.
При обследовании группы в 30.000 человек
в США у 22 из 23 с положительным ФСА в
содержимом желудка был обнаружен рак,
а у 8 с отрицательной реакцией в дальнейшем
так же была выявлена карцинома желудка.
Чувствительность метода составила 92%,
а специфичность – 73%. Трудности скрининга
заключались в необходимости получения
у обследуемых порции желудочного сока,
для чего требовалось зондирование
желудка.
К сожалению в
нашей стране широкомасштабные
профилактические обследования на
предмет выявления раннего рака в
настоящее время вряд ли возможны из-за
определенных социальных и экономических
причин.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #