Рак желудка по мельникову

Рак желудка
В структуре общей заболеваемости и смертности занимает 3 место.
Средний возраст пациентов с раком желудка 68 лет (более 30% старше 70 лет)
До 80% пациентов в странах Европы диагностируются в IV стадии заболевания (цифры сильно варьируются в зависимости от страны). У половины пациентов после радикальной операции развивается прогрессирование.
Факторы риска:
— Избыточное употребление поваренной соли (более 16 гр. в сутки) и нитратов признано одним из ведущих факторов риска развития рака желудка
— Курение
— Злоупотребление алкоголем
— Хронический атрофический гастрит с кишечной метаплазией – наиболее частое предраковое заболевание желудка
— Инфекция НР как ведущая причина хронического гастрита (6 раз, при cogA антигенах — до 28 раз)
— Наличие аденоматозных полипов более 2 см (гиперпластические полипы малигнизируются крайне редко)
— Пищевод Баррета
— Операции на желудке в анамнезе — более 10-15 лет назад, осложненные нарушением координации сокращений пищеварительной трубки — дуодено-гастральным рефлюксом
Клиника:
До 80% больных ранним раком не предъявляют жалоб. Нередко обращение к врачу обусловлено фоновой и сопутствующей патологией.
Выраженные симптомы заболевания обычно свидетельствуют о местно-распространённом или метастатическом процессе.
Наиболее характерны следующие жалобы: дискомфорт или боль в эпигастральной области, четко не связанные с приемом пищи, тошнота и рвота, рвота кофейной гущей при желудочном кровотечении, снижение аппетита, снижение массы тела, прогрессирующая дисфагия (для рака кардиального отдела желудка и кардиоэзофагеального перехода), быстрое насыщение и чувство переполнения желудка (может свидетельствовать о диффузной инфильтративной опухоли), повторная рвота ранее съеденной пищей (свидетельствует о стенозе привратника при поражении антрального отдела).
При обнаружении признаков злокачественного новообразования желудка по данным ФГДС необходимо определить степень распространеннности процесса по TNM, морфологический тип по Лаурену, гистологический тип, степень дифференцировки, стадию заболевания.
Обследование
1) ФГДС специалистами эндоскопического отделения онкологического диспансера для более детального описания опухоли, характера ее роста, размеров, местоположения.
+ эндо-УЗИ при подозрении на ранний рак желудка (Tis-T1), когда предполагается возможность выполнения эндоскопического лечения
2) Пересмотр гистологических препаратов специалистами-морфологами онкологического диспансера для двойного контроля гистологической верификации, описания степени дифференцировки опухоли, описания краев резекции т.к. часто гистологическая картина морфологами общебольничной сет и описывается недостаточно подробно. В случае отсутствия блоков и стекол — выполняется запрос препаратов. Если биопсия опухоли не была проведена, рекомендуется ее выполнение. Рекомендуется получение не менее 6 биоптатов. При риске кровотечения производится браш-биопсия.
+ определение экспрессии Her2 всем пациентам
+ исследование микросателлитной нестабильности
Гистологические варианты:
1. Папиллярная аденокарцинома
2. Тубулярная аденокарцинома:
— высокодифференцированная;
— умереннодифференцированная.
3. Низкодифференцированная аденокарцинома
4. Муцинозная аденокарцинома
5. Перстневидно-клеточная аденокарцинома (самый агрессивный и прогностически неблагоприятный вариант)
6. Аденоплоскоклеточный рак
7. Плоскоклеточный рак
8. Карциноидная опухоль
9. Недифференцированный рак
3) Пересмотр рентгенографии органов грудной клетки для двойного контроля. В случае, если пленки отсутствуют, выполняется запрос или обзорная рентгенография выполняется повторно в 2 проекциях. Следует помнить, что опухоли любых локализаций гематогенным путем метастазируют в легкие.
4) Исследование уровней онкомаркеров. Значимое повышение онкомаркеров свидетельствует дополнительно в пользу злокачественности новообразования. В дальнейшем динамический контроль онкомаркеров будет полезен в процессе терапии — это позволит оценить эффективность проведённого лечения и заподозрить рецидив с опережением инструментальных методов диагностики
— СА72-4,
— РЭА,
— СА19-9 (с поправкой на ЩФ и ГГТП для исключения холестаза как причины повышения онкомаркера)
5) КТ органов грудной клетки. КТ органов брюшной полости и малого таза с в/в кантрастированием. При местнораспространенном процессе КТ частично может заменить Р грудной клетки в 2 проекциях и УЗИ внутренних органов и шейных, надключичных (метастаз Вирхова в левых надключичных л/у), подмышечных, забрюшинных л/у, лимфатических узлов малого таза (метастаз Шницлера в параректальную клетчатку), яичников у женщин (метастаз Крукенберга) Если протоколы КТ описаны удовлетворительно, ориентироваться на них следует только, если он не более месячной давности.
6) Диагностическая лапароскопия со смывами и цитологическом исследовании смывов с брюшины показана при раке желудка IB-III стадий (прорастании мышечного слоя и увеличения регионарных л/у) и обязательна при тотальном и субтотальном поражении желудка
7) Тотальная колоноскопия у лиц старше 50 лет, если предполагается радикальное лечение. У ослабленных пациентов может быть заменена КТ-колоноскопией с контрастированием барием.
8) ОАК, ОАМ, ЭКГ, биохимическое исследование крови (билирубин, АЛТ, АСТ, ЩФ, ГГТП, сахар крови натощак, креатинин), ЭХО-КС о оценкой ФВ миокарди ЛЖ при планировании хирургического лечения или химиотерапии
+ PD-L1 при распросттраненном процессе (для назначения ниволумаба, пемпролизумаба)
+ ПЭТ/КТ выполняется отдельным больным, в тех случаях, когда с помощью стандартных методов обследования не удаётся снять подозрение на наличие отдалённых метастазов, подтверждение которых значимо меняет тактику лечения
+ биопсия отдалённых метастазов или подозрительных в отношении метастазов очагов под контролем УЗИ / КТ, когда их подтверждение меняет лечебную тактику
Классификация по TNM
Т — характеристика первичной опухоли, т.е. максимальная глубина инвазии опухоли в стенку желудка
Тх Первичная опухоль не может быть оценена
Т0 Данных о наличии первичной опухоли не выявлено
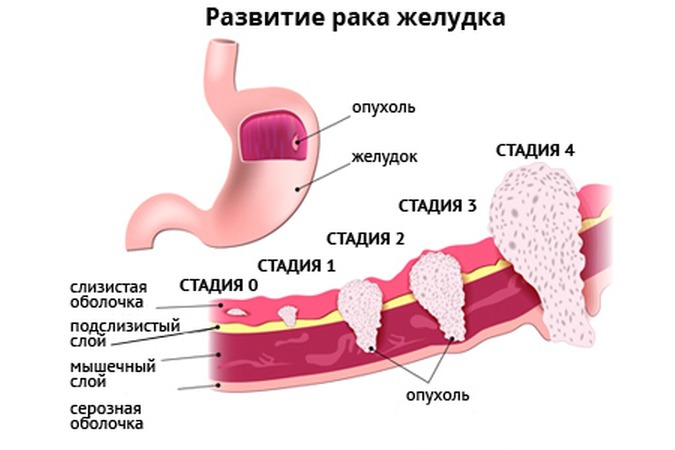
Tis Карцинома in situ (опухоль в пределах слизистой оболочки без инвазии собственной пластинки) или тяжёлая дисплазия
T1 Опухоль захватывает собственную пластинку или мышечную пластинку слизистой оболочки, подслизистый слой
Т1а Опухоль захватывает собственную пластинку или мышечную пластинку слизистой оболочки
Т1b Опухоль захватывает подслизистый слой
T2 Опухоль захватывает мышечный слой
T3 Опухоль захватывает субсерозную оболочку без инвазии висцеральной брюшины или прилежащих структур; к опухолям этой группы относятся также опухоли с инвазией желудочно-ободочной и желудочно-печёночной связки, большого и малого сальников без поражения висцеральной брюшины, покрывающей эти структуры;
T4 Опухоль распространяется на серозную оболочку (висцеральная брюшина) или соседние структуры (интрамуральное распространение опухоли на 12 перстную кишку или пищевод не считается распространением на соседние структуры, но используется для характеристики «T» в случае максимальной глубины инвазии в любой из этих областей)
Т4а Опухоль распространяется на серозную оболочку (висцеральная брюшина)
Т4b Опухоль распространяется на соседние структуры, такие как селезёнка, поперечная ободочная кишка, печень, диафрагма, поджелудочная железа, передняя брюшная стенка, надпочечник, почка, тонкая кишка, забрюшинное пространство
N — характеристика регионарных лимфатических узлов (для точной оценки pN необходимо иссечение и исследование не менее 15 лимфоузлов)
Nx Регионарные лимфатические узлы не могут быть оценены
N0 Нет метастазов в регионарных лимфатических узлах
N1 Поражение 1–2 регионарных лимфатических узлов
N2 Поражение 3–6 регионарных лимфатических узлов
N3 Поражение ≥7 регионарных лимфатических узлов:
• N3a: поражение 7–15 регионарных лимфатических узлов
• N3b: поражение 16 и более регионарных лимфатических узлов
M — характеристика отдалённых метастазов
M0 Отдалённые метастазы отсутствуют
M1 Наличие отдалённых метастазов или наличие опухолевых клеток в смывах /биоптатах и смывах с брюшины
Гистологическая градация аденокарциномы желудка по степени дифференцировки опухолевых клеток:
GX — степень дифференцировки не может быть оценена;
G1 — высокодифференцированный рак:
G2 — умеренно дифференцированный рак;
G3 — низкодифференцированный
G4 — недифференцированный рак
Морфологический подтип по классификации Лаурена:
1. Кишечный тип: опухоль имеет строение, схожее с колоректальным раком, и характеризуется отчётливыми железистыми структурами, состоящими из хорошо дифференцированного цилиндрического эпителия с развитой щёточной каёмкой.
2. Диффузный тип: опухоль представлена слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные) и характеризуется диффузным инфильтративным ростом.
3. Смешанный тип
4. Неклассифицируемый тип
Стадия 0–IA, ранний рак желудка (Tis-T1N0M0)
Особенностью данной группы является благоприятный прогноз (5 летняя выживаемость — более 90 %).
Возможна эндоскопическая резекция слизистой оболочки желудка:
• G1–2 (высокая и умеренная степень дифференцировки)
• экзофитный рост — макроскопический тип возвышающийся (1 тип по японской классификации), плосковозвышающийся (2а тип), плоский (2б тип), и плоскойглубленный (2с тип) тип с западением слизистой не более 5 мм
• размер опухоли не более 2,5 см, а при плоскоуглубленном типе не более 1,0 см.
• без изъязвления и рубцов
• нвазия не более 1/2 подслизистого слоя
• при отсутствии клинически определяемых (эндо-УЗИ, КТ) метастазов в регионарных лимфоузлах и лимфоваскулярной инвазии
В случае обнаружения при плановом гистологическом исследовании инвазии опухоли в подслизистый слой, опухолевых клеток по краю резекции, выявления низкодифференцированных форм или наличия лимфовенозной инвазии показано стандартное хирургическое — дистальная субтотальная резекция, гастрэктомия. Адъювантная лекарственная терапия не показана.
Стадия IB–III (Tis-4 N1–3M0) Оптимальным методом лечения является комбинированный: адекватное хирургическое лечение (гастрэктомия или субтотальная резекция желудка в пределах здоровых тканей R0 в сочетании с D2 лимфодиссекцией), дополненное периоперационной (предпочтительно) или адъювантной ХТ. При невозможности хирургического вмешательства (противопоказания, местная распространённость, отказ пациента) рекомендуется проведение самостоятельной ХЛТ или ХТ по принципам лечения IV стадии заболевания.
При решении вопроса о назначении адъювантной или периоперационной ХТ при операбельных стадиях РЖ возможен учёт данных ретроспективного анализа исследований MAGIC и CLASSIC, показавших, что при наличии высокого уровня микросателлитной нестабильности в опухоли адъювантная ХТ не целесообразна.
Оптимальным сроком начала адьювантной терапии является срок до 12 недель.
Однако по данным немецкого исследования под руководством профессора Erin K. от 2016 года возможна отсрочка в адьювантной терапии до 180 дней (до полугода), что особенно важно у пациентов старшей возрастной группы, которым требуется больший срок для восстановления после хирургического вмешательства.
V стадия — химиотерапия, химиолучевая терапия самостоятельно.
II-III стадия:
а) XT -> хирургия -> XT, классическая схема предложена Аль-Батраном (выигрыш перед самостоятельным хирургическим лечением около 20%)
— 4 FLOT -> хирургия -> 4 FLOT
* 4 исследований III фазы (MAGIC, CLASSIC, ARTIST, ITACA-S) показывают, что лишь пациенты с высоким уровнем микросателлитной нестабильностью имеют выигрыш от неоадьювантной и адьювантной химиотерапии. Пациенты с низким уровнем микросателлитной нестабильностью имеют худшие показатели 5-летней общей выживаемости при проведении неоадьювантной и адьювантной химиотерапии.
б) хирургия -> XT. Подходит, когда пациенты исходно оперируются — при осложненных формах (массивное кровотечение, угроза перфорации, непроходимость), в случае выполнения резекции в общебольничной сети.
— пероральный фторпиримидин S1 в течение 1 года (+10,6% общей 5-летней выживаемости по данным японского исследования под руководством Sasoko)
— 8 курсов XELOX сохранным пациентам (+5% общей 5-летней выживаемости по данным южно-корейского исследования под руководством Y. Bang)
— ослабленным пациентам монотерапия фторпиримидинами (например, капецитабином)
* 4 исследований III фазы (MAGIC, CLASSIC, ARTIST, ITACA-S) показывают, что лишь пациенты с высоким уровнем микросателлитной нестабильностью имеют выигрыш от неоадьювантной и адьювантной химиотерапии. Пациенты с низким уровнем микросателлитной нестабильностью имеют худшие показатели 5-летней общей выживаемости при проведении неоадьювантной и адьювантной химиотерапии.
в) Химиолучевая терапия после операции не увеличивает общей выживаемости (ARTIST-2 TRIAL)
Неоадьювантная химиотерапия показана пациентам с резектабельным раком желудка в стадии, более Т1 и c T любое N+. Предпочтительным протоколом является протокол FLOT 4 курса и еще 4 курса после операции.
Если известно, что у больного местнораспространенная стадия, то лучше проводить неоадъювант нежели адъювант: и пользы больше, и переносимость лучше
При решении вопроса о лекарственной терапии операбельного рака желудка возраст не является критерием исключения.
Решение о назначении адьтювантной терапии зависит от
— статуса пациента по ECOG
— сопутствующих заболеваний
— социальных условий проживания
— когнитивной функции
Показания к неоадьювантной химиотреапии:
— Т2-Т4 N+ M0
— При условии возможности выполнения выполнения Д2 лимфодиссекции
— рак проксимального отдела желудка (при раке тела желудка и нижней 1/3 пищевода нет значимых улучшений общей выживаемости)
— в схему терапии должны быть включены таксаны и препараты платины с инфузионным введением фторпиримидинов
Также применяются менее эффективные протоколы режимы XELOX, CF, ECF, ECX, EОХ. Химиотерапия
включает проведение 3 курсов предопер
Терапия метастатического рака желудка
Терапия 1 линии
Наиболее эффективно сочетание «платина + фторпиримидин» (XELOX, FOLFOX, PF, PX, FOLFIRI)
***
— Оксалиплатин = цисплатину (Al-Bat ran SE et al. JCO 2008)
— Капецитабин И S-1 = инфузиям 5-фторурацила (Kang YKetal. Ann Oncol2009)
— Тройные комбинации эффективнее, но токсичнее, нет преимуществ у пациентов >65 лет (Van Cutsem Е et al. JCO 2006)
— Добавление трастузумаба при HER2neu+ полезно (Bang YJ. Lancet. 2010)
— Добавление иммунотерапии к XT в первой линии неэффективно. В отдельных ситуациях возможна монотерапия пемпролизумабом у отдельных пациентов с высокой экспрессией PDL-1 (CPS>10) и наличием противопоказаний к XT (Fuchs CS. JAMA Oncol. 2018)
— Редукция доз XT — безопасная опция у пациентов с ECOG 2 (The G02 phase III trial)
Выбор 2 линии химиотерапии — самая часто назначаемая схема — рамацирумаб +/- паклитаксел
Терапия 2+ линии не имеет серьезной доказательной базы. Отдельные исследования обнадеживают положительными результатами.
— доцетаксел, британское исследование COUGAR2 с доцетакселом (+1,6 мес. к общей выживаемости, улучшение качества жизни)
— иринотекан, немецкое исследование AIO с иринотеканом (+2,0 мес. к общей выживаемости)
* VS BCS — сравнение доцетаксела и иринотекана (приблизительно одинаковый результат в плане увеличения общей выживамости)
— TAS-102 показал увеличение сроков общей выживаемости в исследовании TAGS. К сожалению, не зарегистрирован в РФ.
— таргетные препараты (рамацирумаб +/- паклитаксел при VEGF мутация, лапатиниб при экспрессии Her2-neo), REGARD (+1,4 мес. общей выживаемости)
— иммунотерапия
3+ линия химиотерапии
— пемпролизумаб 200 мг. 3 раза в неделю зарегистрирован в РФ при высоком уровне микросателлитной нестабильности, PDL-1+
— ожидается регистрация TAS-102 (ингибитор тимидилат синтетазы и тимидин фосфорилазы) — увеличение медианы общей выживаемости на 5,7 мес, улучшение качества жизни
— ниволумаб (рекомендован в Японии) 3 мг/кг 1 раз в 2 недели — + 1,2 мес. к общей выживаемости у пациентов независимо от экспрессии PDL-1 в опухолевых клетках, но при CPS более 10% в микроокружении опухоли (CheckMate 032)
— апатиниб (рекомендован в Китае) — + 1,8 мес. к общей выживаемости
Общие выводы: нужна ли паллиативная гастрэктомия при IV стадии рака желудка?
— На сегодня не имеется данных об эффективности циторедуктивной, паллиативной операции по удалению первичной опухоли.
— Ухудшение переносимости химиотерапии после операции является основным фактором против операции (даже если операционная летальность будет 0%). Причем невозможно предсказать, кто из пациентов не будет переносить химиотерапию после операции.
— Очевидно, что после гастрэктомии переносимость хуже, чем после субтотальной резекции желудка.
У пациентов, которые «ответили» на химиотерапию ~ 40%, исследования с неоадъювантом показывают, что у 5-15% может быть даже полный морфологический ответ, продолжительность жизни зависит в первую очередь от длительности химиотерапевтического эффекта. Операция может помешать продолжению химиотерапии.
— Необходимо научиться разделять рак желудка, на более понятные клинико-морфологическо-молекулярные подгруппы. Тогда могут появиться понятные группы пациентов с IV стадией, которые выиграют от циторедуктивной операции
Также применяются менее эффективные протоколы режимы XELOX, CF, ECF, ECX, EОХ. Химиотерапия
включает проведение 3 курсов предоперационной ХТ и ещё 3 курса после операции.
Перстневидноклеточный подтип является прогностически неблагоприятным, но только лишь наличие перстневидноклеточного варианта не является поводом для отказа в проведении химиотерапии. Протокол FLOT, который дает выигрыши в общей выживаемости т.ч. по сравнению с протоколом ECF. (исследование группы под руководством Al-Batran SE в 2017, the AIO-FLOT3 Trial) Применяется также периоперационный подход 4 курса до оперативного лечения + 4 курса после оперативного лечения.
Пациентоам с операбельным раком желудка с высокой микросателлитной нестабильностью следует отдавать предпочтение тактике только хирургического лечения т.к. они не получают выигрыша от проведения неоадьювантной и адьювантной химиотерапии (метаанализ MSI-GC-01: исследования MAGIC, CLASSIC, ARTIST и ITACA-S)
Перспективным направлением является применение иммунотерапии.

Книга “Комбинированные операции при раке желудка”
Обсуждение проблем радикального хирургического лечения на современном уровне развития дигестивной онкохирургии немыслимо без вопроса лимфодиссекции.
Под лимфодиссекцией (лимфаденэктомией) принято понимать удаление регионарных к удаляемому органу лимфатических коллекторов (узлов и сосудов). Основным теоретическим обоснованием выполнения лимфодиссекций является реализация возможности удаления основного пути и временного барьера распространения опухолевых масс путем иссечения регионарных к органу лимфатических коллекторов с целью ликвидации возможных или явных диссеминатов.
Примечательно, что еще век назад, в 1906 году, Monihan продекларировал, что «… хирургия злокачественных опухолей не столько хирургия органов, сколько анатомия лимфатической системы». Постулат этот за прошедшее время только утверждается. В настоящее время выполнение лимфодиссекций необходимого объема имеет характер хирургической доктрины.
Во всем мире широко обсуждаются объемы необходимой лимфодиссекции в зависимости от локализации опухоли, ее гистотипа и т.д. Среди отечественных публикаций следует особо отметить современную и подробную монографию А.Ф. Черноусова и С.А. Поликарпова (2000).
Общепризнанно, что лимфогенное метастазирование гастральной карциномы служит одной из причин неблагоприятного прогноза и неудач хирургического лечения. Поэтому выполнение радикальной операции по поводу рака желудка на современном этапе принципиально невозможно без удаления путей лимфатического метастазирования опухоли. Кроме этого, поражение лимфатических узлов является для рака желудка одним из наиболее важных прогностических критериев, определяющих необходимость и вид дальнейшего лечения больного.
Известно, что значительная интенсивность лимфогенного метастазирования базируется на морфологической массе лимфатических интрамуральных сплетений желудка, расположенных преимущественно в подслизистом слое. Собираемая сплетениями лимфа оттекает в близлежащие (региональные) лимфатические злы. Регионарный характер оттока лимфы предопределяет начальный путь лимфогенного метастазирования, что важно для выбора рационального объема лимфодиссекции в зависимости от локализации опухоли.
Известно несколько предложенных анатомических схем лимфооттока из желудка.
В историческом аспекте интересна схема оттока лимфы от желудка, предложенная А.В. Мельниковым. Причем эта классическая схема достаточно проста, широко известна и до сих пор применима. Согласно ей в желудке выделяют четыре основных бассейна лимфооттока, а в каждом бассейне четыре этапа лимфоузлов и, соответственно, четыре порядка метастазирования.
Первый бассейн собирает лимфу от большой кривизны пилороантрального отдела желудка (зона правой желудочно-сальниковой артерии). Первый этап метастазирования – лимфоузлы в области привратника; второй – лимфоузлы по нижнему краю головки поджелудочной железы; третий – лимфоузлы в толще брыжейки тонкой кишки, четвертый – парааортальные лимфоузлы.
Второй бассейн собирает лимфу от малой кривизны пилороантрального отдела желудка (зона правой желудочной артерии). Первый этап метастазирования – ретропилорические лимфоузлы; второй – лимфоузлы малого сальника в области привратника и верхней горизонтальной ветви двенадцатиперстной кишки; третий – лимфоузлы гепатодуоденальной связки, четвертый – лимфоузлы ворот печени.
Третий бассейн (основной) собирает лимфу от малой кривизны тела и кардиального отдела желудка (зона левой желудочной артерии), а также от нижнегрудного и абдоминального отделов пищевода. Первый этап метастазирования – лимфоузлы малого сальника; второй – лимфоузлы по ходу левых желудочных сосудов; третий – лимфоузлы по верхнему краю поджелудочной железы, четвертый – параэзофагеальные лимфоузлы.
Четвертый бассейн собирает лимфу от большой кривизны тела желудка (зона селезеночной артерии). Первый этап метастазирования – лимфоузлы желудочно-ободочной связки; второй – лимфоузлы желудочно-селезеночной связки; третий – лимфоузлы ворот селезенки, четвертый – селезенка.
Согласно схеме А.В. Мельникова, при радикальных операциях по поводу рака желудка необходимо удалять лимфоузлы двух этапов метастазирования в зависимости от локализации опухоли.
Известна номенклатура перигастральных лимфоузлов, предложенная М. Сигалом и Ф. Ахметзяновым (1987), в соответствии с которой выделяют:
• Н – лимфоузлы вдоль печеночной артерии, холедоха и шейки желчного пузыря;
• L – лимфоузлы вдоль селезеночной артерии и в воротах селезенки;
• С – лимфоузлы вокруг чревного ствола и устья верхней брыжеечной артерии;
• А – парааортальные лимфоузлы.
На основании этой номенклатуры авторы маркируют выполняемые лимфаденэктомии: правые (Н), левые (L), центральные (СА), полные (HLCA) и т.д. в возможных вариантах сочетаний.
В настоящее время общепризнанна номенклатура лимфоузлов, предложенная Japanese Research Society for Gastric Cancer (JRSGC, Японское Общество изучения рака желудка). Согласно ей выделяют следующие группы:
1 – правые паракардиальные лимфоузлы,
2 – левые паракардиальные лимфоузлы,
3 – лимфоузлы малой кривизны,
4 – лимфоузлы большой кривизны (4s – вдоль левой желудочно-сальниковой артерии и коротких желудочных артерий, 4d – вдоль правой желудочно-сальниковой артерии),
5 – надпривратниковые лимфоузлы,
6 – подпривратниковые лимфоузлы,
7 – лимфоузлы вдоль левой желудочной артерии,
8 – лимфоузлы вдоль общей печеночной артерии,
9 – лимфоузлы вдоль чревного ствола,
10 – лимфоузлы ворот селезенки,
11 – лимфоузлы вдоль селезеночной артерии,
12 – лимфоузлы печеночно-двенадцатиперстной связки,
13 – лимфоузлы задней поверхности поджелудочной железы,
14 – лимфоузлы корня брыжейки,
15 – лимфоузлы вдоль средней ободочной артерии,
16 – парааортальные лимфоузлы,
110 – нижние параэзофагеальные лимфоузлы,
111 – диафрагмальные лимфоузлы.
Все лимфоузлы объединены в четыре группы для каждого отдела желудка следующим образом (таблица).

В соответствии с данной номенклатурой JRSGC предложена классификация лимфаденэктомий при радикальных операциях по поводу рака желудка:
R0 – неполное удаление лимфатических узлов N1;
R1 – полное удаление лимфатических узлов N1;
R2 – полное удаление лимфатических узлов N1-2;
R3 – полное удаление лимфатических узлов N1-3;
R4 – полное удаление лимфатических узлов N1-4, подчеркивается необходимость удаления ретропанкреатических, преаортальных лимфоузлов, а также узлов по боковым поверхностям аорты, в аортокавальной щели, вокруг левой печеночной вены.
Согласно классификации JRSGC выделяют абсолютно радикальные (R > N/+/) и относительно радикальные (R = N/+/) вмешательства. При этом радикальность оперативного вмешательства JRSGC определяет по следующим критериям:
1) отсутствие удаленных метастазов (даже удаленных);
2) отсутствие резидуальной опухоли:
a) отсутствие опухолевых клеток по линии резекции,
b) адекватная комбинированная резекция при вовлечении соседних органов.
Согласно 5-й редакции классификации TNM Международного противоракового союза (критерий N), регионарными для желудка являются узлы, расположенные вдоль малой (1, 3, 5) и большой (2, 4s, 4d, 6) кривизны, вдоль чревного ствола и его ветвей (7, 8, 9, 10, 11), лимфоузлы печеночно-двенадцатиперстной связки (12). Наличие диссеминации в других лимфоузлах (в том числе и абдоминальных) расценивается как отдаленное метастатическое поражение.
Онкологически целесообразным считаем выполнение лимфодиссекции в объеме R2-R4 в зависимости от распространенности и величины первичной опухоли и видимого поражения регионарных лимфоузлов.
Описание техники выполнения лимфодиссекции считаем не целесообразным, так как разные хирурги применяют различные приемы. Кроме того, данному вопросу посвящено несколько современных и подробных публикаций, в частности уже упомянутая монография А.Ф. Черноусова и С.А. Поликарпова (2000).
Принципиальным считаем следующие моменты. Препаровка тканей при лимфодиссекции должна осуществляться только острым путем. В данном случае препаровка «тупым» способом бессмысленна. Препаровка должна производиться по ходу фасций и над самой адвентицией сосудистых стволов. Обязательна тщательная перевязка всех пересекаемых сосудов, в том числе и мелких, и лимфатических, что профилактирует такое неприятное осложнение, как послеоперационная лимфорея.
Следует особо отметить, что при выполнении лимфодиссекций, так же как и в других вопросах, необходимо чувство меры, основанное на оценке целесообразности. С помощью лимфодиссекции хоть сколько расширенного объема нельзя предотвратить гематогенную и перитонеальную диссеминацию.
Таким образом, современный уровень желудочной онкохирургии требует стандартного выполнения лимфодиссекции необходимого объема как непременного компонента радикальной операции. Помимо этого, без лимфаденэктомии и тщательного исследования всех групп удаленных узлов невозможна адекватная оценка распространенности опухолевого процесса и планирование дальнейшего лечения.
ОПТ:СМН.30.09.15.