Рак желудка и диабет

В мире к 2025 году эпидемия сахарного диабета вовлечёт более 300 миллионов человек, что является следствием неконтролируемого роста ожирения и увлечения пищевыми углеводами. Сахарный диабет 2 типа (СД2) уже стал уделом не только пожилых, заболеваемость им почти десятикратно превышает диабет 1 типа.
Давно было замечено, что среди излечившихся от рака диабетиков много больше, чем среди людей никогда не сталкивавшихся со злокачественной опухолью, а на пять диабетиков с онкологическим заболеванием приходится один, у кого одновременно выявляют рак и диабет.

Диабет вызывает рак?
Клинические исследования подтвердили достаточную вероятность развития у страдающих диабетом рака поджелудочной железы, тела матки и толстой кишки. Каждый диабетик может заболеть одной из перечисленных опухолей в два раза чаще всех прочих. Отмечено, что на фоне сахарного диабета 1 типа возрастает частота рака шейки матки и желудка.
Если в популяции одного возраста на девять здоровых людей приходится один диабетик, то среди больных раком поджелудочной железы страдающих сахарным диабетом в три раза больше. Определённо удалось доказать связь недавно возникшего диабета и рака. Но предрасполагал ли диабет к раку или наоборот, можно ли диабет считать осложнением рака поджелудочной железы — достоверно понять пока не смогли.
В качестве факторов риска рака матки давно признана тройка: диабет, гипертония и ожирение, которые прямо или опосредовано, вместе или поодиночке повышают уровень эстрогенов. Избыток этих гормонов запускает опухолевый рост и пролиферацию органов-мишеней.
Интересно взаимоотношение сахарного диабета и рака предстательной железы, развивающегося под действием половых гормонов. Чем дольше мужчина болеет сахарным диабетом, тем меньше у него риск развития рака простаты.
Предполагают, при диабете не только накапливаются продукты углеводного обмена с антипролиферативным действием, но ещё и меняется соотношение эстрогенов и андрогенов в пользу первых, что совсем не способствует пролиферативным изменениям ткани предстательной железы.
Не обнаружено взаимосвязи диабета и рака молочной железы, почки и яичников. Исследователи то находят корреляцию, то напрочь её отрицают. Не вызывает сомнений пагубная роль ожирения, способствующего зарождению постменопаузального рака молочной железы, получается, что косвенно диабет через ожирение может подтолкнуть канцерогенез, но вот прямого его действия не зафиксировано. Да и сама роль жира пока не стала яснее, вполне возможно, что он стимулирует что-то, что и является ответственным за возникновение опухолей. Неоднократно отмечалось, что на степень риска рака молочной железы определённо и негативно влияют противодиабетические средства.
Учёные активно ищут связывающие сахарный диабет и рак гены. СД далеко не всегда повышает риск, но однозначно влияет на течение и лечения рака.
Как сахарный диабет способствует развитию рака?
Механизмов много, и они до конца не изучены. Считается, что в основе развития злокачественных опухолей, связанных с сахарным диабетом, лежат три состояния: повышение в крови уровня сахара (гипергликемия), инсулина (гиперинсулинемия) и развитие воспаления.
При сахарном диабете II типа уровень инсулина в крови нормальный, но клетки слабее на него реагируют и хуже усваивают глюкозу. Организм пытается исправить ситуацию, и поджелудочная железа начинает вырабатывать всё больше гормона. Но усвоение клетками глюкозы и снижение её уровня в крови — не единственный эффект инсулина. Он действует на клетки печени и заставляет их усиленно вырабатывать другой гормон — инсулиноподобный фактор роста 1 (IGF-1). Это вещество обладает митогенными и антиапоптотическими свойствами. Клетки начинают усиленно делиться, они не успевают восстанавливать поврежденную ДНК, при этом подавляется апоптоз — процесс запрограммированной смерти «неправильных» клеток. Это способствует развитию злокачественных опухолей[1].
Второй известный механизм связан с жировой тканью, которая в избытке накапливается в организме у многих людей, страдающих сахарным диабетом II типа. Она вырабатывает адипокины — вещества, которые способствуют развитию воспаления и работают как факторы роста. Кроме того, жировые клетки производят некоторые гормоны, которые также могут влиять на развитие онкологических заболеваний[2].
При сахарном диабете развивается окислительный стресс. В тканях накапливаются свободные радикалы — они приводят к повреждению ДНК и мутациям в онкогенах[3].
Когда в крови повышается уровень сахара, для раковых клеток создаются очень благоприятные условия. Ведь глюкоза для них — основной вид «топлива», они потребляют её в 200 раз активнее по сравнению с нормальными клетками. Этот феномен получил название «эффект Варбурга», потому что его открыл и описал нобелевский лауреат Отто Варбург[4].
Ученые продолжают открывать новые механизмы. Например, в 2019 году было обнаружено, что при высоких уровнях глюкозы в крови у диабетиков падает активность двух веществ, играющих важную роль в восстановлении поврежденной ДНК: фактора транскрипции HIF1α и сигнального белка mTORC1. Из-за этого образуются аддукты — соединения ДНК с другими молекулами. Поврежденные ДНК не восстанавливаются своевременно. Возникает нестабильность генома и повышается риск злокачественного перерождения клеток[5].
Мешает ли сахарный диабет обследованию при раке?
Однозначно, при требующем ограничения по времени приёма пищи обследовании, к примеру, эндоскопии или УЗИ, исполняемых на голодный желудок, у больных сахарным диабетом возникают сложности. По большому счёту, у диабетиков никаких противопоказаний к обследованиям нет. Исключением является только позитронно-эмиссионная томография (ПЭТ), не разрешённая при гипергликемии и гипогликемии.
Вводимый при ПЭТ радиофармпрепарат фтордезоксиглюкоза содержит глюкозу, поэтому при высоком сахаре крови можно добиться критического состояния, вплоть до гипергликемический комы. В большинстве учреждений допустимая верхняя граница глюкозы крови для проведения позитронно-эмиссионной томографии находится в районе 8 ммоль/л. При низкой глюкозе крови ПЭТ не критично, но бесполезно: радиофармпрепарат поглотят не только очаги опухоли, но и сильно голодающие по глюкозе мышцы, «светится» будет всё и опухоль, и весь организм.
Проблема решается с помощью эндокринолога, рассчитывающего больному диабетом правильную дозу антидиабетического средства и время его оптимального приёма.

Влияние диабета на течение опухолевого процесса
Диабет не помогает, это совершенно точно. Диабет не повышает вероятность развития рака молочной железы, но у страдающих раком и диабетом женщин репродуктивного возраста опухоль редко имеет рецепторы прогестерона. Отсутствие рецепторов прогестерона не лучшим образом сказывается на чувствительности к гормональной терапии – это минус, который не только ограничивает возможности лекарственной терапии, но изменяет прогноз на менее благоприятный.
Тридцать лет назад диабет не рассматривался в качестве неблагоприятного фактора у больных раком тела матки, некоторые клинические исследования даже демонстрировали лучший прогноз в отношении жизни и вероятности рецидива. Объяснение тому находили в увеличении уровня эстрогенов, подобно тому при раке предстательной железы, что хорошо должно было сказаться на чувствительности к лечению. Но сегодня это впечатление подвергнуто большому сомнению.
Дело в том, что сам по себе диабет несёт много неприятностей, нивелирующих гормональный позитив. При сахарном диабете страдает иммунитет, и противоопухолевый тоже, изменения в клетках более значимы за счёт большего повреждение ДНК ядра и митохондрий, что повышает агрессивность опухоли и меняет её чувствительность к химиотерапии. В дополнение к этому сахарный диабет — значимый фактор риска развития сердечно-сосудистой и почечной патологии, не увеличивающих продолжительность жизни онкологических больных.
Повышенный уровень сахара крови сулит плохой прогноз в отношении жизни при раке толстой кишки, печени и предстательной железы. Недавнее клиническое исследование показало ухудшение показателей выживаемости больных светлоклеточным раком почки после радикального лечения.
Не должно быть иллюзий, нездоровье никогда не помогало выздоровлению, но состояние компенсации диабета много лучше декомпенсации, поэтому надо держать диабет «под контролем», тогда и мешать он будет значимо меньше.
Как диабет мешает лечению рака
Во-первых, сахарный диабет поражает почки, а многие химиопрепараты выводятся именно почками и не только выводятся, но и повреждают почки в процессе лечения. Так платиновым препаратам присуща невероятно высокая почечная токсичность, по уму их бы при диабете лучше и не использовать, но при том же раке яичников или яичка платиновые производные входят в «золотой стандарт» и отказ от них не помогает излечению. Снижение дозы химиопрепарата откликается меньшей эффективностью терапии.
Диабет, как упоминалось выше, способствует развитию сердечно-сосудистых заболеваний, а некоторые химиопрепараты известны своей кумулятивной (накапливающейся) кардиальной токсичностью. Имеет место и повреждение периферической нервной системы химиопрепаратами и сахарным диабетом. Что делать: снижать дозы или идти на обострение диабета – решают индивидуально. Волей-неволей, приходится выбирать «меньшее зло»: бороться с опухолью всеми имеющимися средствами, вызывая осложнения диабета, или ограничивать планы борьбы, сохраняя компенсацию диабета.
Таргетный бевацизумаб у больного диабетом способствует чуть более ранней инициации диабетической нефропатии, а трастузумаб – кардиопатии. Крайне неприятное влияние годами принимаемого при раке молочной железы тамоксифена на эндометрий при сахарном диабете усугубляется. Некоторые современные препараты требуют предварительной подготовки очень высокими дозами кортикостероидов, которые способны инициировать стероидный диабет, поэтому больному диабетом может потребоваться перевод на инсулин или увеличение дозы инсулина, с которой очень проблематично позже сойти.
Ко всем этим неприятностям, которые при выборе противоопухолевого лечения онкологи стараются избегать, диабет снижает иммунологическую защиту, поэтому падение уровня лейкоцитов и гранулоцитов в результате химиотерапии может откликнуться тяжёлыми и продолжительными инфекционными осложнениями. Не улучшает диабет и течение послеоперационного периода, когда весьма высока вероятность кровотечений из поражённых диабетом сосудов, воспалительных изменений или острой почечной недостаточности. При лучевой терапии диабет нельзя оставлять без внимания, возможны нарушения обмена углеводов со всеми вытекающими неблагоприятными последствиями.
Важнейшим во время любого противоопухолевого лечения у больного диабетом, наряду с проведением специального лечения, становится адекватная профилактика декомпенсации диабета под контролем эндокринолога.
Запись
на консультацию
круглосуточно
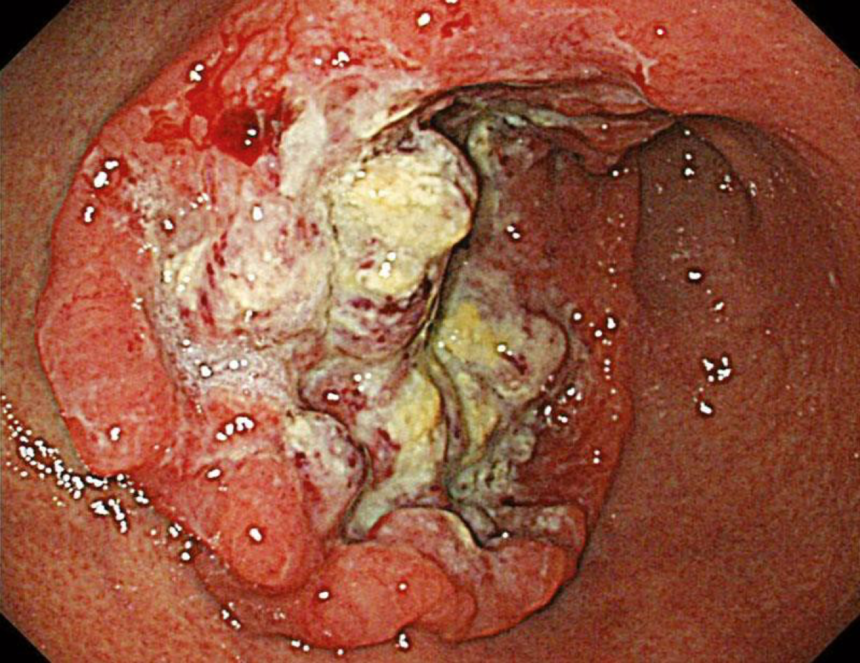
Рак желудка (РЖ) — злокачественная опухоль, развивающаяся из слизистой оболочки желудка. В экономически развитых странах заболеваемость (распространенность) рака желудка заметно снизилась, в основном за счет изменения качества питания. В России рак желудка находится на втором месте по заболеваемости среди других новообразований, уступая раку легкого у мужчин и раку молочной железы у женщин. Во многих странах он до сих пор уверенно держит первое место. Ежегодная заболеваемость в мире — около 800 тысяч новых случаев и около 600 тысяч смертей. Чаще болеют люди после 50 лет и в данной категории преобладают мужчины. Самая высокая выживаемость после обнаружения рака желудка наблюдается в Японии — 53%.
Для развития рака желудка большую роль играют предраковые состояния — хронический атрофический гастрит, хроническая каллезная язва, пернициозная анемия, состояние после резекции желудка (особенно через 10–20 лет после резекции по Бильрот—II), аденоматозные полипы желудка (частота малигнизации — 40% при полипах более 2 см в диаметре), иммунодефицитные состояния, особенно вариабельный неклассифицируемый иммунодефицит (риск карциномы — 33%), инфицирование Helicobacterpylori.
Поэтому, важнейшим методам профилактики рака желудка является своевременное радикальное лечение этих заболеваний. Немаловажное значение имеют внешние канцерогенные факторы: чрезмерно грубая, копченая, жирная, пережаренная или острая пища, неправильный режим .питания и злоупотребление алкоголем. По-видимому, эти факторы способствуют в первую очередь возникновению гастрита, который в дальнейшем служит фоном для появления рака.
Диагностика
При ранней диагностике рака желудка используют:
- Специфические маркеры (карбогидратный антиген CA 19—19, CA 72-4 и некоторые другие).
- Эзофагогастродуоденоскопия (ЭГДС) с использованием специфических красителей, биопсией и цитологическим исследованием содержимого и/или подозрительных участков. Данные методы позволяют почти безошибочно обнаружить предраковые состояния, а также основные макроскопические типы раннего рака желудка: Тип I — возвышающийся, или полиповидный; Тип II — плоский; Тип III — углубленный, или язвенный (выявляется дефект слизистой оболочки по типу язвы).
- Другие методы визуализации: рентгенография, рентгеноскопия, КТ — компьютерная томография, МРТ — магнитно-резонансная томография, УЗИ, ПЭТ — позитронно-эмиссионная томография, лапароскопическая диагностика.
- Дополнительные лабораторные исследования.
Принципы лечения
В зависимости от стадии рака желудка существуют различные методы лечения. Выбор метода лечения зависит от многих факторов. Конечно, месторасположение и стадия опухоли являются важными факторами. К другим факторам относится возраст, общее состояние и личные пожелания.
Основными методами лечения рака желудка являются: хирургическое лечение, химиотерапия (в т.ч. интраперитонеальная химиотерапия, ИПХ) и облучение. Часто наилучшим подходом к лечению может быть применение двух и более методов. Главной целью лечения является полное избавление от болезни. В том случае, когда полное излечение невозможно, терапия направлена на облегчение симптомов болезни, таких как нарушение приема пищи, боль или кровотечение. Перед началом лечения важно уточнить цель предполагаемой терапии.
Хирургическое лечение
Хирургический метод является «золотым» стандартом в лечении больных раком желудка. В зависимости от распространенности опухолевого процесса объем оперативного вмешательства может варьировать от выполнения эндоскопической резекции пораженной слизистой оболочки желудка до
выполнения травматичных расширенных комбинированных операций. В настоящее время довольно широко используются методики оперативных вмешательств на лимфатическом аппарате желудка (лимфодиссекции), которые позволяют наряду с удалением первичной опухоли удалить зоны лимфогенного метастазирования, что в ряде случаев положительно влияет на отдаленные результаты.
Сегодня выполняется 3 основных типа операций — гастрэктомия, субтотальная проксимальная и субтотальная дистальная резекции желудка. Гастрэктомия является одной из основных операций в арсенале хирургического лечения рака желудка, составляя до 70% всех радикальных операций, и признается стандартной при условии сохранения селезенки и поджелудочной железы.
Органосохраняющее лечение рака желудка
Органосохраняющие методы завоевывают все большее признание в практике лечения больных онкологическими заболеваниями. Показанием к их выполнению является выявление на дооперационном этапе ранних форм злокачественной опухоли. Ранним раком желудка принято считать злокачественную опухоль, поражающую слизистую оболочку и подслизистый слой стенки желудка, независимо от наличия и отсутствия метастазов в лимфатических узлах.
При выявлении раннего рака желудка возможно выполнение органосохраняющего оперативного вмешательства, которое заключается в эндоскопической резекции пораженной слизистой оболочки желудка в пределах неизмененных тканей.
Данный метод лечения больных ранними формами рака желудка является мало инвазивным и более экономичным, по сравнению со стандартным оперативным лечением и позволяет сократить время пребывания больного в стационаре и сроки реабилитационного периода.
Дистальная субтотальная резекция желудка
Показанием к выполнению субтотальной резекции желудка является локализация опухоли в области нижней трети желудка экзофитного и язвенного
характера. Оперативное вмешательство выполняют из абдоминального доступа. Выполняют верхнюю срединную лапаротомию, после чего производят детальную ревизию органов брюшной полости с целью определения распространенности опухолевого процесса и объема оперативного вмешательства. Методика выполнения субтотальной резекции желудка может иметь некоторые отличия в зависимости от объема выполняемой лимфодиссекции (стандартный объем D1 или расширенная лимфодисекия D2).
Гастрэктомия
Показанием к выполнению гастрэктомии является локализация опухоли в средней и верхней трети желудка, а также инфильтративный тип роста опухоли вне зависимости от локализации. Оперативное вмешательство выполняют чаще из абдоминального доступа, реже, при вовлечении в опухолевый процесс дистальных отделов пищевода, используют торако-абдоминальный доступ. Лимфодиссекция может выполняться в объеме D1, D2 или D3.
Справка IMA
Доктор Мелвин Лук Чи-Менг, хирург-гастроэнтеролог «Центра гастроэнтерологической, гепатобилиарной и лапароскопической хирургии» больницы «Mount Elizabeth» специализируется на лечении рака органов брюшной полости.
Доктор Мелвин Лук Чи-Менг прошел годичную стажировку в Национальном онкологическом центре в Токио по специализации хирургия верхнего отдела желудочно-кишечного тракта, где обучился японской технике радикальной резекции и удаления системных лимфоузлов при хирургическом лечении рака пищевода, желудка, поджелудочной железы и брюшной полости.
Хирургическое лечение местнораспространенного рака
Практически повсеместно имеет место поздняя диагностика заболевания — 75% больных к моменту госпитализации имеют III — IV стадию рака желудка, в связи с чем, довольно высока частота комбинированных операций, которая колеблется от 30% до 50%.
Несмотря на высокий риск, комбинированные операции в настоящее время занимают важное место в хирургии рака желудка, что обусловлено особенностями регионарного метастазирования и местного распространения опухоли. Даже если операция при раке желудка является паллиативной, она в любом случае уменьшает симптомы заболевания и увеличивает срок жизни больных.
Современная хирургия имеет разнообразный арсенал комбинированных оперативных вмешательств. Самая распространенная комбинация — это операция на желудке сопровождающаяся выполнением спленэктомии. Реже выполняются дистальная резекция поджелудочной железы, резекция
толстой кишки и ее брыжейки, надпочечника, диафрагмы, гастропанкреатодуоденальная резекция, левая верхняя эвисцерация брюшной полости.
Интраперитониальная химиотерапия (ИПХ)
На сегодняшний день существует множество методик и режимов интраперитонеального введения препаратов. Условно ИПХ можно разделить на интраоперационную и послеоперационную, хотя некоторые авторы начинают введение препаратов в процессе хирургического вмешательства в сочетании с гипертермией или без нее и продолжают интраперитонеальное введение препаратов в раннем послеоперационном периоде.
Основанием для сочетания ИПХ с гипертермией являются цитотоксический эффект гипертермии, повышение проникающей способности химиопрепаратов в ткани. Хотя рядом автором самостоятельный противоопухолевый эффект повышенной температуры отрицается, усиление цитотоксического эффекта химиопрепаратов на фоне гипертермии считается доказанным. Методики интраперитонеальной химиогипертермической перфузии (ИХГП) достаточно многочисленны и различаются по продолжительности процедуры, набору химиопрепаратов, способу анестезии и методу предупреждения общего перегревания организма. В зависимости от того, на закрытой или открытой брюшной полости проводится гипертермическая перфузия, ее можно разделить на два основных метода: закрытый и открытый.
Известного онкологический хирург Пол Шугабейкер из Вашингтонского института онкологии считает, что гипертермическая интраоперационная ИПХ с использованием ручного распределения нагретого раствора по всей поверхности брюшины должна рассматриваться, как стандартная методика лечения у больных раком желудка III стадии, а при возможности выполнения паллиативной гастрэктомии и у больных IV стадии. Интраоперационная химиотерапия предпочтительнее послеоперационной, поскольку адгезивный процесс уже в раннем послеоперационном периоде может препятствовать орошению всех отделов брюшной полости и ложа желудка.
Химиотерапия
Под химиотерапией подразумевается использование противоопухолевых препаратов для уничтожения опухолевых клеток. Обычно препараты назначаются внутривенно или внутрь, т.е. через рот. Как только препарат поступает в кровяное русло, он распространяется по всему организму. Химиотерапии применяется обычно для воздействия на распространенную опухоль.
Химиотерапия может быть основным методом лечения рака желудка, когда опухоль уже распространилась в отдаленные органы. Этот метод терапии применяется до или после операции. Опыт показал, что химиотерапия может облегчить симптомы у некоторых больных раком желудка, особенно в тех случаях, когда рак распространился в другие области тела. Имеются указания на то, что химиотерапия в сочетании с лучевой терапией может отсрочить рецидив (возврат) болезни и продлить жизнь больным с распространенным процессом.
Химиотерапевтические препараты не только уничтожают опухолевые клетки, но и могут повреждать нормальные клетки, что приводит к побочным эффектам. Эти побочные эффекты зависят от типа препаратов, их доз и длительности лечения. В процессе химиотерапии могут появиться следующие осложнения лечения: повышенная утомляемость, тошнота и рвота, жидкий стул, потеря аппетита, облысение (волосы отрастают вновь после окончания лечения), язвы во рту, повышенный риск инфекционных заболеваний в связи со снижением количества лейкоцитов (белых кровяных телец), появление синяков или кровотечений, одышка.
Большинство из этих побочных эффектов проходят после окончания лечения. При появлении таких явлений сообщите об этом врачу или медицинской сестре, так как имеются способы борьбы с побочными эффектами химиотерапии.
Лучевая терапия
При этом методе используются лучи высоких энергий с целью уничтожения или сокращения опухоли. Облучение может быть наружным или с помощью радиоактивных материалов, вводимых непосредственно в опухолевую ткань (внутреннее или имплантационное облучение). При раке желудка обычно применяется наружное облучение.
После операции лучевая терапия может применяться для уничтожения мелких очагов опухоли, которые нельзя увидеть или удалить во время оперативного вмешательства. Полагают, что лучевая терапия, особенно в комбинации с химиотерапией, может отсрочить или предотвратить рецидив (возврат) рака после операции и может способствовать продлению жизни больным. Лучевая терапия может использоваться с целью облегчения симптомов, таких как боль, кровотечение и затруднение прохождения пищи.
Лучевая терапия рака желудка — сложная процедура, поэтому ее нужно проводить в отделениях с большим опытом лечения таких больных.
Справка IMA
Облучение больных РЖ проводится с применением современных линейных ускорителей с использованием трехмерной планирующей системы.Для достижения более высокой эффективности и снижения токсических проявлений лучевой терапии облучение проводится с применением системы лучевой терапии «TomoTherapy HI-ART», которая позволяет:
- создавать десятки тысяч мелких, мощных и точных лучей радиации для облучения опухолей;
- направлять радиоактивное излучение с высочайшей точностью на опухоли, используя встроенный компьютерный томограф для определения формы и положения опухоли за секунды до начала облучения;
- зачастую значительно снижать воздействие радиоактивного излучения на смежные с опухолью здоровые ткани.
Система лучевой терапии «TomoTherapy HI-ART» имеется в распоряжении больницы «Mount Elizabeth», Национального онкологического центра и Медицинского центра «Prince Court» (Малайзия).
Из побочных эффектов лучевой терапии нужно отметить незначительные кожные реакции, тошноту, рвоту, жидкий стул или повышенную утомляемость. Эти симптомы обычно проходят через несколько недель после прекращения лечения. Облучение может усугубить побочные эффекты химиотерапии.
Прогноз
Ко времени постановки диагноза только у 40% пациентов имеется потенциально курабельная опухоль. Прогноз мало благоприятен. Он в значительной степени зависит от глубины прорастания опухолью стенки желудка, степени поражения регионарных лимфатических узлов и наличия отдалённых метастазов. Операция является методом выбора, при ней 5-летняя выживаемость — в 12% случаев. При поверхностной локализации опухоли 5-летняя выживаемость может достигать 70%. При раке в язве желудка прогноз несколько лучше (5-летняя выживаемость составляет 30–50%). Ранний диагноз обеспечивает наиболее благоприятный прогноз. Клиническое улучшение при неоперабельной опухоли и метастазах у 20—40% больных удается достичь в результате применения химиотерапии, но это мало влияет на продолжительность жизни.
Source: www.inmedas.ru