Рак желудка 4 степени канцероматоз брюшной полости
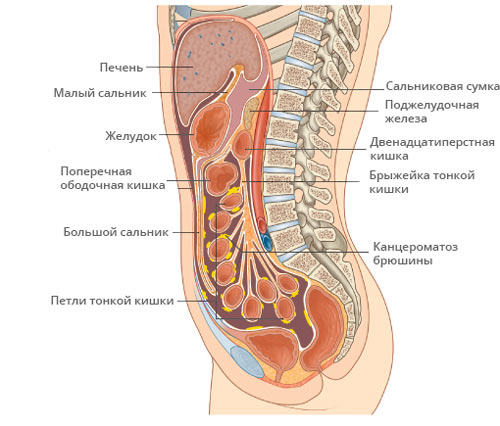
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.

Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Запись
на консультацию
круглосуточно
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.
LHIPEC – новое в лечении рака органов брюшной полости 4 стадии: рак желудка, рак кишечника, рак яичников.
Данный материал подготовлен медицинским координатором нашего центра и врачами – онкологами из Новосибирска и Владивостока в результате медицинской стажировки в Корею (30.09 – 05.10.2019) в клинику СЭМ на изучение современного метода LHIPEC для лечения пациентов с диагнозом: рак желудка, рак кишечника, рак яичников 3 и 4 стадии, с метастазами в брюшной полости, асцитом и канцероматозом.
В данной статье также использована информация из зарубежных научных исследований и публикаций, предоставленных доктором Ли, онкологом, главврачом клиники СЭМ, Корея, и практикующим хирургом по методике LHIPEC.
Для начала разберемся в терминах
Метастазы в брюшной полости.
Это вторичные злокачественные образования, источником которых стала первичная опухоль, могут образовываться в лимфоузлах, в соседних и даже отдаленных органах, в костях. Метастазы разделяют на одиночные, множественные, мелкие и крупные, опасные и менее опасные.
Канцероматоз.
Канцероматоз брюшины – это метастатическое поражение стенок брюшной полости и поверхностей тканей органов. Как правило, канцероматоз – это признак 3 или 4 стадии рака, чаще терминальной, то есть заключительной стадии развития онкологии. Обычно это множественное поражение тканей, в виде белых бугристых плотных образований. Далее мы расскажем, как эти образования меняются после проведения операции LHIPEC.
Асцит.
Асцит в брюшной полости – это свободная жидкость, которая появляется в результате прогрессирования онкологии (важно, чаще асцит является следствием цирроза печени, реже – онкологии). Жидкость скапливается в брюшине, ее может быть мало, а может быть несколько литров. При онкологии жидкость содержит в себе атипичные (злокачественные) клетки.
Спайки.
Мало кто обращает внимание из пациентов на данный фактор, но спайки – опасная проблема для пациента. Дело в том, что ткани нашей брюшной полости имеют так называемый слипчивый характер. При перенесенных операциях, закрытых травмах живота, лучевой терапии может происходить «склеивание» органов между собой или со стенками брюшины. Само склеивание выглядит как белые фиброзные ткани разной плотности и длины, крепко соединяющие органы и стенки брюшины там, где этого не должно быть. Такой процесс может привести даже к летальному исходу как одно из осложнений лечения.
Многие знают, как лечить рак
Если диагноз онкология поставлен, то в зависимости от условий, назначают операцию, химиотерапию, лучевую терапию. Современные способы лечения рака сегодня также включают иммунотерапию, таргетную терапию, криоабляцию, гипертермию и многое другое.
Удивительно, но иногда именно смешение типов лечения дает совершенно новый результат и прорыв в лечение рака, особенно при последних стадиях. Именно так появилась методика LHIPEC.
Разберемся по порядку.
Есть обычная химиотерапия. Для каждого вида рака – свой протокол, часто даже несколько, если первая линия не помогла или у пациента развилась химиорезистентность, то есть привыкание к данному препарату, назначают другой протокол.
Есть обычная операция, хирургическое удаление образования. Операция бывает лапароскопической (малоинвазивное вмешательство через 2-3 прокола с использованием эндоскопического оборудования) и лапаротомическая, то есть с открытым доступом.
Есть гипертермия. Это нагревание того места пациента, где локализуется опухоль, как бы «прогревание» до 44-45 градусов. Данный метод используют для усиления эффекта от лечения химиотерапией или лучевой терапией, так как высокая температура пагубно сказывается на злокачественных клетках, в то время как здоровые клетки способны ее выдержать.
Инртаоперационный HIPEC – объединение этих трех методов лечения: химиотерапия, открытая операция и гипертермия.
Сначала получилась открытая операция с применением HIPEC: после удаления образования и возможно лимфоузлов, пациенту в течение 40 минут промывают брюшную полость химиопрепаратом, подогретым до 39 градусов, после чего сшивают место доступа и заканчивают операцию.
The New England Journal of Medicine, 18 января 2018. Группа ученых и онкологов Голландии и Дании. Публикация результатов клинических испытаний применения HIPEC.
- 245 пациентов с раком яичников 3 стадии (1 группа 123 чел. без и 2 группа 122 чел. с HIPEC)
- Клинические испытания длились с апреля 2007 по апрель 2016 годов
- 3 курса неоадъювантной (до операционной) химиотерапии (карбоплатин + пакситаксел)
- Оперативное удаление образования
- Внутрибрюшинная гипертермическая химиотерапия в конце операции (цисплатин)
Результаты исследования:
Средняя продолжительность ремиссии без рецидива рака:
- 1 группа = 10,7 месяцев
- 2 группа = 14, 2 месяца
Средняя выживаемость пациентов в течение 4,7 лет наблюдения:
- 1 группа = 38 %
- 2 группа = 50 %
Обратиться в клинику
Исследования метода «горячей» химиотерапии во время операции показали, что этот метод может быть очень эффективным в вопросе продления жизни пациента с раком органов брюшной полости на 3 и 4 стадиях, и даже позволяет добиться большего процента пятилетней выживаемости пациентов с тяжелой степенью рака.
Единственная проблема: этот метод применим один раз, во время открытой операции. Как только ученые и врачи это поняли, начался следующий этап исследований: сделать эту процедуру повторной, для усиления эффективности лечения рака.
Так появился метод LHIPEC – лапароскопическая внутрибрюшинная гипертермическая химиотерапия. Это смешение тех же методов: химиотерапия, операция и гипертермия, только в данной случае малоинвазивная операция, через 2-3 прокола с помощью эндоскопов, что позволяет повторять процедуру несколько раз (от 2 до 10) с интервалом 3-4 недели.
LHIPEC позволяет локально воздействовать на опухоль, метастазы, канцероматоз, избавиться от асцита и запустить процесс уничтожения атипичных клеток. В отличие от системной химиотерапии, которая при 4 стадии рака помогает лишь поддерживать состояние больного, но не лечить.
На сегодня, пожалуй, это единственное средство лечения рака желудка, рака кишечника, рака яичников и других (список ниже в таблице), которое позволяет эффективно избавиться от продуцирования асцита, от канцероматоза и метастаз в брюшной полости.
Описание процедуры.
LHIPEC – это оперативное вмешательство, осуществляется под общим наркозом, средняя продолжительность операции около 1,5 – 2 часов. В области брюшной полости хирург делает 2-3 прокола для введения камеры и одного или двух эндоскопов, с помощью которых он сможет:
- откачать асцит,
- взять жидкость на анализ,
- взять образец ткани из канцероматозного образования брюшной стенки,
- по возможности разделить спайки для нормальной циркуляции последующей химиотерапии и максимального доступа ко всей пораженной площади в брюшной полости.
Это все называется ревизия брюшной полости. При этом опытный хирург оценивает общий объем поражения брюшной полости по специальной шкале PCI, считает количество откаченной жидкости, оценивает состояние плотности и жизнеспособности канцероматозных тканей и спаечных тканей.
По окончании всех процедур устанавливаются трубки вместо эндоскопов и подключается аппарат для промывания брюшной полости химиотерапией. Подобранный под диагноз препарат или комбинация препаратов подогревается до 41-42 градусов по Цельсию, поступает в брюшную полость, циркулирует и откачивается через другую трубку уже с температурой 39-40 градусов. Процедура длится около 60-90 минут в зависимости от состояния пациента, после чего откачивается вся возможная свободная жидкость, оборудование снимается, накладываются швы.
Назначение метода:
Данный метод назначается пациентам при условии наличия метастаз в брюшной полости, канцероматоза и асцита. В основном, наиболее сильный эффект проявляется у пациентов с диагнозом рак желудка, рак кишечника, рак яичников, мезотелиома. Реже под условия участия попадали пациенты с диагнозом рак матки, рак поджелудочной железы, рак желчного пузыря.
Частота применения:
LHIPEC проводят от 1 до 10 раз. Все зависит от диагноза, от стадии рака, от состояния брюшной полости и самого пациента, от подобранных препаратов и ответной реакции организма. Ниже в таблице приведены данные по количеству раз и эффективности.
Обратиться в клинику
Результаты клинических испытаний клиники G SAM Hospital, Korea, доктор Chaiyoung Lee, частота применения:
| Количество раз LHIPEC | |||||||||||
| Количество пациентов Виды рака | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | Всего раз |
| Рак желудка | 262 | 109 | 50 | 29 | 15 | 10 | 6 | 3 | 1 | 1 | 486 |
| Рак яичников | 84 | 42 | 19 | 13 | 7 | 4 | 3 | 172 | |||
| Рак кишечника | 72 | 26 | 12 | 6 | 3 | 1 | 1 | 121 | |||
| Рак поджелудочной железы | 33 | 7 | 2 | 1 | 1 | 1 | 1 | 1 | 47 | ||
| Рак желчного пузыря | 30 | 8 | 3 | 2 | 2 | 2 | 1 | 1 | 49 | ||
| Аденокарцинома неуточненной локализации | 25 | 12 | 8 | 1 | 46 | ||||||
| Мезотелиома | 18 | 13 | 7 | 7 | 5 | 5 | 3 | 3 | 2 | 1 | 64 |
| Рак матки | 7 | 3 | 1 | 1 | 1 | 1 | 1 | 15 | |||
| Другие виды | 22 | 5 | 2 | 29 | |||||||
| Всего пациентов / раз | 553 | 225 | 104 | 60 | 34 | 24 | 16 | 8 | 3 | 2 | 1029 |
Оксана Гончарук, руководитель центра Медкор

Во время стажировки мы присутствовали на трех операциях. Первой была пациентка с раком яичников 4 стадии, LHIPEC проводился ей впервые. Во время ревизии брюшной полости благодаря введенной камере было видно, насколько сильно поражена брюшная полость: ткани воспаленные, канцероматозные образования по всем стенкам брюшины и на поверхности органов, асцит около 2,5 литров, жесткие плотные спайки, которые можно было только рассечь, что опасно, так как во многих местах они проросли рядом с сосудами. Далее была операция у пациентки тоже с раком яичников второй стадии. Но ей LHIPEC проводили уже второй раз. И мы отчетливо увидели процессы разложения злокачественных образований, канцероматозные ткани были пожелтевшими (некроз), плоскими, в меньшем объёме и количестве (со слов хирурга по сравнению с первой операцией), асцит накопился за 4 недели всего около 800 мл., а спайки стали мягкими и рыхлыми, хирург легко их разделял даже камерой. То же самое мы увидели на повторной процедуре LHIPEC у пациента с раком желудка на 4 стадии. Эффект воздействия локальной горячей химиотерапии был очевиден.
Международные клинические испытания:
«Эффект от использования Лапароскопической перитонеальной гипертермической химиотерапии у пациентов с перитонеальным метастатическим раком органов ЖКТ»
- Участники проекта: Доктор Chaiyoung Lee, доктора и ученые из Японии, Кореи и Китая.
- Срок проведения клинических испытаний 2008 – 2014 года.
Данные о результатах исследований:
| Показатели | Рак желудка | Рак кишечника |
| Уменьшение объема асцита | 72% | 79% |
| Уменьшение показателя PCI (объема поражения) | 61% | 65% |
| Увеличение средней продолжительности жизни до | 11,5 мес | 20,8 мес |
| Обычная средняя продолжительность жизни без LHIPEC | 3,1 месяц | 5,2 месяца |
*Данные опубликованы Cancer&Clinical Oncology. Vol.3 No.2; 2014
Михаил К., 50 лет. Новосибирск.
Обратилась супруга Михаила. Пациент с аденокарциномой желудка 4 стадии, после оперативного удаления опухоли, 6 курсов полихимии, 3 монокурсов таргетной химии. На момент обращения сохранялся канцероматоз и небольшой объем асцита, метастазы в брюшной полости.
При рассмотрении данного запроса, доктор Ли предложил следующую схему лечения. Пациент заканчивает курс химии, вместо следующего курса через 3 недели приезжает в Корею на проведение процедуры LHIPEC. Затем на Родине через 3 неделе делает следующий курс химиотерапии, после чего снова приезжает в Корею на вторую процедуру через 3 недели.
По окончании лечения по данной схеме в Корее пациенту провели контрольное обследование, которое показало полное отсутствие метастаз, канцероматоза и асцита в брюшной полости. Согласно протоколу лечения, пациент продолжает принимать таргетный препарат на снижение риска рецидива заболевания.
Выводы.
Эффективное лечение рака 4 стадии есть. Благодаря таким методам как LHIPEC, у пациентов появляется шанс. Этот метод позволяет убрать острое состояние у пациента, дает время общему системному лечению подействовать и быть более эффективным, дает больше времени качественной жизни и больший процент выхода в длительную ремиссию.
Где можно получить лечение рака методом LHIPEC?
Сколько времени занимает лечение?
Выезд на период 10-12 дней с учетом предоперационного обследования.
Сколько стоит лечение рака методом LHIPEC?
Предоперационные обследования – от 500 до 1500 USD (около 32 000 – 96 000 рублей).
Процедура LHIPEC – от 8 000 до 10 000 USD (около 515 000 – 640 000 рублей), зависит от препарата химиотерапии.
За что еще нужно платить?
Авиа билет до Сеула и обратно.
Питание.
Как узнать, поможет ли LHIPEC в моем случае?
Отправляйте ваши медицинские документы (копии) и снимки в электронном виде на почту info@med-core.com.
Запрос врачу обрабатывается бесплатно, в течение 2-3 рабочих дней. Если доктор Ли считает, что данному пациенту можно помочь методом LHIPEC, он дает план лечения, мы его вам пришлем сразу по получении, с указанием нужных сроков выезда и необходимого бюджета. В случае выезда, вас ведет медицинский координатор нашего центра, начиная с подготовки к выезду, во время нахождения в клинике и после возвращения по программе пост-сопровождения.