Парижская классификация раннего рака желудка



Тип I
Выступающий тип

Тип II
Поверхностный тип

А. Поверхностный
приподнятый


В. Поверхностный
плоский




С. Поверхностный
углубленный

Тип III
Подрытый









Эндоскопическая
дифференциальная диагностика.
Трудности возникают при дифференциальной
диагностике ранних форм РЖ и
доброкачественных новообразований –
полипов.
Внешне они очень похожи и определить
характер полипоидного образования без
гистологического исследования невозможно.
Но дело в том, что биопсия, выплненная
с поверхности полипа не отражает
изменений в его теле и основании. Поэтому
все полипоидные (полиповидные) образования
подлежат удалению с помощью
электрокоагуляционной петли и тока
высокой частоты и тотальному
морфологическому изучению. При
множественных полипах электроэксцизию
начинают с наиболее крупных, в которых
вероятность развития рака максимальна.
Ещё сложнее
дифференциальная диагностика изъязвленного
рака и язвы
желудка.
Сказать «на глаз» в каком участке стенки
язвы могут быть злокачественные клетки
практически невозможно. Поэтому
рекомендуют выполнять множественные
биопсии из разных участков по краю язвы
(биопсия в области дна язвы малоинформативна
из-за наличия некротического детрита
и опасна из-за возможности кровотечения).
Таких биопсий нужно выполнить не менее
пяти. Только тогда можно быть более или
менее уверенным в доброкачественности
изязвления. Существует четкая
закономерность: чем выше по желудку
находится язва, тем больше вероятность
её злокачественного характера. Даже
рубец на месте зажившей язвы желудка
не исключает наличия рака и требует
обязательной биопсии, ибо первично
изъязвленные раки могут рубцеваться
под влиянием противоязвенной терапии.
Весьма непросто
отличить диффузно растущий рак антрального
отдела от т.н. ригидного
антрального гастрита.
В обоих случаях обращает на себя внимание
отсутствие перистальтики в антральном
отделе желудка, изменение его складчатости,
инфильтративное утолщение слизистой.
Решают вопрос повторные биопсии,
выполненные ступенчатым образом (каждая
последующая биопсия выполняется в месте
предыдущей, углубляясь в толщу стенки
желудка). Такие биопсии позволяют
верифицировать рак даже в случае его
подслизистого роста.
Дополнительные
методы исследования.
После установления диагноза РЖ необходимо
определить его операбельность. Истинные
границы опухоли и распространение рака
по лимфатической системе не всегда
возможно уточнить не только в
предоперационном периоде, но даже во
время операции. Ответ на этот вопрос
может дать только морфолог, производящий
исследование резецированного желудка,
удаленных вместе с ним тканей и
регионарных лимфатических узлов. Однако
и до операции можно выявить признаки
неоперабельности. При общеклиническом
обследовании
можно выявить отдаленные метастазы
(метастаз Вирхова, метастаз в область
пупка, метастаз Шницлера, метастаз
Крукенберга у женщин, увеличенную печень
с плотным бугристым краем, асцит,
плевральный выпот. Признаки метастазов
в печень и поджелудочную железу помогает
выявить ультразвуковое
сканирование и КТ,
а для определения перехода РЖ на соседние
органы и распространение его по брюшине
можно перед операцей выполнить
диагностическую
лапароскопию.
Лечение РЖ.
В настоящее время основным методом
лечения РЖ, как раннего, так и далеко
зашедшего, является хирургическая
операция.
Первым успешную
резекцию желудка по поводу рака выполнил
профессор хирургической клиники в Вене
Теодор Бильрот в 1881 году (рис 18). С этой
даты началось быстрое развитие желудочной
хирургии. Бильрот предложил два способа
резекции желудка: наложение анастомоза
между остающимися отделами конец-в-конец
(Бильрот I)
и ушивание культей желудка и
двенадцатиперстной кишки с наложением
анастомоза между желудком и начальной
петлей тощей кишки бок-в-бок (Бильрот
II).
Дальнейшие модификации этих операций
связаны с именами таких известных
хирургов первой половины 20 века, как
Кохер, Гофмейстер, Финстерер, Ру, Хаберер
и др.
Вопрос об объеме
операции при РЖ до настоящего времени
однозначно не решен (рис 19). По мнению
одних хирургов, методом выбора является
субтотальная резекция желудка с
обязательным удалением регионарных
лимфатических узлов единым блоком.
Другие считают возможным выполнение
экономных резекций, но с лимфоаденодиссекцией
в максимальном объеме, третьи допускают
возможность обширных комбинированных
операций с удалением соседних с желудком
органов при распространении на них
рака. Трудность в выработке рациональной
хирургической тактики у каждого
конкретного больного заключаются в
том, что до настоящего времени нет
точного метода интраоперационного
определения распространенности опухоли
как по желудку, так и по лимфатическим
путям. Экспресс-методы исследования
биоптатов, взятых во время операции, не
всегда точны и значительно увеличивают
продолжительность операции. Размеры
опухоли не могут считаться критерием,
так как даже при малых раках встречаются
не только регионарные, но и отдалённые
метастазы.
Наиболее часто
выполняемыми при РЖ радикальными
операциями являются: 1) Дистальная
субтотальная резекция желудка
– удаление большей части желудка с
большим и малым сальником и оставлением
кардиальной части и купола с небольшим
участком большой кривизны (при раке
выходного отдела желудка); анастомоз
между культей желудка и двенадцатиперстной
кишкой;
2) Проксимальная
субтотальная резекция желудка
– то же, но с оставлением части
пилорического отдела (при раке
проксимальной части желудка); анастомоз
между пищеводом и культей желудка);
3) Тотальная
гастрэктомия
– удаление всего желудка с большим и
малым сальником, желудочными связками
и прилегающими к желудку участками
двенадцатиперстной кишки и пищевода,
(при поражении большей части желудка и
высокой локализации рака, а так же при
диффузном росте раковых опухолей);
эзофагоеюноанастомоз.
При любой из
этих операций с онкологической точки
зрения целесообразно выполнение
лимфоаденодиссекции
– максимально
возможное удаление регионарных
лимфатических узлов по ходу левой
желудочной, селезёночной, кишечной
(a.celiaca)
и общей печёночной артерий
Объем операции
при ранних РЖ определяется в зависимости
от локализации опухоли и опыта хирурга.
Противопоказаниями
к радикальной операции при РЖ по мнению
большинства хирургов и онкологов,
являются: чрезмерное распространение
опухоли за пределами желудка (переход
на поджелудочную железу, печень,
забрюшинную клетчатку), метастазы в
отдаленные органы, диссеминация рака
по брюшине или тяжелое состояние
больного, вызванное серьёзными
сопутствующими заболеваниями или
преклонным возрастом. В этих случаях
возможно выполнение той или иной
паллиативной операции, направленной
на сохранение нарушенного пассажа пищи
по пораженному желудку или предупреждении
осложнений: кровотечения, перфорации,
непроходимости.
Самым частым
паллиативным вмешательством является
гастроэнтеростомия,
предпринимаемая для ликвидации или
предупреждения непроходимости выходного
отдела желудка. При сужении или закрытии
входа в желудок накладывают
эзофагогастростомию
или вводят трубку для питания
непосредственно в желудок через
гастростому.
При тотальном поражении желудка
приходится прибегать к еюностомии.
При кровотечении из распадающейся
опухоли или опастности перфорации
возможно выполнение паллиативной
резекции желудка.
В послеоперационном
периоде у больных РЖ возможно проведение
химиотерапии
современными противоопухолевыми
препаратами, что наиболее показано при
низкодифференцированных опухолях.
Отдаленные
результаты хирургического лечения.
По данным
G.Davis
(1983), подвергшего анализу результаты
нескольких крупных серий наблюдений
в США, хирургическое вмешательство
выполняется у 86 из каждых 100 человек с
диагностированным РЖ (рис 20). Из них у
41 пациента операция оказывается
паллиативной или носит диагностический
характер. 10 человек из этой группы
погибают в послеоперационном периоде
от различных осложнений. Из 31 больного,
перенесшего вмешательство, через 5 лет
в живых не остается никого. У 45 из 86
оперированных больных (чуть больше
половины) удается выполнить радикальную
операцию. Из них 5 человек погибают от
послеоперационных осложнений. Из 40
пациентов, перенесших операцию, спустя
пять лет продолжают жить 10 человек.
Таким образом, 5-летняя выживаемость
при хирургическом лечении РЖ составляет
лишь 10%.
А каковы результаты
хирургического лечения раннего РЖ? В
1976 году Т.Takasugi
с оавт. были опубликованы результаты
хирургического лечения 732 больных с
гистологически доказанным ранним раком
желудка (рис 21). В течение 5 лет после
операции прожили 715 человек (97,7%), а
спустя 10 и 15 лет — 705 человек (96.4%). Несколько
менее впечатляющими, но всё же очень
высокими являются результаты другой
серии наблюдений японских авторов
(T.Iwanaga
et
al.,1979):
из 510 оперированных больных ранним РЖ
5-летний барьер выживаемости преодолели
457 человек (89,6%), а 10-летний – 370 больных
(72,6%).
Таким образом,
раннее выявление опухоли служит ключом
к улучшению результатов лечения РЖ.
Методы раннего
выявления РЖ.
Опыт последних десятилетий показывает,
что наиболее эффективным средством
диагностики РЖ на начальных стадиях
является выявление среди условно
здорового населения «групп риска» по
РЖ (путём анкетирования и опроса) и
обследование их с помощью современных
рентгенологических и эндоскопических
методов, а так же активное выявление,
обследование и лечение больных
предраковыми заболеваниями желудка
(рис 22). Существенную помощь в раннем
выявлении онкологических заболеваний
могли бы оказать т.н. скрининговые методы
исследования (screening
– просеивание, отсев, отбор), которые
можно выполнять массово, среди широких
контингентов населения или в больших
по объему группах риска. В настоящее
время к скрининговым методикам по РЖ
можно отнести только крупнокадровую
флюорографию желудка, да и то лишь
условно, в связи с высокой её стоимостью.
В последние
десятилетия активно ведутся поиски
специфических раковых маркеров. Маркеры
– гликопротеиды с антигенными свойствами
часто обнаруживаются в тканях и жидкостях
плодов, но потом они исчезают и появляются
лишь при развитии опухолевых процессов.
Они являются признаком дедифференциации
тканей с возвратом к эмбриональному
состоянию, что особенно характерно при
низкодифференцированных опухолях.
Онкофетальные антигены могут служить
признаком появления злокачественной
опухоли и ранних предраковых изменений.
К ним относится
карциноэмбриональный
антиген (КЭА).
Его обнаруживают в крови у 4-5% и в
желудочном соке у 50% больных ранним
раком желудка. Однако его нельзя считать
строго специфическим для РЖ, т.к. он
определяется и у больных раком толстой
кишки. Для массового скрининга используют
фетальный
сульфогликопротеиновый антиген (ФСА).
При РЖ его обнаруживают в 90-95% наблюдений.
При обследовании группы в 30.000 человек
в США у 22 из 23 с положительным ФСА в
содержимом желудка был обнаружен рак,
а у 8 с отрицательной реакцией в дальнейшем
так же была выявлена карцинома желудка.
Чувствительность метода составила 92%,
а специфичность – 73%. Трудности скрининга
заключались в необходимости получения
у обследуемых порции желудочного сока,
для чего требовалось зондирование
желудка.
К сожалению в
нашей стране широкомасштабные
профилактические обследования на
предмет выявления раннего рака в
настоящее время вряд ли возможны из-за
определенных социальных и экономических
причин.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
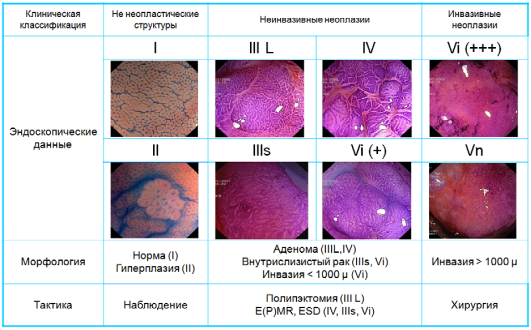
Классификация
капиллярного рельефа (Capillary
pattern
– CP)
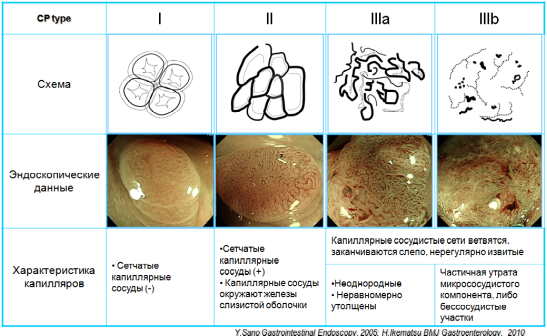
Классификация
интраэпителиальных папиллярных
капиллярных петель IPCL (J.Cohen, 2007)
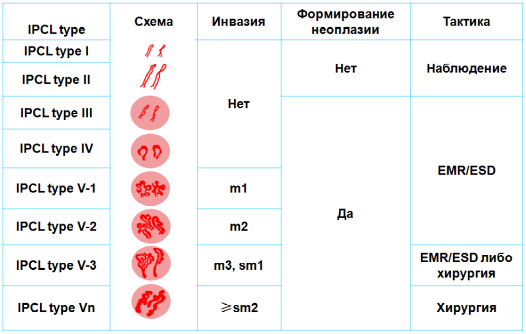
Схематическое
изображение анатомии дистального отдела
пищевода

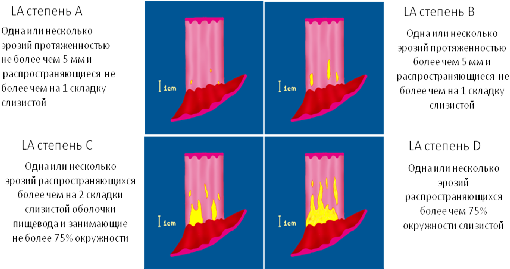
Лос-Aнжелесская
классификация эрозивных эзофагитов
(1994 год)
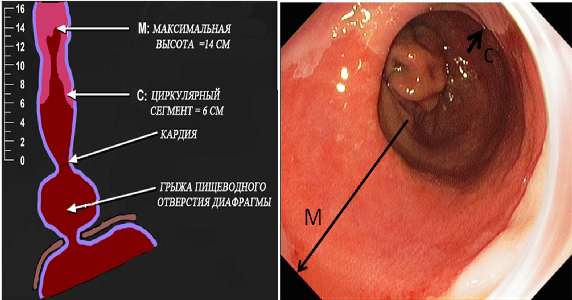
ПРАЖСКИЕ
С&M
КРИТЕРИИ ПРИ ПИЩЕВОДЕ БАРРЕТА 2004 год
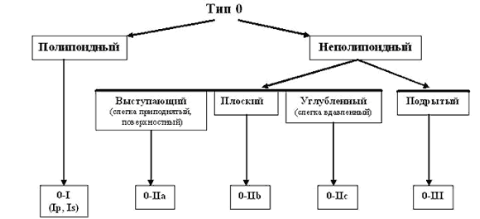
Парижская
эндоскопическая классификация опухолевых
поражений пищевода, желудка и толстой
кишки (2002).
The
Paris endoscopic classification of superficial neoplastic lesions:
esophagus, stomach and colon
Gastrointestinal
Endoscopy, Volume 58, No 6 (Suppl.), 2003
тип
– поверхностные
полипоидные или неполипоидный опухоли;
тип 1
– полипоидные опухоли, обычно на широком
основании;
тип
2 – язвенные
опухоли с четко отграниченными и
поднятыми краями;
тип
3 –
инфильтративно–язвенные опухоли без
четких границ;
тип
4
–диффузно–инфильтративные (неизъязвленные)
опухоли;
тип
5 –
неклассифицируемые (неподдающиеся
классификации) запущенные опухоли.
Эндоскопические
классификации варикозно-расширенных
вен пищевода
1.
N.Soehendra,
K.
Binmoeller
(1997)
ВРВ
пищевода:
1
степень – диаметр вен не превышает 5
мм, вытянутые, располагаются только в
нижней трети пищевода;
2
степень – диаметр вен 5 -10 мм, извитые,
распространяются в средней трети
пищевода;
3
степень – размер вен более 10 мм,
напряженные с тонкой стенкой, расположены
вплотную друг к другу, на поверхности
вен «красные маркеры».
ВРВ
желудка:
1
степень – диаметр вен не более 5 мм, едва
различимы над слизистой желудка;
2
степень – вены размером 5-10 мм,
солитарно-полипоидного характера;
3
степень – вены диаметром более 10 мм,
представляют обширный конгломерат
узлов.
2.
К.-J.
Paquet
(1983) (рис.1А):
I
– единичные эктазии вен (рентгенологически
не определяются).
II
– единичные хорошо отграниченные стволы
вен, которые при попытке инсуффляции
остаются отчётливо выраженными, нет
истончения эпителия на венах.
III
— отчётливое сужение просвета пищевода
стволами ВРВ, расположенными в нижней
и средней трети пищевода, которые
частично уменьшаются только при сильной
инсуффляции воздуха. На верхушках ВРВ
единичные красные маркеры или ангиэктазии.
IV
— просвет пищевода полностью выполнен
варикозными узлами даже при максимальной
инсуффляции. Эпителий над венами
истончён. На верхушках вариксов
определяются эрозии и/или ангиэктазии.
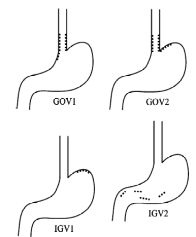
3.
Sarin
(1992)
в
зависимости от локализации выделил 4
подтипа желудочных вариксов, отмечая
их более частое появление при
нецирротической портальной гипертензии
и внепеченочной обструкции портальной
вены (рис 1Б.):
GOV1
– гастроэзофагеальные вариксы,
соединенные с пищеводными венами вдоль
малой кривизны желудка;
GOV2
– гастроэзофагеальные вариксы,
соединенные с пищеводными венами вдоль
свода желудка.
IGV1
– изолированные желудочные вариксы
свода желудка.
IGV2
– изолированные вариксы в теле или
антральном отделе желудка или в первой
части 12–перстной кишки.
5.
Японское
научное общество по изучению портальной
гипертензии в 1991 году опубликовало
основные правила для описания и
регистрации эндоскопических признаков
ВРВ пищевода и желудка. Правила содержат
6 основных критериев, согласно которым
оценивается состояние варикозно
измененных вен как до, так и после
лечебных воздействий.
Локализация
– эта характеристика требует определения
распространённости ВРВ вдоль пищевода,
а при выявлении вен желудка, оценивается
их расположение относительно кардии:
нижняя
треть пищевода –Li;средняя
треть – Lm;верхняя
треть – Ls;ВРВ
желудка – Lg:
—
располагающиеся в кардии – Lg-c;
—
отдалённые от кардии – Lg-f.
2.
Форма
(вид и размер) – данным показателем
оценивается внешний вид и размер ВРВ,
при этом обнаруживают:
отсутствие
вен – F0;короткие,
малого калибра ВРВ – F1;умеренно
расширенные, извитые ВРВ – F2;значительно
расширенные, узловатые ВРВ – F3.
3.
Цвет
– этой категорией отражается толщина
стенки ВРВ. Синий цвет указывает на
значительное её истончение
белый
– Cw;cиний
– Cb.
4.
“Красные
маркёры” стенки
– среди них выделяют:
пятна
“красной вишни”- CRS;гематоцистные
пятна – HCS;телеангиэктазии
– TE.
5.
Признаки кровотечения – при остром
кровотечении требуется установить его
интенсивность, а в случае гемостаза
оценить характер тромба.
—
в период кровотечения:
—
струйное;
—
в виде просачивания;
—
после достижения гемостаза:
—
красный тромб;
— белый тромб.
6.
Изменения слизистой пищевода – они
могут быть как проявлением рефлюксной
болезни, нередко сочетающейся с
заболеваниями, протекающими с синдромом
портальной гипертензии, так и следствием
лечебного эндоскопического воздействия.
эрозия
– E;язва
– U;рубец
– S.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Полип желудка — это ненормальное разрастание ткани, исходящей из слизистой оболочки желудка. Они встречаются довольно-таки редко и обычно не вызывают клинических симптомов. Полипы желудка диагностируются, когда доктор проводит исследование по какой-либо другой причине.
Дальнейшее отношение к выявленному во время видеоэзофагогастродуоденоскопии (ВГДС) полипу зависит от его гистологической верификации, этиологии (причины возникновения), естественной истории (развитие в динамике). После оценки полученных данных решается вопрос о необходимости лечения в данном клиническом случае или о проведении динамического наблюдения.
Классификация полипов желудка
Наиболее рациональным является классифицирование полипов по клиническим, морфологическим и гистологическим признакам. Чаще всего полипы имеют бессимптомное течение. Однако, осложненный вариант может проявляться кровотечением (признаки анемии, кровь в стуле), непроходимостью (тошнота, рвота), гастритоподобным течением (боли в верхних отделах живота) и малигнизацией (снижение массы тела и др. симптомы онкологического заболевания).
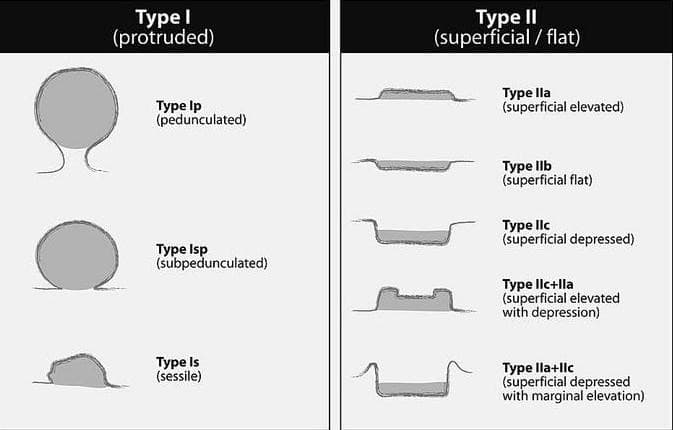
По морфологическим критериям полипы разделяют на солитарные (одиночные) и множественные, мелкие и крупные, мягкие и плотные. Учитывая, что видеогастроскопия является «золотым» стандартом в диагностике данной патологии, во всем мире признанной является Парижская классификация эпителиальных новообразований, согласно которой выделяют выступающие (0-Ip – на узкой ножке, 0-Isp – на зауженном основании, 0-Is – сидячие) и поверхностные (0-IIa – приподнятые, 0-IIb – поверхностные плоские, 0-IIc – слегка углубленные, смешанные варианты).
Ключевым моментом при выполнении эндоскопического исследования является не только правильная интерпретация найденного образования, но и возможность забора материала с последующим гистологическим подтверждением, что главным образом влияет на дальнейшую тактику лечения. В связи с этим представлены четыре группы полипов с их подробными характеристиками.
Полипы фундальных желез
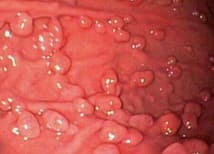 Наиболее частый тип полипов, выявляемых при ЭГДС. По данным крупных современных исследований, фундальные полипы желудка диагностируются приблизительно в 6% пациентов, которым проводится ЭГДС. Это, в свою очередь, cоставляет около 74% всех полипов желудка, подтвержденных гистологической оценкой. Эндоскопически фундальные полипы желудка обычно множественные, небольшие (менее 10 мм), с гладкой поверхностью, блестящие и макроскопически «сидячие» (0-Is по Парижской классификации 2002-2005 гг.)
Наиболее частый тип полипов, выявляемых при ЭГДС. По данным крупных современных исследований, фундальные полипы желудка диагностируются приблизительно в 6% пациентов, которым проводится ЭГДС. Это, в свою очередь, cоставляет около 74% всех полипов желудка, подтвержденных гистологической оценкой. Эндоскопически фундальные полипы желудка обычно множественные, небольшие (менее 10 мм), с гладкой поверхностью, блестящие и макроскопически «сидячие» (0-Is по Парижской классификации 2002-2005 гг.)
При хромоскопии и узкоспектральной эндоскопии (NBI) поверхность представлена рисунком по типу «пчелиных сот» с густой сосудистой архитектоникой. Изначально фундальные полипы связывали с гамартомами (образованиями, представляющими тканевую аномалию развития), однако, в большом числе исследований подтверждено, что механизмы, подавляющие секрецию соляной кислоты ингибиторами протонной помпы (ИПП), могут также участвовать в патогенезе развития фундальных полипов желудка.
Гистологически фундальные полипы представлены дилятированными (расширенными) кислотопродуцирующими железами, покрытыми плоскими париетальными и слизистыми клетками без признаков дисплазии. Выявление характерных полипов желудка у пациентов, принимающих ИПП, с большой долей вероятности диагностируют как полипы фундальных желез. При первичном осмотре один или более представленных полипов после взятия биопсии подвергают морфологической оценке для подтверждения диагноза. Большие полипы (более 10 мм), эрозированные, расположенные нетипично, например, в антральном отделе желудка, должны быть подвергнуты более агрессивной тактике ведения – эндоскопической полипэктомии.
Гиперпластические полипы
Это воспалительная пролиферация фовеолярных клеток желудка (муцин — продуцирующих эпителиальных клеток). Гиперпластические полипы желудка связывают с атрофией слизистой, вызванной инфицированием H.pylori или аутоиммунными гастритами. Однако, в последнее время встречается все больше случаев выявления таких полипов на фоне нормальной или реактивной слизистой, не связанной с сопутствующей инфекцией. Гиперпластические полипы в равной степени встречаются у мужчин и женщин на 6 -7 декадах жизни. Наиболее частая локализация – это антральный отдел желудка.
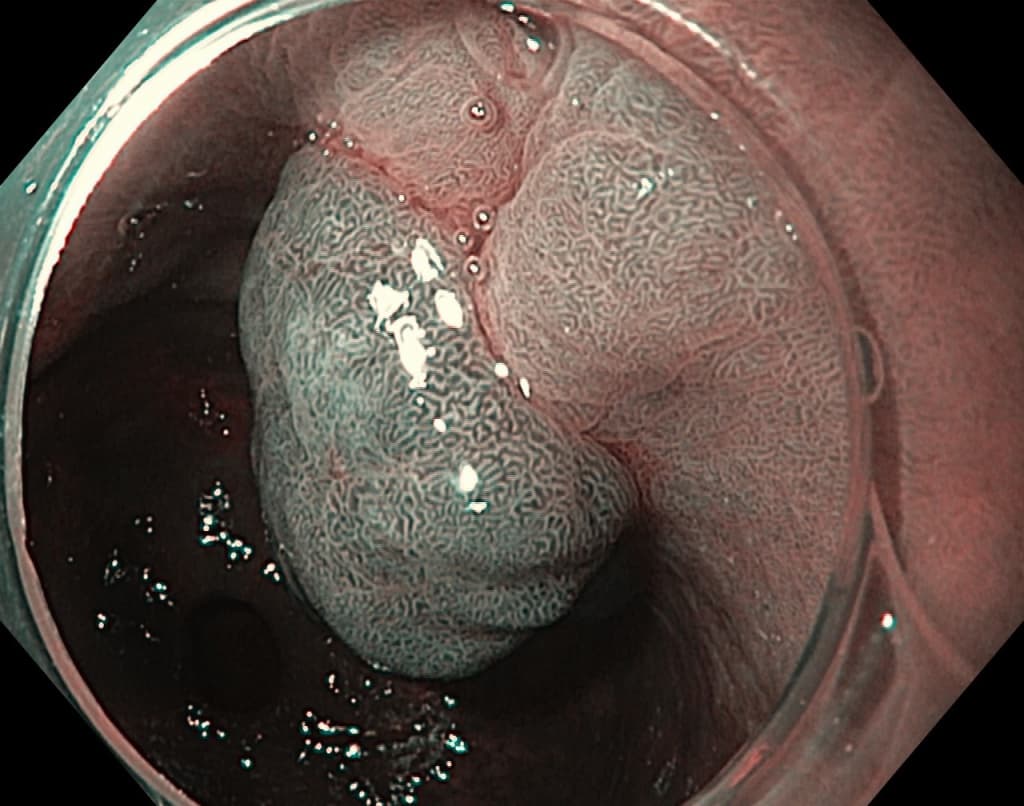 Эндоскопически они обычно гладкие, куполообразные (0-Is, 0-Isp тип), размерами от 5 до 15 мм в диаметре, хотя могут быть намного больше. Большие полипы становятся дольчатыми, расположенными на ножке (0-Ip тип), поверхность эпителия полипа нередко эрозирована, что может являться причиной хронической кровопотери и железодефицитной анемии. Редко поступают пациенты с признаками высокой непроходимости, вследствие обтурации или пролабирования полипа через привратник. Гиперпластические полипы возникают как гиперпролиферативный ответ на повреждение слизистой (эрозии, язвы). Длительное химическое воздействие соляной кислоты и наличие инфекции H.pylori могут быть первоначальной ступенью в их развитии.
Эндоскопически они обычно гладкие, куполообразные (0-Is, 0-Isp тип), размерами от 5 до 15 мм в диаметре, хотя могут быть намного больше. Большие полипы становятся дольчатыми, расположенными на ножке (0-Ip тип), поверхность эпителия полипа нередко эрозирована, что может являться причиной хронической кровопотери и железодефицитной анемии. Редко поступают пациенты с признаками высокой непроходимости, вследствие обтурации или пролабирования полипа через привратник. Гиперпластические полипы возникают как гиперпролиферативный ответ на повреждение слизистой (эрозии, язвы). Длительное химическое воздействие соляной кислоты и наличие инфекции H.pylori могут быть первоначальной ступенью в их развитии.
Гистологическая характеристика включает удлиненные, искаженные, разветвленные, дилятированные фовеолярные железы с богато васкуляризованной стромой на фоне хронического воспаления. Показано, что в 1 — 20 % полипов могут скрываться фокусы диспластических изменений. В целом, распространенность очага карциномы составляет менее 2 % и, как правило, в полипах размерами более 20 мм. В связи с потенциальным риском развития рака желудка, все гиперпластические полипы более 10 мм в диаметре следует полностью удалять. Резекция полиповидных образований всегда должна быть дополнена взятием образцов интактной слизистой, которые содержат информацию о распространенности и тяжести воспалительных и атрофических изменений в окружающей слизистой оболочке (по морфологической классификации OLGA). В результате — определяется стратификация риска развития рака желудка.
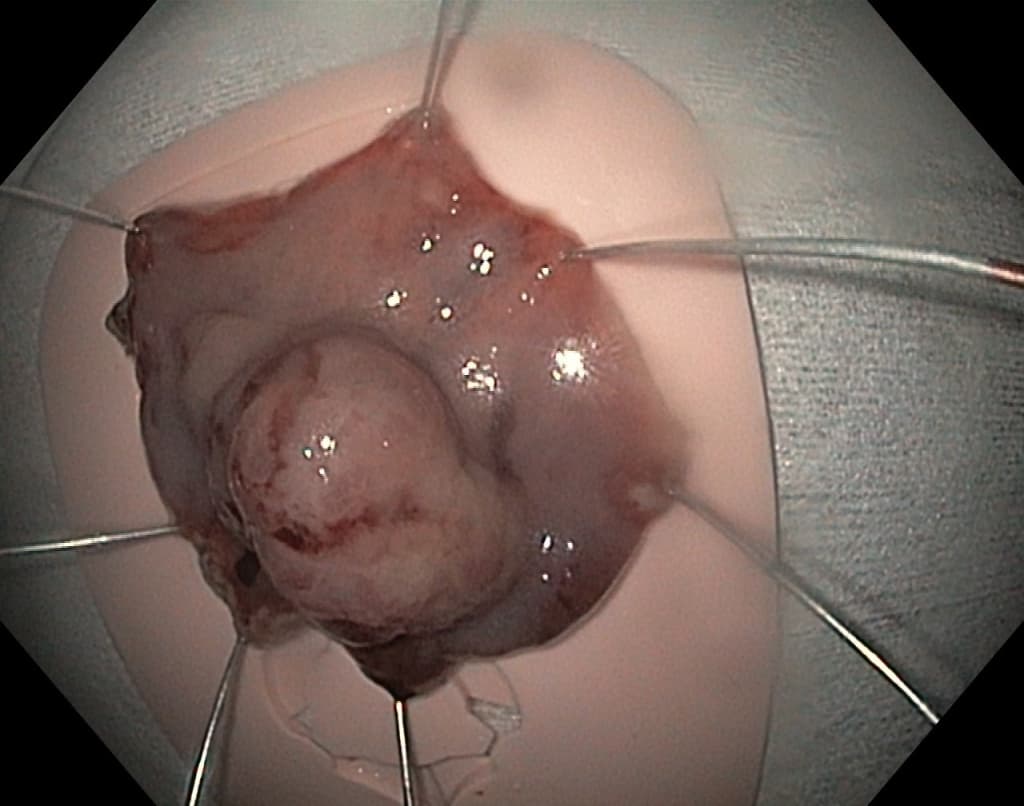 По современным представлениям, необходимо выполнить эрадикацию H.pylori с последующей оценкой между 3 и 6 месяцами после терапии для подтверждения успешного лечения. Во многих случаях оставленные маленькие гиперпластические полипы могут регрессировать или исчезнуть вовсе. Пациенты с III и IV стадиями по классификации OLGA (умеренная диффузная или тяжелая атрофия слизистой, наряду с распространенной кишечной метаплазией) должны проходить последующее эндоскопическое наблюдение не реже 1 раза в год, так как риски развития рака желудка в данном случае повышаются более чем в 6 раз.
По современным представлениям, необходимо выполнить эрадикацию H.pylori с последующей оценкой между 3 и 6 месяцами после терапии для подтверждения успешного лечения. Во многих случаях оставленные маленькие гиперпластические полипы могут регрессировать или исчезнуть вовсе. Пациенты с III и IV стадиями по классификации OLGA (умеренная диффузная или тяжелая атрофия слизистой, наряду с распространенной кишечной метаплазией) должны проходить последующее эндоскопическое наблюдение не реже 1 раза в год, так как риски развития рака желудка в данном случае повышаются более чем в 6 раз.
Аденома желудка
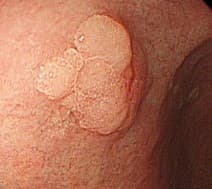 Наиболее частый желудочный неопластический полип – это эпителиальное диспластическое разрастание ткани, часто называемое аденомой, по современной номенклатуре ВОЗ-интраэпителиальная неоплазия. В западном, индустриально развитом мире, H.pylori – связанные аденомы желудка становятся редки, насчитывая менее 1%, хотя встречаемость рака желудка и аденом в регионах Восточной Азии остается высокой, около четверти всех полипов. Как и гиперпластические полипы, аденомы желудка встречаются с одинаковой частотой у мужчин и у женщин, на 6-7 декадах жизни.
Наиболее частый желудочный неопластический полип – это эпителиальное диспластическое разрастание ткани, часто называемое аденомой, по современной номенклатуре ВОЗ-интраэпителиальная неоплазия. В западном, индустриально развитом мире, H.pylori – связанные аденомы желудка становятся редки, насчитывая менее 1%, хотя встречаемость рака желудка и аденом в регионах Восточной Азии остается высокой, около четверти всех полипов. Как и гиперпластические полипы, аденомы желудка встречаются с одинаковой частотой у мужчин и у женщин, на 6-7 декадах жизни.
Эндоскопически они представлены солитарным одиночным образованием дольчатой формы с бархатистой поверхностью. Хотя они могут быть найдены в любом отделе, наиболее часто локализуются в антральном отделе желудка.
Аденомы желудка состоят из диспластических эпителиальных клеток, которые часто появляются на фоне атрофии и интестинальной метаплазии слизистой, естественным образом связанными с инфекцией H.pylori. Аденомы могут быть рассмотрены как часть последовательной цепочки от дисплазии к раку желудка. Имеется прямо пропорциональная связь — чем больше аденоматозный полип, тем выше вероятность наличия в нем фокуса аденокарциномы. Учитывая тот факт, что аденома, возникающая на фоне хронического атрофического гастрита, является предшественником аденокарциномы, должно быть рекомендовано полное удаление (резекция) всех аденоматозных полипов с оценкой тяжести воспалительных и атрофических изменений слизистой желудка. Важно то, что аденома – это неопластическое образование, и поэтому всех пациентов с выявленными аденомами необходимо внести под эндоскопическое наблюдение, несмотря на стадию атрофии слизистой. Эрадикационная терапия H.pylori с последующим подтверждением эффективности лечения также должна быть оценена в ходе гистологического исследования.
Нейроэндокринные опухоли (НЭО)
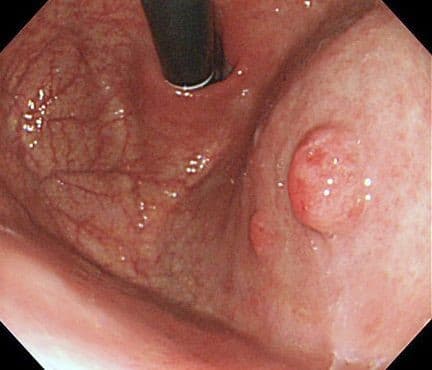 Карциноиды – нейроэндокринные опухоли, исходящие из энтерохромаффинноподобных (ЭХ) клеток. НЭО составляют менее 2% полиповидных образований, желудка и подразделяются на три основных типа.
Карциноиды – нейроэндокринные опухоли, исходящие из энтерохромаффинноподобных (ЭХ) клеток. НЭО составляют менее 2% полиповидных образований, желудка и подразделяются на три основных типа.
- НЭО I типа составляют 70-80% всех нейроэндокринных опухолей. Они ассоциированы с гипергастринемией вследствие аутоиммунного атрофического гастрита, более того, они встречаются у пожилых пациентов, чаще женщин с атрофическим гастритом на фоне пернициозной анемии. Эти образования обнаруживаются случайно, они маленькие (менее 10 мм), множественные, морфологически состоящие из эндокринных клеток с низким пролиферативным индексом (не склонны к озлокачествлению).
- НЭО II типа связаны с гипергастринемией вследствие гастрин-секретирующей опухоли. Она является одной из составляющих таких синдромов как МЭН-1 и Золлингера-Эллисона. Этот тип опухоли достаточно редок, составляет лишь 5 – 8 % всех НЭО. В этом случае опухоль менее 1 см, без характерных инфильтративных изменений, окружающая слизистая оболочка либо нормальная, либо умеренно воспалена, но без атрофических явлений. НЭО желудка I и II типов могут быть удалены эндоскопически, с последующим подавлением секреции гастрина медикаментозно.
- НЭО III типа встречаются спорадично. Составляют около 20% всех НЭО и обычно обнаруживаются при появлении клинической симптоматики (боль в эпигастрии) или при эрозировании слизистой (проявляется кровотечением), или при обнаружении метастазов (наличие карциноидного синдрома – гиперемия кожи, диарея, бронхоспазм, патология клапанной системы сердца). Данный тип опухоли имеет склонность к достижению размеров более 1,5 см, с полиморфными изменениями слизистой (эрозирование, зоны некроза, инфильтрации слизистой). Пролиферативный индекс (KI-67, индекс митотической активности) составляет более 20%, что говорит о злокачественном течении заболевания, требующего хирургической тактики лечения.
Лечение полипов желудка
Как говорилось ранее, все аденоматозные и крупные полипы более 10 мм должны быть подвергнуты удалению. Каким же образом выполняется эндоскопическая полипэктомия или резекция слизистой?
После четкого определения границ образования, под его основание в подслизистый слой выполняется инъекция физиологического раствора, окрашенного красителем «индигокарминовый синий» с целью предотвращения перфорации и четкой визуализации сосудистых структур. Затем эндоскопическая петля позиционируется на неизмененной слизистой вокруг образования и постепенно затягивается. Далее выполняется электрокоагуляция с использованием электрохирургического ножа/блока. Пострезекционный дефект с белым струпом без «плюс ткани» говорит о радикальности и надежности оперативного вмешательства, тем самым исключая возможные осложнения. Этапы операции представлены на рисунках (в нашей Клинике используется нож — ERBE VIO 300D).
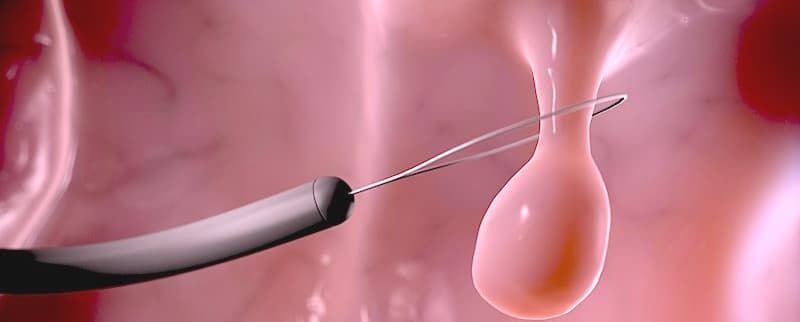
Крупные экзофитные (выступающие) полипы на широком основании или плоские образования, которые невозможно удалить эндопетлей, подвергаются технически более сложному варианту эндоскопического удаления – диссекции в подслизистом слое. Данный вид операции направлен на радикальное удаление образования единым блоком: после создания «гидростатической подушки» выполняется циркулярный разрез вокруг образования специальными инструментами, после чего рассекаются соединительнотканные сплетения подслизистого слоя с полной ликвидацией патологического очага.
Послеоперационное наблюдение
Первые сутки после полипэктомии рекомендуется щадящий режим активности и питания. Как упоминалось ранее, на месте полипа остается пострезекционный дефект слизистой оболочки, в связи с чем назначается противоязвенная диета — стол №1 по Певзнеру. Суть его заключается в ограничении продуктов, стимулирующих секрецию в желудке, длительно задерживающихся и трудно перевариваемых блюд (острая, жирная, жареная пища). Такая диета и ограничение физических нагрузок соблюдаются в течение месяца. Также необходимо помнить об отказе от приема антикоагулянтов в течение 3 дней как перед, так и после операции, в целях предотвращения ранних и отсроченных кровотечений.
По современным представлениям, наиболее рациональным является наблюдение за пациентами после проведенной полипэктомии через 1 год. При этом оценивается состояние слизистой оболочки на предмет появления новых образований или рецидива на месте ранее выполненной операции. Если же после резекции образований гистологический ответ подтверждает наличие дисплазии высокой степени или же раннего рака, то контрольная гастроскопия должна проводиться в интервале: 1,5 мес.- 3 мес.- 6 мес. – 1 год и в последующем каждый год.
Профилактика полипов желудка
Целью профилактики является выявление образований желудка на ранних этапах развития. Рекомендуется выполнение эндоскопического исследования лицам старше 45 лет в качестве скрининга даже при отсутствии клинической симптоматики, так как заболевание проявляет себя лишь на поздней стадии, когда уже требуется хирургическое лечение. Следуя принципам онкологической настороженности, пациентам с отягощенным наследственным анамнезом, то есть при наличии онкологических заболеваний со стороны ЖКТ у ближайших родственников, требуется незамедлительный профилактический осмотр желудка и толстой кишки.
Как получить услугу в Клинике
В нашей Клинике проводятся все виды эндоскопических исследований на высококачественном оборудовании как под местной анестезией, так и под наркозом. Все выявленные патологические образования подвергаются гистологической верификации. Также проводится забор материала на наличие инфекции H.pylori и для определения стадии и степени выраженности воспалительных и атрофических изменений слизистой оболочки желудка (класс.OLGA), что свидетельствует, как говорилось ранее, о риске развития онкологического процесса.
Что касается оперативного эндоскопического лечения, то в клинике возможно его выполнение в амбулаторных и стационарных условиях. Решение принимает лечащий врач, опираясь на размеры патологических очагов, их количество, результаты гистологии и сопутствующую патологию.

