Иммунотерапия при раке желудка
Новости онкологии
19.01.2016
 Владимирова Любовь Юрьевна
Владимирова Любовь Юрьевна
Руководитель отдела лекарственного лечения опухолей
ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России,
председатель регионального отделения RUSSCO, член правления RUSSCO,
доктор медицинских наук, профессор,
Ростов-на-Дону
Несмотря на определенный прогресс в лечении рака желудка, прогноз больных остается неблагоприятным. За последние несколько лет был получен определенный успех при иммунотерапии меланомы, в лечении которой ее применили впервые, а также при раке молочной железы, раке почки, раке предстательной железы и при немелкоклеточном раке легкого. Поэтому журнал Science в 2013 году назвал иммунотерапию «прорывом года» [1]. Интерес к иммунотерапевтическим подходам в лечении рака желудка все больше возрастает.
Роль иммунной системы
Известно, что иммунная система позволяет отличать «свое» от «чужого». В гипотезе иммуновыживаемости раковых клеток была представлена концепция, согласно которой иммунная система способна находить и уничтожать появившиеся злокачественные клетки [2-4]. Первоначально эта теория была отвергнута, но постепенно в эксперименте были получены весомые доказательства, и теперь они являются частью теории «иммуноредактирования» рака [5].
Этот процесс имеет 3 основные фазы: устранения («elimination»), равновесия («equilibrium») и избегания («escape»). Во время фазы элиминации рост и размер клеток опухоли могут вызывать изменения в микроокружении и локальное повреждение. Клетки иммунной системы, такие как натуральные киллеры и Т-клетки натуральные киллеры, секретируют гамма-интерферон и цитокины, а также осуществляют ингибирование ангиогенеза и пролиферацию клеток опухоли. Затем антигенпрезентирующие дендритные клетки поглощают опухолевые антигены и активируют Т-лимфоциты для развития иммунного ответа. Самой продолжительной из всех трех фаз является фаза равновесия. В этом процессе CD8+Т-клетки, дендридные клетки и опухолевые клетки находятся в фазе динамического баланса и опухолевые клетки находятся в покое. К сожалению, во время этого долгого процесса генетически нестабильные опухолевые клетки могут выживать, приобрести резистентность, и это приводит к фазе избегания.
Другим важным этапом было выделение первого антигена опухолей человека, распознаваемого Т-клетками [6]. Это стало возможно в результате клонирования гена MAGE (melanoma antigen-encoding gene), который кодирует антигены, распознанные цитотоксическими Т-клетками. Это открытие было не только новым доказательством способности нашей иммунной системы находить и разрушать опухолевые клетки, но также впервые была определена молекулярная природа этих антигенов.
Иммунотерапия: вакцины против рака
Вакцина против рака создана с целью усиления способности иммунной системы человека распознавать и разрушать опухолевые клетки путем стимулирования опухолеспецифичных Т-лимфоцитов. В частности, опухолевые антигены должны быть распознаны Т-клетками с помощью специальных антиген-презентирующих клеток (например, дендритных клеток). Обычно эти антигены представляют собой малые внутриклеточные пептиды, которые на поверхности опухолевых клеток имеют молекулы главного комплекса гистосовместимости и распознаются Т-клетками. Молекулы комплекса гистосовместимости I класса отвечают за презентацию антигена СD3+ CD8+, а II класса – СD3+СD4+.
В настоящее время были обнаружены и изучены тысячи опухолевых антигенов. Ген MAGE, впервые найденный у больных меланомой, представлен по-разному в различных солидных опухолях, но он также присутствует на нормальных клетках, не проявляя себя. Другие найденные потенциальные антигены являются пептидами, связанными с мутациями (например, KRAS и связанные с ним мутации), антигены дифференцировки, антигены избыточной экспрессии (например, HER2/neu и раково-эмбриональный антиген) и вирусные антигены (например, HPV).
Рак желудка экспрессирует MAGE в 38% случаев. В доклинических исследованиях показано, каким образом Helicobacter pilori может индуцировать экспрессию МАGE-3 [7,8]. Нановакцина, нагруженная пептидом МАGE-3 с целью усилить иммунный ответ, была изучена на мышиной модели рака желудка. В результате была получена регрессия опухоли [9]. Японскими учеными проведена I/II фаза исследования на 22 больных с распространенным раком желудка с использованием пептидов от VEGF-R1 и VEGF-R2 совместно с применением S-1 и цисплатина. В результате была получена частичная регрессия у 55% больных и увеличение продолжительности общей выживаемости [10]. Кроме того, опухолевые антигены, связанные с HER2/neu, обычно избыточно экспрессируемые при раке желудка, могут играть важную роль в развитии новых подходов к иммунотерапии и вакцинации.
Адоптивная иммунотерапия (или иммунотерапия «адоптивными клетками») является еще одним видом иммунотерапии. Опухолево-специфичные Т-клетки забирают у больного и культивируют in vitro. Затем эти клетки реинфузируются больному в больших количествах. В настоящее время генетическая модификация этих клеток in vitro до их возвращения имеет особое значение. Можно использовать различные типы клеток в качестве активированных киллеров. Некоторые из них были изучены при раке желудка, в том числе лимфоциты, инфильтрирующие опухоль [11].
В одном из последних исследовании у 44 больных с распространенным раком желудка были использованы тумор-ассоциированные лимфоциты в комбинации с или без химиотерапии [12]. Результаты показали, что общая выживаемость была лучше в группе комбинации химиотерапии с тумор-ассоциированными лимфоцитами. Более того, при раке желудка были исследованы цитокин-индуцированные киллеры [13,14]. Клинические исследования подтвердили что больные, которых лечили химиотерапией в комбинации с цитокин-индуцированными киллерами, обработанными in vitro интерлейкином-2 совместно с антителами анти-СD-3, имели лучшую выживаемость по сравнению с больными, которым была проведена только химиотерапия. Однако высокая специфичность обработанных киллеров этого типа является крайне важной, позволяя уменьшить риск жизнеугрожающих побочных эффектов, связанных с выраженным иммунным ответом.
Ингибиторы иммунных контрольных точек
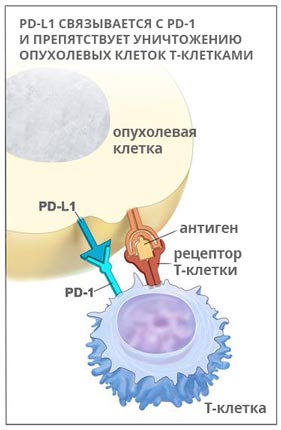
Чтобы избежать избыточной пролиферации и повреждения ткани, необходимо тщательно регулировать активность Т-клеток. В этот процесс включено несколько иммунных контрольных точек. Т-клетки экспрессируют ингибирующие рецепторы CTLA-4 и РD-1. Эти молекулы обычно появляются на поверхности Т-клеток после их активации и передают негативный сигнал. Блокада этих рецепторов с помощью антител вызывает повышенную активность Т-клеток, которая достаточно высока при многих видах опухоли.
Не так давно в геномном атласе рака были проанализированы молекулярные характеристики аденокарциномы желудка [15]. Были выделены 4 опухолевых подтипа: опухоли, позитивные по вирусу Эпштейна-Барр, микросателлитные нестабильные опухоли, геномно-стабильные опухоли и опухоли с хромосомной нестабильностью. В подгруппе с вирусом Эпштейн-Барр, составляющей 15% от всех, выявлена повышенная экспрессия РD-L1, что говорит о выраженном присутствии иммунных клеток при раке желудка и позволяет использовать ингибиторы иммунных контрольных точек.
Было проведено исследование II фазы с использованием тремелимумаба – полностью гуманизированного моноклонального антигена анти CTLA-4 – в качестве 2-й линии терапии 18 больных раком желудка [16]. Хотя объективный ответ отмечен у 5% больных, медиана выживаемости составила 4,8 мес. и соответствовала таковой при лечении рака желудка с использованием химиотерапии.
Кроме того, можно предположить, что комбинация ингибиторов из 2 блокаторов иммунного ответа может быть более эффективна у больных с распространенным раком желудка. Новый препарат MEDI 4736 является моноклональным антигеном человека IgG1, который связывается с РD-L1 и предотвращает его связывание с РD-1 и СD-80. Полученные в I фазе предварительные данные показали многообещающий клинический эффект препарата при многих видах опухоли [17]. Сегодня продолжается несколько исследований MEDI 4736 как монотерапии, так и в комбинации с иммуномодуляторами, например, тремелимумабом.
Ниволумаб – антитело, которое блокирует взаимодействие между РD-1 и соответствующим лигандом РD-L1. Ниволумаб показал впечатляющую эффективность при многих видах опухолей. В декабре 2014 FDA одобрило ниволумаб для лечения нерезектабельной или метастатической меланомы после прогрессирования на ипилимумабе (и BRAF ингибиторе при наличии BRAF V600 мутации). Позже ниволумаб получил одобрение в качестве 2-й линии лечения при плоскоклеточном немелкоклеточном раке легкого. Основой тому послужило улучшение общей выживаемости в сравнении с доцетакселом (9,2 мес. vs 6,0 мес., HR 0,59, р=0,00025).
В настоящее время при раке желудка проводится I фаза исследований этого анти-PD-1 иммуностимулирующего антитела самостоятельно или в комбинации. Доклинические исследования показали, что двойная блокада РD-1 и СТLА-4 приводила к повышению выброса цитокинов и увеличивала пролиферацию СD8+ и СD4+ Т-клеток по сравнению с блокадой одного из рецепторов [18,19]. Продолжаются исследования Ib/II фазы по изучению активности ниволумаба в монотерапии или в комбинации с ипилимумабом у больных метастатическим раком желудка, раком поджелудочной железы, трижды-негативным раком молочной железы и мелкоклеточным раком легкого [20].
Пембролизумаб является высокоспецифичным гуманизированным моноклональным IgG4 антителом, которое блокирует взаимодействие PD-1 c его лигандами PD-L1 и PD-L2. Это антитело показало обещающие результаты у 135 больных метастатической меланомой в большом исследовании I фазы (KEYNOTE-001) [21,22]. Использование пембролизумаба привело к общему ответу у 26% больных и имело управляемый профиль токсичности. На этом основании FDA одобрило его для лечения меланомы. Недавно было проведено исследование по безопасности и активности пембролизумаба у больных раком желудка в I фазе, было скринировано 165 больных распространенным раком желудка и гастроэзофагального соединения [23]. 65 больных (40%) были PD-L1 позитивными (критерием служило окрашивание PD-L1 в строме или ≥1% опухолевых клеток), 39 из них получали пембролизумаб (10 мг/кг) каждые 2 недели. У 41% больных отмечено уменьшение опухоли. Общий ответ в азиатской популяции больных составил 32%, в неазиатской – 30%. Отмечено, что лечение больные перенесли хорошо, даже несмотря на то, что они предварительно получали серьезное лечение. Далее, были получены предварительные доказательства взаимосвязи между выживаемостью без прогрессии, ответом опухоли на лечение и экспрессией PD-L1.
Иммунотерапия в настоящее время выходит на передовую позицию. Получены неожиданные результаты, особенно при лечении меланомы, при которой этот терапевтический подход позволил улучшить выживаемость. При раке желудка, несмотря на некоторые результаты, требуется дальнейшее изучение этого вопроса. Кроме того, открытие эффективных биомаркеров позволило бы сделать важный шаг в определении групп больных, где иммунотерапия была бы оптимальной. Это могло бы не только увеличить количество больных, у которых возможен эффект от лечения, но также выделить больных, у которых возможно развитие выраженной токсичности. Такой подход поможет определить экономическую выгоду от лечения. Следовательно, дальнейшие клинические исследования могли бы быть посвящены изучению потенциальных биомаркеров, таких как экспрессия PD-L1, инфильтрации иммунными клетками (например, СD8/регуляторные Т-клетки и хемокины) и использования частоты мутаций в опухоли.
Литература:
- Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science 2013; 342: 1432-1433.
- Burnet FM. Cancer: a biological approach. Brit Med J. 1957; 1: 841-847.
- Burnet FM. The concept of immunological surveillance. Prog Exp Tumor Res. 1970; 13: 1-27.
- Thomas L. Cellular and Humoral Aspects of the Hypersensitive states. Sherwood Lawrence, MD New York, Paul B. Hoeber, Inc., 1959, 667 pp.
- Dunn GP, Bruce AT, Ikeda H, et al. Cancer immunoediting: from immuno-surveillance to tumor escape. Nat Immunol. 2002; 3: 991-998.
- Van der Bruggen, Traversari C, Chomez P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science. 1991; 254: 1643-1647.
- Inoue H, Mori M, Honda M, et al. The expression of tumor-rejection antigen ‘MAGE’ genes in human gastric carcinoma. Gastroenterology. 1995; 109: 1522-1525.
- Fukuyama T, Yamazaki T, Fujita T, et al. Helicobacter pylori, a carcinogen, induces the expression of melanoma antigen-encoding gene (Mage)-A3, a cancer/testis antigen. Tumor Biol. 2012; 33: 1881-1887.
- Yang J, Li ZH, Zhou JJ, et al. Preparation and antitumor effects of nanovaccines with MAGE-3 peptides in transplanted gastric cancer in mice. Chin J Cancer. 2010; 29: 359-364.
- Masuzawa T, Fujiwara Y, Okada K, et al. Phase I/II study of S-1 plus cisplatin combined with peptide vaccines for human vascular endothelial growth factor receptor 1 and 2 in patients with advanced gastric cancer. Int J Oncol. 2012; 41: 1297-1304.
- Yamaue H, Tanimura H, Tsunoda T, et al. Clinical application of adoptive immunotherapy by cytotoxic T lymphocytes induced from tumor-infiltrating lymphocytes. Nihon Gan Chiryo Gakkai Shi. 1990; 25: 978-989.
- Kono K, Takahashi A, Ichihara F, et al. Prognostic significance of adoptive immunotherapy with tumor-associated lymphocytes in patients with advanced gastric cancer: a randomized trial. Clin Cancer Res. 2002; 8: 1767-1771.
- Jiang J, Xu N, Wu C, et al. Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells. Anticancer Res. 2006; 26: 2237-2242.
- Jiang JT, Shen YP, Wu CP, et al. Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients. World J Gastroenterol. 2010; 16: 6155-6162.
- The Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-209.
- Ralph C, Elkord E, Burt DJ, et al. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2008; 16: 1662-1672.
- Segal N. Preliminary data from a multi-arm expansion study of MEDI4736, an anti-PD-L1 antibody. J Clin Oncol. 32:5s, 2014 (suppl; abstr 3002).
- Curran MA, Montalvo W, Yagita H, et al. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Prc Natl Acad Sci USA. 2010; 107: 4275-4280.
- Duraiswamy J, Kluger H, Callahan MK, et al. Dual blockade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-cell rejection function in tumors.Cancer Res. 2013; 369: 122-133.
- Callahan M, Bendell J, Chan E, et al. Phase I/II, open-label study of nivolumab (anti-PD-1; BMS-936558, ONO-4538) as monotherapy or combined with ipilimumab advanced or metastatic solid tumor. J Clin Oncol. 32:5s, 2014 (suppl; abstr TPS3114).
- Hamid O, Robert C, Daud A, et al. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med. 2013; 369: 134-144.
- Robert C, Ribas A, Wolchok JD,e t al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet. 2014; 384: 1109-1111.
- Muro K, Bang Y, Shankaran V, et al. A phase 1b study of pembrolizumab in patients with advanced gastric cancer. Annals Onc. 2014; Suppl 5: v1-v41.
![]()
![]()
![]()
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Активная иммунотерапия рака желудка
Своевременное хирургическое лечение рака желудка может привести к полному выздоровлению. Однако, на поздних стадиях заболевания, когда проведение радикальной хирургической операции является невозможным, прогноз течения болезни неблагоприятный, несмотря на проводимое химиотерапевтическое лечение. Иммунотерапия, направленная на усиление противоопухолевого иммунитета пациента, рассматривается как эффективное дополнение к хирургическому лечению этого заболевания.
Индуцирующий курс лечения включает в себя 10 подкожных вакцинаций и занимает примерно 3 месяца. Дальнейшее лечение назначается в зависимости от стадии болезни и состояния пациента. Лечение проводится в амбулаторных условиях. Возможно повышение температуры до 38°C и развитие гриппоподобного состояния в течение первых 24 ч после вакцинации. Индуцируемые вакцинациями иммунные процессы разрушают опухолевые клетки и препятствуют развитию рецидива болезни.

Наш опыт свидетельствует о том, что клинический эффект
активной иммунотерапии разной степени выраженности продолжительностью не менее 6 месяцев
может быть достигнут у значительной части пациентов с IV стадией рака желудка.
Примеры эффективного применения иммунотерапии
в лечении метастатического рака желудка
Пациентка И, 44 лет с диагнозом перстневидно-клеточный рак желудка была подвергнута комбинированнойя гастрэктомии и затем 1 курсу полихимиотерапии. Через 2 месяца была отмечена прогрессия заболевания. По результатам УЗИ были выявлены увеличенные лимфоузлы в воротах печени и в забрюшинном пространстве. В связи с этим, вакцинотерапия была начата в усиленном режиме. Лечение переносила хорошо. В месте инъекции вакцины отмечалась болезненность и покраснение, проходящие через несколько часов.
Через 3 месяца после начала иммунотерапевтического лечения при очередном обследовании в воротах, в эпигастральной области, а также в забрюшинном пространстве лимфоузлы не визуализировались. В анализах крови отмечены уменьшение СОЭ до нормы, повышение гемоглобина. При всех последующих обследованиях патологических изменений выявлено не было. Через 2 года после начала вакцинотерапии состояние пациентки удовлетворительное, жалоб нет.
Пациент И, 54 года с диагнозом: низкодифференцированная аденокарцинома желудка, множественные MTS в левом легком (состояние после лучевой терапии и химиотерапии). Начал получать иммунотерапевтическое лечение в состоянии средней степени тяжести. Беспокоили слабость, утомляемость, периодическая рвота (чаще в утреннее время суток), субфебрилитет. На фоне лечения отмечено повышение температуры до 38,5º С и снижение аппетита. Через 3 месяца состояние ухудшилось: рвота ежедневно в вечернее время суток после приема пищи, потеря веса 1-2 кг за месяц. Появились боли в эпигастральной области. Однако через 5 месяцев после начала вакцинотерапии общее состояние пациента улучшилось, показатели крови были в пределах нормы, СОЭ 15 мм/ч.
По данным УЗИ в нижнем полюсе правой почки визуализировалось тканевое образование с ровным контуром до 15 мм в диаметре. Было отмечено снижение частоты приступов рвоты. Состояние оставалось стабильным в течение 6 месяцев до тех пор, пока не развилась желудочная непроходимость, в связи с чем была выполнена операция (по Бильрот 2). Во время оперативного лечения местных и отдаленных MTS обнаружено не было. Рентгенологическое исследование не выявило каких-либо патологических изменений в легких. УЗИ абдоминальных органов также не выявило патологии внутренних органов. После операции анализы крови и мочи быстро пришли в норму. Через 2,5 года после начала вакцинотерапии состояние пациента удовлетворительное, данных за прогрессию заболевания не отмечено.
Иммунитет человека борется не только с болезнетворными бактериями, вирусами и грибками. Принцип работы иммунной системы состоит в том, что, как только в организме появляется «незнакомое» вещество, оно сразу же распознается как «чужое» и подвергается атаке. Источниками таких веществ могут стать не только болезнетворные микроорганизмы, но и собственные аномальные клетки.
Во время деления клеток в нашем организме периодически возникают ошибки. Это неизбежно. Если что-то пошло не так, после деления дочерние клетки имеют неправильное строение, могут становиться раковыми. Иммунная система всегда настороже и готова их уничтожить.
Однако, иммунитет справляется со своей функцией не всегда — в противном случае ни у кого бы не возникали злокачественные опухоли.
Раковые клетки коварны, они могут обзавестись разными видами защиты:
- Если раковая клетка вырабатывает недостаточно много чужеродных веществ, иммунитет её не замечает.
- Некоторые опухоли умеют вырабатывать вещества, которые подавляют работу иммунных клеток.
- Иногда ведущая роль принадлежит микроокружению опухоли — клеткам и молекулам, которые окружают раковые клетки. Микроокружение тоже может подавлять иммунитет.
Для того чтобы иммунная система начала расправляться с опухолью, её нужно активировать, либо предоставить ей необходимые компоненты. Современные врачи и ученые знают, как это сделать. Такое направление лечения рака называется иммунотерапией. Существует несколько её разновидностей.
Какие бывают разновидности иммунотерапии?
На данный момент онкологам доступны разные виды иммунотерапии:
- Моноклональные антитела. Эти препараты представляют собой искусственные аналоги иммунной системы. Каждое из них имеет конкретную мишень — определенное вещество, вырабатываемое раковыми клетками.
- Ингибиторы контрольных точек. Контрольные точки — вещества, которые подавляют работу иммунитета. В норме они нужны для того, чтобы иммунная система не атаковала здоровые ткани. Раковые клетки часто используют контрольные точки для «маскировки». Ингибиторы снимают этот блок, после чего опухоль подвергается атаке.
- Противораковые вакцины. Организм можно привить не только против инфекций, но и против рака. Первая такая вакцина была одобрена в Америке еще в 2010 году. Пациенту вводят вещества, которые вырабатывают опухолевые клетки, чтоб стимулировать иммунный ответ.
- Модуляторы работы иммунитета. Обычно такие лекарства включают интерфероны, интерлейкины, факторы роста. Они улучшают работу иммунитета неспецифически — то есть не против каких-то определенных компонентов раковых клеток, а в общем.
- Клеточная иммунотерапия. Это направление показало успехи в некоторых исследованиях. Суть в том, что у пациента берут собственные иммунные клетки, активируют их против компонентов опухоли, затем размножают новый активированный клон в лаборатории и возвращают в организм больного. Такой «десант» начинает агрессивно атаковать раковые клетки. Это помогает уменьшить или полностью уничтожить опухоль.
Многие ученые считают, что за иммунотерапией будущее в лечении рака. Исследования в этом направлении продолжаются, в лабораториях разрабатывают и тестируют новые препараты.
Моноклональные антитела
Чужеродные вещества в организме человека называют антигенами. В ответ на их внедрение иммунная система вырабатывает специфические белковые молекулы — антитела. Каждое антитело связывается с соответствующим ему антигеном, после чего происходит ряд событий, приводящий к уничтожению чужеродного агента.
Моноклональные антитела — по сути искусственные заменители собственных антител человека. Каждое из них находит в организме свою молекулу-мишень и связывается с ней. В случае с онкологическими заболеваниями такой мишенью является определенное вещество, которое раковые клетки вырабатывают в достаточно большом количестве, а здоровые — в очень малом, или не вырабатывают вообще.
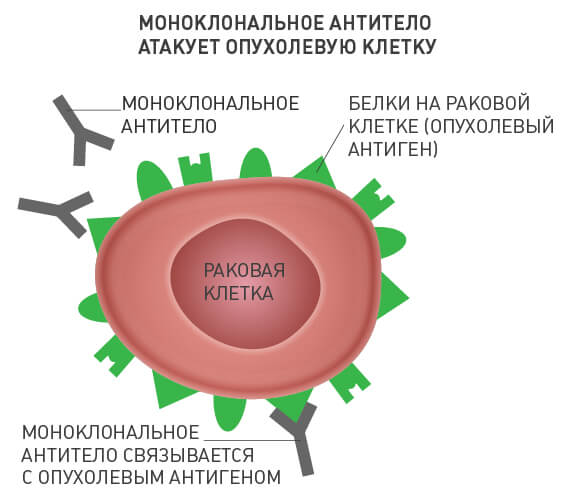
Различные моноклональные антитела действуют по-разному:
- «помечают» раковые клетки и делают их «заметными» для иммунитета;
- разрушают мембрану раковых клеток;
- блокируют рост опухоли или кровеносных сосудов;
- блокируют вещества, которые мешают иммунитету распознавать рак;
- непосредственно разрушают опухоль.
Моноклональные антитела можно использовать для доставки к раковым клеткам других лекарств. Например, можно прикрепить к молекуле антитела радиоактивную частицу или химиопрепарат.
За последние годы в мире было одобрено и внедрено в клиническую практику более десятка разных моноклональных антител. Они применяются для лечения ряда злокачественных опухолей, обладающих определенными молекулярно-генетическими характеристиками. В настоящее время ученые работают над созданием новых препаратов, некоторые лекарства проходят испытания и, возможно, вскоре будут введены в клиническую практику.
Кейтруда (Пембролизумаб)
Кейтруда — моноклональное антитело, мишенью для которого является PD-1 — рецептор запрограммированной клеточной гибели. Препарат помогает снять «маскировку» раковых клеток, в итоге иммунитет может их распознать и атаковать.
PD-1 – это рецептор, который находится на поверхности T-клеток. Когда он взаимодействует с белком PD-L1, замедляется размножение иммунных клеток, они перестают выделять цитокины и атаковать опухолевую ткань. Кейтруда разрывает эту связь и снимает блок с лимфоцитов:

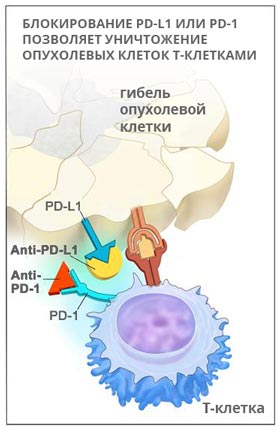
Пембролизумаб был одобрен к применению в Америке в сентябре 2014 года. В настоящее время его используют для лечения меланомы, немелкоклеточного рака легких, опухолей головы и шеи. Кейтруду обычно назначают при некурабельных опухолях, которые невозможно удалить хирургически, если другие методы лечения не помогают.
Ниволумаб (Опдиво)
Ниволумаб, как и Кейтруда, является ингибитором белка-рецептора PD-1. В декабре 2014 года этот препарат был одобрен в Америке для лечения меланомы. В настоящее время основными показаниями к применению Ниволумаба являются: метастатическая и неоперабельная меланома, местнораспространенный или метастатический мелкоклеточный и немелкоклеточный рак легких, почечно-клеточный рак на поздних стадиях. В ряде случаев ниволумаб сочетают с другим ингибитором контрольных точек – ипилимумабом (Ервой).
Ритуксимаб (Мабтера, Ритуксан)
Мишень для ритуксимаба — рецептор CD20, который находится на поверхности B-лимфоцитов. Соединяясь с рецептором, препарат заставляет NK-клетки (натуральные киллеры — разновидность иммунных клеток) атаковать B-лимфоциты, как злокачественные, так и нормальные. После курса лечения организм производит новые нормальные B-лимфоциты, их количество восстанавливается.
Ритуксимаб был одобрен к применению достаточно давно — еще в 1997 году. В настоящее время его используют для лечения аутоиммунных и онкологических заболеваний: хронического лимфолейкоза, вульгарной пузырчатки, неходжкинской лимфомы, идиопатической тромбоцитопенической пурпуры.
Ипилимумаб (Ервой)
Ервой связывается с молекулой CTLA-4 и активирует иммунную систему, для того чтобы она могла бороться с раком. Исследования показывают, что препарат помогает надолго остановить рост опухоли, а в 58% случаев способствует уменьшению её размеров, как минимум, на треть.
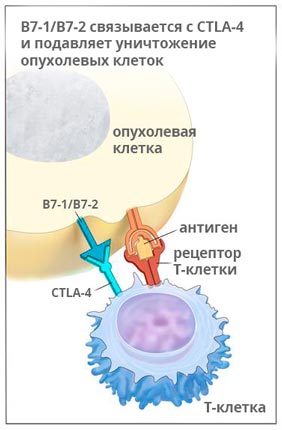
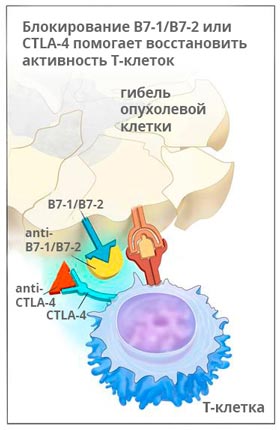
Ипилимумаб применяют у пациентов, страдающих меланомой на поздних стадиях, раком легкого, простаты.
Цитокины
Цитокины – это неспецифические стимуляторы иммунитета. Они активируют иммунную систему не против какого-то определенного антигена, а в целом. В настоящее время в онкологии главным образом применяют два препарата – интерлейкин-2 (ИЛ-2) и интерферон-альфа.
Интерлейкин-2 представляет собой молекулу, которая переносит биохимические сигналы между лейкоцитами. Он ускоряет рост и размножение иммунных клеток. Этот препарат находит применение при распространенном раке почек, метастатической меланоме. Иногда ИЛ-2 сочетают с химиотерапией и другими цитокинами. При этом его действие усиливается, но повышается риск серьезных побочных эффектов.
В настоящее время ведутся исследования по возможности применения в онкологии других типов интерлейкинов, таких как ИЛ-7, ИЛ-12, ИЛ-21.
Интерфероны – вещества, которые принимают участие в борьбе с вирусами и раковыми клетками. Существует три типа интерферона, названных по буквам греческого алфавита – альфа, бета и гамма. Для лечения рака применяют препараты интерферона-альфа. Они помогают усилить противоопухолевый иммунный ответ, непосредственно замедлить рост раковых клеток и кровеносных сосудов, которые обеспечивают опухоль кислородом и питательными веществами.
Интерферон-альфа применяют при раке почек, меланоме, волосатоклеточном лейкозе, некоторых типах лимфомы, саркоме Капоши.
Иммунотерапия при раке легкого
Рак легких — одно из самых распространенных онкологических заболеваний. По заболеваемости и уровню смертности он занимает первое место у мужчин и третье место у женщин. Почти 20% пациентов, умерших от злокачественных опухолей, погибли от рака легкого. В группе повышенного риска находятся курильщики в возрасте старше 50 лет. На каждые 3–4 миллиона выкуренных сигарет приходится одна смерть от рака легких.
Заболевание часто диагностируют на поздних стадиях, когда многие виды лечения оказываются неэффективны. В таких случаях пользу может принести иммунотерапия.
При раке легкого применяют такие препараты, как ниволумаб (Опдиво), ипилимумаб (Ервой), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик).
В Европейской клинике применяются наиболее современные методы лечения рака легкого, меланомы и других онкологических заболеваний. Благодаря сотрудничеству с зарубежными коллегами, мы может предоставить пациентам возможность пройти курс иммунотерапии, персонализированного лечения в нашем центре иммунотерапии. Мы знаем, как продлить жизнь и избавить от мучительных симптомов при запущенном раке. Мы знаем, как помочь.
Иммунотерапия при меланоме
Меланома — далеко не самая распространенная (всего 2%) форма рака кожи, но она очень агрессивна и чаще других опухолей приводит к смерти. Так, в 2012 году в мире было диагностировано 232 000 новых случаев меланомы, 55 000 больных погибли. Меланома рано метастазирует, после чего многие методы лечения становятся неэффективны.
На поздних стадиях для лечения меланомы применяют пембролизумаб (Кейтруда), ипилимумаб (Ервой), ниволумаб (Опдиво).
Отзыв пациента о лечении меланомы иммунотерапией:
Расскажу, как меня «лечили» в одной клинике, как спасли в Европейской, и как мне невольно пришлось стать экспертом в иммунотерапии меланомы.
Мне 41, я бывший спортсмен-байдарочник, волосы черные, глаза карие — то есть, я нормально переношу загар, кожа смуглеет быстро, а ожогов у меня не бывает. Я, конечно, слышал, что длительное пребывание на солнце чревато всякими проблемами, а так как основную часть времени я проводил как раз на солнце, регулярно проверялся у дерматолога. От него и узнал, что есть такая беда, как меланома — рак кожи. Но, по его словам, мне она не грозит, как раз ввиду особенностей моей кожи.
Ну, и, конечно, у меня нашли меланому. Причем, что обидно, не на спине или плечах, что было бы логично — эти места постоянно под лучами, а на бедре.
Показать полностью »
В первую очередь, по совету дерматолога, отправился в одну небезызвестную клинику. Приняли охотно, сказали, что вероятность хорошего исхода большая, так как обнаружена она достаточно рано.
Но, этот выигрыш они благополучно спустили на недельные обследования. По результатам мне назначили операцию ещё через неделю, а потом Интерферон. Я обратился к тому же дерматологу, который послушал меня, и несколько удивился. Ничего толком не сказал, но намекнул на то, что можно бы получить и второе мнение, да побыстрее.
Вот тогда я и обратился в Европейскую клинику. Там мне быстро сделали ПЭТ-КТ и ещё несколько обследований, определили отсутствие BRAF-мутаций, и, к сожалению, констатировали начало распространения новообразования. Операцию сделали сразу после исследования. Потом курс иммунотерапии — Опдиво. Очень повезло, что распространение пятна только-только началось. Иначе, как я понял потом, за такие сроки, которые планировались в первой клинике, можно было дождаться уже серьёзного распространения и больших неприятностей. Вот тогда бы никакой Опдиво, а тем более Интерферон не помогли бы. Сейчас чувствую себя отлично, за местом, где было пятно пристально следят в Европейской. Ещё прохожу курс, прогрессирования нет. После таких оперативных и техничных действий, которые меня, по сути, спасли, я им доверяю полностью. Отдельное спасибо, конечно, Андрею Львовичу и Анне Александровне. Всегда видно, когда врач на твоей стороне и откровенно объясняет, что и как у нас делается в сфере онкологии. Обращайтесь к ним — они сделают лучшее, что вообще возможно, а не то, что делают обычно «по инструкциям», из которых половина в России не работает.
Запись
на консультацию
круглосуточно
Иммунотерапия при раке желудка
При раке желудка I–III стадии основным методом лечения является хирургическое удаление опухоли, нередко его дополняют курсом химиотерапии и лучевой терапии. На IV стадии, когда опухоль распространяется за пределы органа и дает метастазы, шансы на полную ремиссию стремятся к нулю. В таких случаях проводят лечение, направленное на замедление роста опухоли, сокращение её размеров, продление жизни пациента.
Именно на IV стадии, когда рак желудка не реагирует на другие виды лечения, может принести пользу иммунотерапия. Эффективны такие препараты, как трастузумаб и рамуцирумаб. В настоящее время исследования в отношении иммунотерапии при раке желудка ведутся в четырех основных направлениях: ингибиторы контрольных точек, таргетная иммунотерапия моноклональными антителами, противораковые вакцины и клеточная иммунотерапия.
Иммунотерапия при раке почки
При лечении рака почек иммунотерапией применяет две группы иммунопрепаратов:
- Цитокины — белки, которые активируют иммунную систему и заставляют её бороться с раком. Для лечения применяют искусственно синтезированные аналоги этих белков: интерлейкин-2 (IL-2) и интерферон-альфа.
- Ингибиторы контрольных точек. Контрольные точки — это особые молекулы иммунной системы, которые она использует, чтобы сдерживать себя от атаки здоровых клеток. Иногда они мешают бороться против опухолевых клеток. При раке почек применяют Ниволумаб (Опдиво) — он блокирует PD-1, белок, который находится на поверхности T-лимфоцитов.
Иммунотерапия при раке яичников
В последние годы хирургическое лечение и химиотерапия при раке яичников значительно продвинулись вперед, и все же ситуация пока еще далека от идеальной. У многих женщин опухоль рецидивирует, перестает реагировать на препараты, которые помогали ранее. Из иммунопрепаратов при раке яичников в настоящее время применяется Бевацизумаб (Авастин) — представитель группы моноклональных антител, который блокирует фактор роста эндотелия сосудов. Раковые клетки синтезируют это вещество в большом количестве, чтобы стимулировать рост новых сосудов, обеспечить себя кислородом и питательными веществами. Некоторые методы иммунотерапии при раке яичников в настоящее время находятся на стадии разработки и тестирования: моноклональные антитела, ингибиторы контрольных точек, иммуномодуляторы, противораковые вакцины, иммуноклеточная терапия, онколитические вирусы.
Побочные эффекты иммунотерапии
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Иногда иммунотерапия активирует иммунные клетки чрезмерно, и они начинают атаковать нормальные ткани организма. Из-за этого могут возникать некоторые побочные эффекты:
- При поражении слизистой оболочки полости рта и глотки на ней возникают болезненные язвы, которые могут инфицироваться. Обычно они проходят в течение 5–14 дней после окончания лечения.
- Кожные реакции: покраснение, отечность, сухость, повышение чувствительности к свету, трещины на кончиках пальцев.
- Симптомы, напоминающие грипп: слабость, разбитость, повышенная температура, озноб, кашель.
- Тошнота и рвота.
- Головные боли, головокружения.
- Повышение или снижение артериального давления.
- Мышечные боли.
- Одышка.
- Отеки на ногах.
- Увеличение веса из-за задержки жидкости в организме.
- Диарея.
У разных иммунопрепаратов побочные эффекты выражены по-разному. Лучше заранее поговорить с врачом и спросить, каких проблем можно ожидать во время курса лечения, как с ними бороться.
Иммунотерапия: за и против
Несомненное преимущество имму