Феррум лек при раке желудка
Комментарии
Опубликовано в:
«ОНКОЛОГИЯ. ЖУРНАЛ им. П.А. ГЕРЦЕНА» »» № 2, 2012
С.В. МОИСЕЕВ
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН
Снеговой Антон Владимирович — канд. мед. наук, ст. науч. сотр., специалист по поддерживающей терапии отд. изучения новых противоопухолевых лекарств
Рассмотрена проблема анемии у онкологических больных. Одной из причин развития анемии является дефицит железа. Абсолютная или функциональная нехватка железа снижает эффективность применения рекомбинантного эритропоэтина, используемого для лечения анемии индуцированной химиотерапией. Многочисленные исследования показали, что внутривенные формы железа по сравнению с пероральными более эффективно восполняют дефицит железа необходимый для оптимального эритропоэза. Современные американские и европейские рекомендации (ESMO, NCCN) по лечению анемии у онкологических больных включают обязательное использование внутривенных форм железа.
Ключевые слова: анемия, химиотерапия, железодефицитная анемия, эритропоэз.
Iron preparations in the treatment of anemia in cancer patients
S.V. MOISEYEV
N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences
The paper considers the problem of anemia in cancer patients. Iron deficiency is one of the causes of anemia. Absolute or functional iron deficiency lowers the efficacy of recombinant erythropoietin used to treat anemia with induced chemotherapy. Numerous trials have shown that intravenous versus oral iron preparations are more effective in compensating for the lack of iron indispensable for optimal erythropoiesis. Today’s American and European guidelines (ESMO, NCCN) for the treatment of anemia in cancer patients include the compulsory use of intravenous iron formulations.
Key words: anemia, chemotherapy, iron-deficiency anemia, erythropoiesis.
В последние годы анемия привлекает к себе пристальное внимание ученых, так как является частым осложнением опухолевых заболеваний и противоопухолевой цитотоксической терапии. На фоне лекарственного лечения частота анемии среднетяжелой (НЬ 8-10 г/л) и тяжелой (НЬ 6,5-8 г/л) степени достигает 75%, что отрицательно сказывается на качестве жизни пациентов [1]. Кроме того, анемия ведет к тканевой гипоксии, снижает чувствительность опухоли к химиотерапии и лучевой терапии и является независимым прогностическим фактором, определяющим выживаемость онкологических больных [2].
В течение многих лет единственным методом лечения тяжелого анемического синдрома в онкологии была гемотрансфузия (ГТ), а точнее переливание донорской эритроцитарной массы. ГТ и сейчас используется при необходимости быстрого повышения уровня гемоглобина, хотя обладает множеством побочных эффектов и, по данным американских авторов, существенно увеличивает риск тромбоэмболии и смерти [3].
Создание и внедрение в практику лечения онкологических больных рекомбинантных человеческих эритропоэтинов (ЭПО) значительно снизило количество ГТ и обусловленных ими осложнений. При этом отмечено положительное влияние ЭПО на качество жизни пациентов [4]. Однако, являясь единственным патогенетическим методом лечения анемии, ЭПО не всегда позволяют достичь желаемого результата. Одной из причин этого может быть дефицит железа.
Спорные вопросы, касающиеся использования ЭПО у онкологических больных, достаточно подробно освещены в ряде отечественных публикаций [5, 6]. Целью данного обзора является оценка роли дефицита железа и препаратов для его коррекции в лечении анемии у онкологических больных.
Железо является функциональным компонентом большого числа ферментов, играющих важную роль в основных метаболических процессах. По мнению M. Aapro и соавт. [7], дефицит железа у онкологических больных составляет 30-60%.
Этиопатогенетические механизмы развития анемии при злокачественных опухолях многофакторны и сложны. Активация иммунной системы и гиперэкспрессия провоспалительных цитокинов (интерлейкины-1 и 6, фактор некроза опухоли, интерферон-гамма и др.) нарушает продукцию эндогенного эритропоэтина, эритроцитов и метаболизма железа [8-10].
Гепсидин — гормон синтезируемый печенью, открыт и описан A. Krause и соавт. [11] как LEAP — liver expressed antimicrobial peptide. Установлено, что гиперпродукция интерлейкина-6 способствует повышенному синтезу гепсидина. Циркулируя в плазме, гепсидин взаимодействует с транспортным белком ферропортином, подавляет всасывание железа в кишечнике, высвобождение его и макрофагов из депо, что приводит к дефициту железа в костном мозге и развитию анемии [12]. При том, что количество железа в организме может быть достаточным и даже повышенным, возникает так называемый функциональный дефицит железа (ФДЖ) [13, 14].
Таким образом, существует дефицит железа абсолютный и функциональный. Функциональный дефицит железа характеризуется нормальным или высоким уровнем ферритина в сыворотке (<800 нг/мл), насыщением трансферрина <20%, увеличением пропорции гипохромных эритроцитов и ретикулоцитов, низким уровнем среднего объема эритроцитов (MCV <80 fl), низким содержанием гемоглобина в эритроците (МСН <27 pg). Может возникать в результате возросших потребностей костного мозга в железе после стимуляции эритропоэза ЭПО.
Абсолютный дефицит железа у онкологических больных может развиваться в результате недостаточного поступления с пищей и недостаточной его абсорбции в желудочно-кишечном тракте, а также повышенной потребности организма при ряде клинических ситуаций (хирургическое вмешательство, желудочно-кишечное кровотечение и др.) Развитию железодефицитной анемии предшествуют стадии простого дефицита железа и железодефицитного эритропоэза. Простой дефицит железа характеризуется сниженной концентрацией ферритина в сыворотке (<30 нг/мл) и железа в костном мозге при нормальном уровне гемоглобина. Клинически отмечается утомляемость, снижение работоспособности, изменение настроения и ухудшение когнитивной функции. Железодефицитный эритропоэз развивается при дефиците железа, доступного для включения в протопорфириновую группу гемоглобина. Отмечается снижение уровня гемоглобина, низкий уровень железа в сыворотке, увеличение свободного протопорфирина в эритроцитах, повышение общей железосвязывающей способности сыворотки, низкое насыщение трансферрина (<15%). Железодефицитная анемия характеризуется снижением запасов железа, низким уровнем железа в сыворотке, повышением общей железосвязывающей способности сыворотки, очень низким уровнем насыщения трансферрина железом и снижением уровня гемоглобина [15].
В онкологии лечение анемии при абсолютном дефиците начинают с применения препаратов железа. При функциональном дефиците железа их сочетают со стимуляторами эритропоэза. При уровне ферритина >800 мг/мл и насыщении трансферрина — 20% препараты железа не вводятся.
В клинической практике для внутривенного введения используются следующие препараты: карбоксимальтозат железа (феринжект), сахарат железа (венофер), глюконат железа (ферлицит), декстран железа (феррумлек, космофер). Все они представляют собой сферические железо-углеводные коллоидные комплексы, включающие железо-(111)-оксигидроксидное ядро, сходное по структуре с ферритином, которое покрыто углеводной оболочкой. Оболочка придает комплексу стабильность и замедляет выделение железа. Эффективность и переносимость внутривенных препаратов зависят от состава оболочки, молекулярной массы и стабильности комплекса. Глюконаты имеют низкую молекулярную массу, менее стабильны и быстрее высвобождают железо: период полувыведения (Т½) — 1 ч. Декстраны имеют большую молекулярную массу, более стабильны — Т½ — 30-60 ч, но наиболее часто дают аллергические реакции, включая анафилактический шок. Сахараты имеют Т½ — 5,3 ч, значительно реже дают аллергические реакции.
Карбоксимальтозат железа (феринжект) характеризуется медленным физиологическим высвобождением железа из стабильного комплекса с углеводом, что определяет его низкую токсичность. Феринжект после внутривенного ведения захватывается ретикулоэндотелиальной системой и распределяется на железо и карбоксимальтозу. После однократного внутривенного введения препарата в дозах от 100 до 1000 мг максимальная его концентрация в сыворотке (37-333 мкг/мл) достигается через 15 мин — 1,21 ч. Время полувыведения составляет 7-12 ч, среднее время удержания в организме 11-12 ч. Препарат практически не выделяется почками. Феринжект вводится внутривенно струйно в максимальной дозе 200 мг не более 3 раз в неделю или в дозе 1000 мг внутривенно капельно 15 мин не чаще 1 раза в неделю. Препарат хорошо переносится и не требует проведения тест-дозы, возможность возникновения аллергических реакций минимальна [16].
Таким образом, больные со злокачественными опухолями часто страдают анемией, которая может быть железодефицитной. Для лечения этих состояний используют средства, стимулирующие эритропоэз и гемотрансфузии. Одновременно необходимо возмещение дефицита железа.
Впервые эффективность комбинации ЭПО с препаратами железа была выявлена в нефрологии, причем было установлено преимущество именно внутривенных форм железа по сравнению с пероральными. В последнее десятилетие проведен ряд исследований по оценке такого лечения у онкологических больных с анемией, индуцированной химиотерапией. Результаты некоторых из них представлены ниже.
В исследовании М. Auerbach и соавт. [17] 157 пациентов, получавших эритропоэтин альфа еженедельно в течение 6 нед, были рандомизированы на три группы: 1-я — дополнительно вводился декстран железа внутривенно струйно или капельно; 2-я — получала препарат железа внутрь, 3-я — была контрольной. Все пациенты имели исходный уровень НЬ<105 г/л и низкое насыщение трансферрина <19%. При оценке через 6 нед лечения в контрольной группе средний уровень НЬ <105 г/л (анемия сохраняется), во 2-й группе НЬ — 112 г/л, целевой уровень не достигнут, существенной разницы с контролем нет. В 1-й группе достигнут максимальный уровень гемоглобина — 119-122 г/л, отличий при струйном и капельном введении нет. Дополнительно оценивали частоту гематологического ответа — процент больных, достигших уровень НЬ >120 г/л или имевших увеличение НЬ >20 г/л. Гематологический ответ достоверно превышал показатели 2-й группы и контроля: 68, 36 и 25% соответственно (р<0,01).
В исследовании D. Henry и соавт. [18] 187 пациентов получали лечение эритропоэтином альфа 1 раз в неделю в течение 12 нед. Из них 129 были рандомизированы на три группы: 1-я — получала дополнительно глюконат железа внутривенно; 2-я — сульфат железа внутрь; 3-я — была контрольной. Включались больные с исходным уровнем НЬ <110 г/л и насыщением трансферрина <15%. При оценке через 8 нед лечения прирост уровня НЬ в 1-й группе составил 24 г/л, а во 2-й и 3-й — 16-15 г/л. Гематологический ответ в 1-й группе составил 73%, во 2-й и 3-й группе соответственно 45 и 41%. Разница статистически достоверна как между 1-й и 2-й группами (р=0,009), так и между 1-й и контролем (р=0,0044).
В 2008 г. L. Bastit и соавт. [19] опубликовали результаты крупного (n=396) открытого рандомизированного исследования III фазы. Пациенты с исходным уровнем НЬ <105 г/л и насыщением трансферрина >15% получали лечение дарбэпоэтином альфа по 500 мкг 1 раз в 3 нед в течение 16 нед. Сравнивались две группы: исследовательская — дополнительно внутривенно 1 раз в неделю вводился сахарат железа; контрольная — железо вводилось перорально или не вводилось. Частота гематологического ответа в исследовательской группе составила 86%, а в контрольной — 73%. Дополнительно оценивалась потребность в заместительных гемотрансфузиях, которая в группе комбинированного лечения достоверно различалась с контролем (9% против 20% соответственно, р=0,005).
В исследовании P. Pedrazzoli и соавт. [20] 149 больным дарбэпоэтин вводился по 150 мкг 1 раз в неделю с внутривенным железом или без него. Авторы показали достоверное преимущество комбинированного лечения с включением внутривенного железа. Интересные данные получили М. Hedenus и соавт. [21], оценившие не только гематологический ответ, но и количество израсходованного ЭПО. Было установлено, что комбинированное применение ЭПО с внутривенным железом в среднем на 25% снижает расход ЭПО по сравнению с контролем.
В литературе имеются публикации, указывающие на возможность достижения целевого уровня гемоглобина и снижения потребности в гемотрансфузиях у онкологических больных с анемией, при использовании только внутривенных форм железа. В 2010 г. Р. Dangsuvan и соавт. [22] опубликовали результаты локального исследования (n=44), в котором сравнивался сахарат железа и пероральные препараты у пациенток с анемией на фоне химиотерапии без дополнительного введения ЭПО. Потребность в заместительных гемотрансфузиях в группе внутривенного сахарата железа составила 22,7%, с пероральным препаратом железа — 63,6%. Опубликованы данные, показавшие эффективность внутривенных препаратов железа для лечения анемии у онкологических больных без применения средств, стимулирующих эритропоэз. В 2010 г. Т. Steinmetz и соавт. [23] опубликовали результаты исследования по оценке эффективности и переносимости карбоксимальтозата железа у онкологических больных с анемией и абсолютным или функциональным дефицитом железа. Оценка эффективности проведена у 420 пациентов, которые были рандомизированы в группу внутривенного железа без средств стимулирующих эритропоэз (n=347), и группу, получавших этот же препарат в комбинации со стимуляторами эритропоэза (n=73). Через 5 нед лечения гемоглобин в обеих группах повысился до 11-12 г/л. Нежелательные явления (в основном тошнота и диарея), возможно, связанные с карбоксимальтозатом железа, составили 2,3%. Препарат в обоих случаях эффективно повышал и стабилизировал уровень гемоглобина у онкологических больных [23].
Заключение
Анемия часто встречается у больных со злокачественными новообразованиями и связана как с основным заболеванием, так и с его лечением: цитотоксическая и лучевая терапия оказывают прямое подавляющее действие на кроветворение. Анемия при злокачественных опухолях по патогенезу ассоциируется с анемией при хронических заболеваниях и нередко сочетается с дефицитом железа — функциональным или абсолютным. Результаты международных исследований показали необходимость использования внутривенных форм железа с гемостимулирующей терапией ЭПО для лечения анемии, возникшей на фоне химиотерапии. Одновременно существуют указания на эффективность внутривенного железа в монотерапии при функциональном его дефиците. Это явилось основанием для включения в международные рекомендации (NCCN, ESMO) по проведению гемостимулирующей терапии у онкологических больных внутривенных форм железа [15, 24]. При отсутствии дефицита железа (ферритин >800 нг/мл и насыщение трансферрина >20%) вводить его не рекомендуется, как и пациентам с признаками активной инфекции [15]. Целевой уровень гемоглобина при лечении анемии не должен превышать 12,0 г/дл (120 г/л), его достижение сопровождается улучшением качества жизни пациентов и, возможно, результатов противоопухолевого лечения и выживаемости. Надеемся, что дальнейшее проведение хорошо спланированных международных исследований позволит ответить на многие вопросы, еще существующие в этой проблеме.
Недавно в клинической практике появился новый препарат для внутривенного введения — железа карбоксимальтозат (феринжект), показавший высокую эффективность как в комбинации с ЭПО, так и в монорежиме. Феринжект не требует проведения тест-дозы, обладает хорошей переносимостью и минимальным риском развития аллергических реакций.
Список использованной литературы
- Ludwig H, Van Bells S, Barret-Lee P. et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur. J. Cancer. 2004; 40: 2293-306.
- Caro J.J., Salas M., Ward A. et al. Anemia as an independent prognostic factor for survival in patients with cancer: a systemic, quantitative review. Cancer. 2001; 91: 2214-21.
- Khorana A., Francis C., Blumberg N. et al. Blood transfusions, thrombosis and mortality in hospitalized patients with cancer. Arch. Intern. Med. 2008; 168: 2377-81.
- Bohlius J., Wilson J., Seidenfeld J. et al. Recombinant human erythropoietins and cancer patients: update meta-analysis of 57 studies including 9353 patients. J. Natl. Cancer Inst. 2006; 98: 708-14.
- Абрамов М.Е. Анемия на фоне химиотерапии. Пути коррекции. Фарматека. 2012; 8: 50-4.
- Птушкин В.В. Анемия в онкологии: подходы к лечению. Современная онкология. 2012; 14 (1): 58-63.
- Aapro M., Osterborg A., Gasco P. et al. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v.iron. Ann. Oncol. 2012. doi: 10.1093/annonc/mds112.
- Павлов А.Д., Морщакова Е.Ф., Румянцева А.Г. Анемия при злокачественных новообразованиях: патогенез и лечение рекомбинантными человеческим эритропоэтином. Современная онкология. 2002; 4: 50-4.
- Duhrsen U., Augener W., Zwingers T., Brittinger G. Spectrum and frequency of autoimmune derangements in lymphoproliferative disorders: analysis of 637 cases and comparison with myeloprolif-erative diseases. Br. J. Haematol. 1987; 67 (2): 235-9.
- De Rienzo D.P., Saleem A. Anemia of chronic disease: a review of pathogenesis. Tex. Med. 1990; 86: 80-3.
- Krause A., Neitz S., Magert H. et al. LEAP-1, a novel highly disul-de-bonded human peptide, exhibits antimicrobial activity. FEBS Letters. 2000; 480: 147- 50.
- Park C.H., Valore E.V., WaringA.J., Ganz T. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J. Biol. Chem. 2001; 276: 7806-10.
- Милованов Ю.С., Милованова Л.Ю., Козловская Л.В. Нефрогенная анемия: патогенез, прогностическое значение, принципы лечения. Клиническая нефрология. 2010; 6: 7-18.
- Дворецкий Л.И. Железодефицитная анемия в практике терапевта. Русский медицинский журнал. 2009; 23: 1517-21.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Cancer- and chemotherapy-induced Anemia. Version 2.2012 (R).www.NCCN.org.
- Crichton R., Danielson G., Geisser P. Iron therapy with special emphasis on intravenous administration. Science. 2008; 1-127.
- Auerbach M., Ballard H., Trout R. et al. Intravenous iron optimizes the response to recombinant human erythropoietin in cancer patients with chemotherapy-related anemia: a multicenter, open-label, randomized trial. J. Clin. Oncol. 2004; 22: 1301-7.
- Henry D.H., Dahl N.V., Auerbach M. et al. Intravenous ferric gluconate improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy. Oncologist. 2007; 12: 231-42.
- Bastit L., Vandebroek A., Altintas S. et al. Randomized, multi-center, controlled trial comparing the efficacy and safety of darbepoetin alfa administered every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia. J. Clin. Oncol. 2008; 26: 1611-8.
- Pedrazzoli P., Farris A., Del Prete S. et al. Randomized trial of intravenous iron supplementation in patients with chemotherapy-related anemia without iron deficiency treated with darbepoetin alfa. J. Clin. Oncol. 2008; 26: 1619-25.
- Hedenus M., Birgegard G., Nasman P. et al. Addition ofintravenous iron to epoetin beta increases hemoglobin response and decreases epoetin dose requirement in anemic patients with lymphoprolif-erative malignancies: a randomized multicenter study. Leukemia. 2007; 21: 627-32.
- Dangsuwan P., Manchana T. Blood transfusion reduction with intravenous iron in gynecologic cancer patients receiving chemotherapy. Gynecol. Oncol. 2010; 116 (3): 522-25.
- Steinmetz T., Tschechne B., Virgin G. Ferric Carboxymaltose for the Correction of Cancer- and Chemotherapy-Induced Anaemia in Clinical Practice. J. Support Cancer Care. 2010; 19: 261.
- Schrijvers D., de Samblanx H., Roila F. Erythropoiesis-stimulating agents in the treatment of anaemia in cancer patients: ESMO Clinical Practice Guidelines for use. Ann. Oncol. 2010; 21: S 5: v244-v247, doi: 10.1093/annonc/mdq202.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
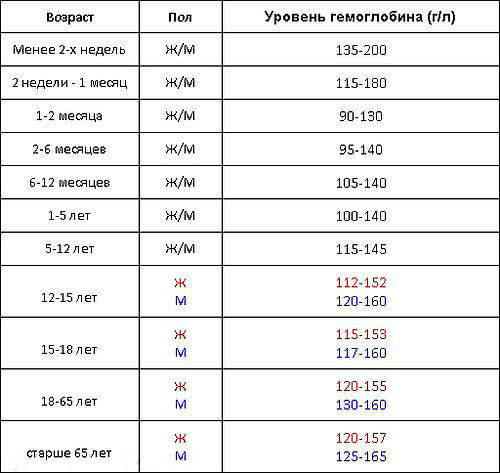
Гемоглобин — это белок, который содержится в красных кровяных телах, эритроцитах. Он ответственен за перенос кислорода ко всем органам и тканям, поэтому его нехватка сразу же ведет к целому патологическому каскаду и негативным последствиям для всего организма. Низкий гемоглобин при онкологии обусловлен целым рядом самых разных причин и факторов и требует незамедлительной реакции со стороны лечащего врача. У здорового человека содержание гемоглобина в крови должно быть на уровне 110-120 грамм на литр у женщин и 120-140 г/л у мужчин. Данные цифры могут колебаться в зависимости от ряда индивидуальных факторов (заболевания, вредные привычки, менструальный цикл у женщин и так далее), однако не должны превышать 10 г/л. Понятия норма гемоглобина при онкологии, как такового не существует в медицине в связи с тем, что каждая патология имеет свои закономерности и влияния.Однако, в норме следует придерживаться следующих цифр:
Таблица содержания гемоглобина по полу/возрасту
Почему падает гемоглобин при онкологии?
При развитии опухолевого процесса в организме запускается целый каскад патологических реакций, которые тянут за собой осложнения в органах и системах даже не связанных с первичным очагом. В основном идут нарушения в наиболее важных звеньях организма — иммунной системе, кроветворной, дыхательной и сердечно-сосудистой системах. Соответственно, эти патологические процессы усугубляют друг друга, создается некий порочный круг, который мешает борьбе организма с опухолью и выздоровлению пациента. На самом деле, падение гемоглобина при онкологии происходит по нескольким причинам:
- Функциональные нарушения в кроветворной системе костного мозга вследствие общей раковой интоксикации организма.
- Органическое поражение костного мозга некоторыми видами злокачественных опухолей.
- Негативное воздействие цитостатических препаратов (химиотерапия) и лучевые процедуры, которые разрушают не только зрелые эритроциты, но и незрелые клетки-предшественницы в кроветворных органах.
- Недостаточное питание онкологического больного, раковая кахексия приводят к тому, что в организме падает общее количество белков и развивается вторичная анемия.
- Хронические микрокровотечения в тканях и органах, пораженных опухолевым процессом.
Все эти процессы могут проходить параллельно друг другу и приобретают связанный характер, который грамотный онколог должен стремиться разорвать с помощью того или иного метода сопутствующего лечения. Почему же нехватка гемоглобина в организме столь опасна для онкологических пациентов? Анемия мешает иммунной системе человека полноценно бороться с раковыми клетками — по исследованиям японских ученых снижение уровня гемоглобина на 20% уменьшает естественную активность Т-киллеров, иммунных клеток, которые целенаправленно уничтожают патологические агенты.
Кроме этого, анемия приводит к общей гипоксии в тканях, как пораженных раком, так и здоровых. Что также дополнительно усугубляет негативное влияние на организм.
Как поднять гемоглобин при онкологии: 4 способа
Так же, как и происходит развитие анемии в несколько этапов и разными путями, так же и восстанавливать уровень гемоглобина при онкологических заболеваниях надо учитывая все звенья цепи патогенеза. Поэтому существует несколько главных способов лечения анемии при раке, в зависимости от механизма развития:
- Терапевтические методы коррекции уровня гемоглобина с помощью лекарственных препаратов. Преимущественно используются комбинированные средства на основе железа и фолиевой кислоты, если анемия имеет железодефицитный характер. Из наиболее распространенных — “Феррум-Лек”, “Ферретаб”, “Тардиферрон”. Используются также в комбинации с другими классами препаратов и методами лечения.
- Специальная сбалансированная диета, которая подразумевает повышенное содержание белков, аминокислот, витаминов и минералов в ежедневном рационе. Особенно эффективна диета в ситуации, когда гемоглобин снижен вследствие нарушения аппетита (например из-за сеансов химиотерапии).
- Прием стимуляторов эритропоэза (созревание эритроцитов в кроветворных органах). В основном аналоги эритропоэтина назначаются при раке костей, почек или метастазов в селезенку, то есть если орган, где созревают клетки крови поражен опухолью и процесс эритропоэза нарушен. Самые популярные препараты — “Эпрекс” (эпоэтин-альфа), Гемостимулин. Кроме этого, при онкологии часто используются комбинированные препараты, которые параллельно стимулируют лимфопоэз или образование тромбоцитов, однако это во многом зависит от того, какой гемоглобин при онкологии был зафиксирован изначально. Это связано с тем, что при раке часто снижена концентрация в плазме всех форменных элементов крови.
- Переливания эритроцитарной массы или цельной крови. Такие трансфузии назначаются при хронических внутренних кровотечениях либо при неэффективности других методов лечения. Эритроцитарная масса получается путем фильтрации донорской крови на центрифуге, с последующим отделением концентрата красных кровяных телец.
 Несмотря на высокую эффективность лекарственных препаратов, призванных повысить гемоглобин при онкологии, терапевтические методы не всегда приемлимы для пациента в силу тех или иных обстоятельств. В частности, исследования показали, что после комплексного лечения большинства опухолей головы и шеи, стимуляторы эритропоэза и трансфузии эритроцитов оказывали негативное воздействие на организм. Препараты железа рекомендуется вводить внутривенно капельно, эффективность такого пути введения гораздо выше, чем прием таблетированной формы. Особенно, если анемия вызвана химиотерапией или лучевыми процедурами. Восстановление печени после химиотерапии — также важный этап в лечении низкого гемоглобина при раке.
Несмотря на высокую эффективность лекарственных препаратов, призванных повысить гемоглобин при онкологии, терапевтические методы не всегда приемлимы для пациента в силу тех или иных обстоятельств. В частности, исследования показали, что после комплексного лечения большинства опухолей головы и шеи, стимуляторы эритропоэза и трансфузии эритроцитов оказывали негативное воздействие на организм. Препараты железа рекомендуется вводить внутривенно капельно, эффективность такого пути введения гораздо выше, чем прием таблетированной формы. Особенно, если анемия вызвана химиотерапией или лучевыми процедурами. Восстановление печени после химиотерапии — также важный этап в лечении низкого гемоглобина при раке.
Продукты, повышающие гемоглобин при раке
Далеко не всегда терапия фарм препаратами является основным методом лечения анемии при раке, да и сами пациенты зачастую предпочитают сначала сбалансировать питание диетой. Особенно актуально это в случае раковой кахексии, то есть процессе, когда организм не получает достаточно питательных веществ. Итак, как повысить гемоглобин в крови при онкологии с помощью коррекции дневного рациона? Для начала следует определиться, что питание при онкологическом заболевании должно в первую очередь основываться на тех же принципах, что и у здорового человека. То есть, рекомендуется обильное питье, желательно щелочных и нейтральных минеральных вод, исключение из рациона копченостей, жареных продуктов и другой пищи, где содержатся канцерогены.  В свою очередь, следует увеличить прием свежих овощей и фруктов, клетчатки, орехов. В дневном рационе обязательно должно быть не менее 300 граммов белка и 600 г легко усваиваемых углеводов, желательно растительного происхождения. Однако, отдельно стоит обратить внимание на продукты, повышающие гемоглобин при онкологии.
В свою очередь, следует увеличить прием свежих овощей и фруктов, клетчатки, орехов. В дневном рационе обязательно должно быть не менее 300 граммов белка и 600 г легко усваиваемых углеводов, желательно растительного происхождения. Однако, отдельно стоит обратить внимание на продукты, повышающие гемоглобин при онкологии.
Сельдерей
Употребление сельдерея каждый день позитивно сказывается на электролитном балансе плазмы крови и косвенно повышает гемоглобин. Это связано с тем, что цинк, которого много в этом овоще, принимает важное участие в ферментативном цикле образования белков плазмы. Рекомендуется добавлять сельдерей в салаты и первые блюда.
Пророщенный овес
Употребление овса издавна популярно среди раковых больных, считается, что этот продукт благотворно влияет на состояние крови в общем, особенно хорошо повышает эритроциты и лейкоциты после лучевых процедур. Плюс ко всему, любые пророщенные злаки богаты витаминами группы В и микроэлементами (Селен, Хром, Молибден), которые в целом укрепляют иммунную систему.
Льняное масло
Растительные масла чрезвычайно полезны для ослабленного организма, так как ненасыщенные жирные кислоты активно связывают свободные радикалы. Льняное масло дополнительно выводит шлаки из желудочно-кишечного тракта и способствует улучшению пищеварения.
Говяжья печень, бобовые, морская капуста
Все эти продукты объединяет то, что в них содержится много железа. Поэтому, практически при всех видах анемии надо активно включать их в пищевой рацион. Кроме этого, в бобовых содержится множество ненасыщенных жиров и природных незаменимых аминокислот, а морская капуста богата йодом и ее рекомендуют при раке щитовидки. Таким образом, проблема как повысить гемоглобин при онкологии, должна рассматриваться с комплексным подходом. Конечный результат будет во многом зависеть от того, насколько правильно выявлена причина анемии, и как врач разобрался во всех патогенетических звеньях изменений в плазме крови. Кроме этого, большое значение играет локализация и характер основного заболевания, методы лечения и реабилитации, применяемые пациентом. Однако, за содержанием гемоглобина в крови нужно тщательно следить, что поможет организму больного лучше бороться с онкологией.


