Диссеминированный рак желудка это

Пациент: больная К., рак желудка с метастазами
Возраст: 45 лет
28.10.2002 г. больная поступила в клинику с диагнозом рак желудка (пилорического отдела) T4N3M1, осложненный декомпенсированным стенозом, метастазы в яичники, лимфоузлы брюшной полости и забрюшинного пространства.
Из анамнеза: в 2002 году отметила прогрессирующее снижение веса на 19 кг. В августе 2002 года у больной выявлен рак желудка (пилорического отдела) T4N3M1, осложненный декомпенсированным стенозом, метастазы в яичники, лимфоузлы брюшной полости и забрюшинного пространства.
Цитология № 7751/53 – низкодифференцированная аденокарцинома желудка.
10.09.2002 г. произведена операция – лапаротомия, ревизия органов брюшной полости. Наложение переднего впередиободочного гастроэнтероанастомоза с анастомозом Брауна. Проведение полихимиотерапии не планировалось, учитывая большую распространенность опухоли и низкую эффективность химиотерапии.
При поступлении в клинику “К-тест” состояние удовлетворительное, ослабленное, определяется асцит. При рентгеноскопии подтвержден рак дистальной половины желудка с метастазами. На КТ определяется асцит, двусторонний плеврит, увеличение отдельных забрюшинных лимфоузлов до 10 мм (рис. 3а). При ультразвуковом исследовании в малом тазу лоцируется метастаз Крукенберга размером 50 × 40 мм.
30.10.2002 г. проведен первый сеанс общей гипертермии с полихимиотерапией (5-фторурацил, лейковорин, доксорубицин). Максимальная температура составила 42,45 °С. В постгипертермическом периоде отмечалась транзиторная гипербилирубинемия (49,6 ммоль/л).
Повторно больная поступила в клинику 02.12.2002 г. через 4 недели после первого сеанса гипертермии. Состояние при поступлении удовлетворительное, жалоб нет, прибавила в весе 3 кг. При ультразвуковом исследовании органов малого таза отмечено уменьшение размеров метастазов в яичниках до 45 × 35 мм, что соответствует стабилизации.
05.12.2002 г. проведен второй сеанс общей гипертермии с полихимиотерапией, максимальная температура составила 42,58 °С. Постгипертермический период протекал гладко, и больная была выписана в удовлетворительном состоянии на пятые сутки после сеанса гипертермии.
Обследована в январе 2003 года через 1 месяц после второго сеанса общей гипертермии. При КТ брюшной полости асцита, плеврита и увеличения забрюшинных лимфоузлов не отмечается (рис. 3б). При ультразвуковом исследовании размеры яичников уменьшились до 30 × 28 мм, что соответствует частичной регрессии.
В марте 2003 года больная чувствует себя удовлетворительно, за период с октября 2002 года по март 2003 года прибавила в весе 16 кг, ремиссия сохраняется.
Оперативное лечение рака желудка с метастазами стало возможным
Учитывая выраженный клинический эффект, достигнутый после двух сеансов общей гипертермии с полихимиотерапией, 22.04.2003 г. выполнена операция – верхне-срединная лапаротомия: в брюшной полости – спаечный процесс, по всей брюшной полости – разрастание фиброзной ткани, метастазы в оба яичника. Выполнена субтотальная резекция желудка по Ру, резекция обоих яичников. Гистологически: в желудке – на фоне выраженного фиброза, эластоза единичные рассеянные комплексы атипичных клеток с гиперхроматозом и пикнозом ядер. Картина терапевтического патоморфоза III степени по Г.А. Лавниковой. В обоих яичниках на фоне фибротекоматоза и фиброза – комплексы опухолевых клеток с «целлюлярными» очагами некроза, пикнозом и рексисом ядер. Заключение: рак желудка (малодифференцированная аденокарцинома) с термохимиотерапевтическим патоморфозом III степени. Метастатическое поражение обоих яичников с терапевтическим регрессом.
Данный пример показывает возможность достижения частичной регрессии при использовании общей гипертермии у больной диссеминированным раком желудка. В приведенном примере объективный эффект был получен после второго сеанса общей гипертермии с полихимиотерапией, что дало возможность выполнить радикальную операцию.
Ист. болезни: 526/586
© 2020 Онкологическая клиника «К-тест» · Копирование материалов запрещено. *Цены, указанные на сайте, не являются офертой. Стоимость услуг устанавливается и оплачивается согласно прейскуранту Клиники, действующему на момент оказания услуги. Подробности по тел.8 (831) 439-15-14. Имеются противопоказания. Необходима консультация специалиста. Лицензия ЛО-52-01-005717 от 16.02.2017. ОГРН 1025203029763. ИНН 5260013184
Появление препарата тегафур+гимерацил+отерацил (ТГО), перорального производного фторпиримидинов, позволило по-новому взглянуть на лечение больных диссеминированным раком желудка. Интерес к препарату подтверждается массой международных исследований, в которых изучается его эффективность в комбинациях с различными препаратами. Комбинация ТГО с цисплатином оказалась равной по эффективности с режимом 5-фторурацил+цисплатин (различия в медианах общей и безрецидивной выживаемости статистически незначимы) при существенно значимой меньшей токсичности. Именно лучший профиль безопасности позволяет рассматривать его как перспективный препарат для лечения больных.
Рак желудка – высокоагрессивная опухоль с неблагоприятным прогнозом. Каждый год в мире диагностируется 1 млн новых случаев заболевания и 750 тыс. смертей. Рак желудка занимает 2-е место в структуре мировой онкологической смертности, поэтому остается важной медико-социальной проблемой. Более чем 70% (677 тыс.) случаев зарегистрировано в развивающихся странах, при этом половина приходится на страны Восточной Азии (в особенности Китай). Наибольшая частота смертности также отмечается в странах Восточной Азии (24:100 000 среди мужчин, 9,8:100 000 среди женщин), наименьшая – в Северной Америке (2,8 и 1,5 соответственно).
На сегодняшний день примерно у 65% пациентов рак желудка обнаруживается на 3–4-й стадиях, т.к. заболевание очень часто протекает бессимптомно. Такая статистика справедлива для стран всего мира, кроме Кореи и Японии, где реализуются систематические скрининговые программы, позволяющие выявлять рак желудка на ранних стадиях [1].
У 85% пациентов выявляются метастазы в лимфатических узлах и у 30% – в печени. Несмотря на успехи противоопухолевой лекарственной терапии, медиана общей выживаемости пациентов на стадии метастатической болезни составляет менее 12 месяцев [2].
Очень часто в химиотерапии рака желудка используются фторпиримидины. Новый препарат этой группы (тегафур+гимерацил+отерацил –ТГО), представляет собой комбинацию тегафура (который после абсорбции из желудочно-кишечного тракта трансформируется в противоопухолевое средство 5-фторурацил – ФУ), гимерацила (ингибитор дигидропиримидиндегидрогеназы, который предотвращает разрушение 5-ФУ) и отерацила (ингибитор оротатфосфорибозилтрансферазы), обладает большим периодом полувыведения и лучшим профилем безопасности, чем 5-ФУ. Гимерацил пролонгирует период полувыведения 5-ФУ, а отерацил улучшает переносимость препарата.
Одним из самых больших многоцентровых исследований ТГО стало таковое третьей фазы FLAGS (сравнение режимов цисплатин/ТГО и цисплатин/5-ФУ в лечении распространенного рака желудка и пищевода). В исследование были включены пациенты с нерезектабельным раком желудка [3].
Больные (n=1053) были рандомизированы в две группы. Первая группа (n=527) получала лечение в режиме: ТГО 25 мг/м2 внутрь 2 раза в сутки, 1–21 день, цисплатин 75 мг/м2 в/в 1-й день, каждые 4 недели. Вторая группа (n=526): 5-ФУ 1000 мг/м2/24 часа, дни 1–5, цисплатин 100 мг/м2 в/в 1-й день каждые 4 недели. Частота объективного ответа составила 29,1% в группе ТГО+цисплатин и 31,9% в группе цисплатин+5-ФУ (p=0,4). Медиана продолжительности общего ответа составила 6,5 и 5,8 месяца соответственно (р=0,08).
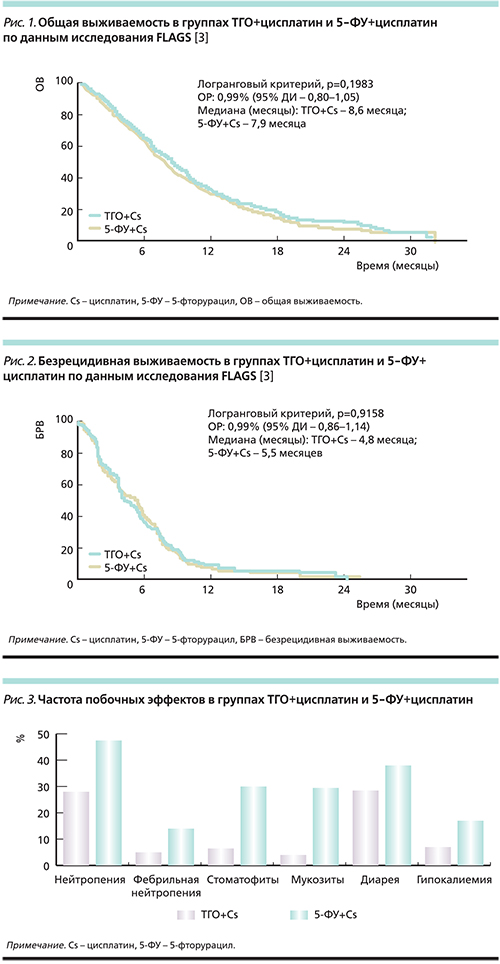
Медиана общей выживаемости в группе пациентов, получавших ТГО+цисплатин, составила 8,6 месяца против 7,9 в группе 5-ФУ+цисплатин (p=0,1983; рис. 1). Безрецидивная выживаемость составила 4,8 и 5,5 месяцев соответственно (p=0,9158; рис. 2).
Частота побочных эффектов в группе ТГО+цисплатин была значительно ниже (рис. 3). В группе ТГО+цисплатин отмечена значительно меньшая гематологическая токсичность: частота нейтропении в группе ТГО+цисплатин составила 28,6% (3–4-й степеней 18,6%) против 47,2% (3–4-й степеней 40,0%) в группе 5-ФУ+цисплатин. Фебрильная нейтропения отмечена у 5,0 и 14,4% пациентов соответственно. Смертность в результате токсичности составила 2,5% (n=13) в группе пациентов, получавших ТГО+цисплатин, и 4,9% (n=25) в группе 5-ФУ+цисплатин.
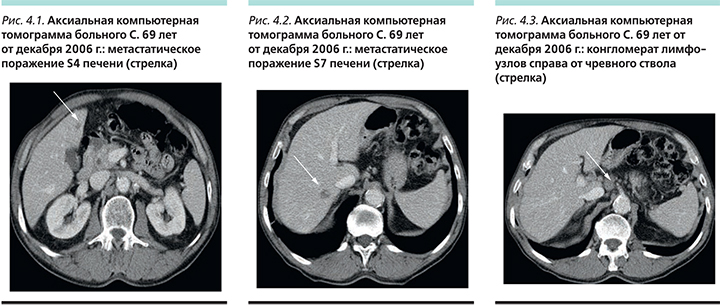
Также ТГО показал меньшую негематологическую токсичность. Частота стоматитов 6,3% (3–4-й степеней 1,3%) и 30,1% (3–4-й степеней 13,6%), мукозитов 3,8% (3–4-й степеней 0,8%) и 29,9% (3–4-й степеней 8,1%), частота диареи составила 29,2% (3–4-й степеней 4,0%) и 38,4% (3–4-й степеней 4,5%) соответственно. Гипокалиемия выявлялась у 6,9% (3–4-й степеней 3,6%) пациентов в группе ТГО+цисплатин и у 16,7% (3–4-й степеней 10,8%) в группе 5-ФУ+цисплатин.
Таким образом, исследователи пришли к выводу о равной эффективности режима ТГО+цисплатин по сравнению с режимом 5-ФУ+цисплатин (различия в медианах общей и безрецидивной выживаемости статистически незначимы) при существенно меньшей токсичности.
Ниже приводится клинический случай длительного и эффективного лечения пациента с метастатическим раком желудка с применением ТГО в рамках исследования FLAGS.
Клинический случай
Больной С. 69 лет. С апреля 2006 г. отметил появление болевого синдрома в эпигастральной области. Обратился к врачу в августе 2006 г. При эзофагогастродуоденоскопии (ЭГДС) выявлен рак желудка, при гистологическом исследовании – картина низкодифференцированной аденокарци-номы.
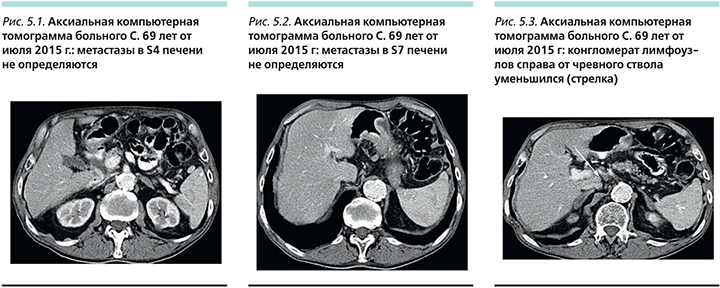
В сентябре 2006 г., по данным компьютерной томографии (КТ) органов брюшной полости, выявлены множественные метастазы в паренхиме печени (контрольные очаги: в S7 3,9×3,2 см, S4 2,0×1,9 см), метастазы в лимфатических узлах брюшной полости и забрюшинного пространства (справа от чревного ствола конгломерат 5,8×5,8 см, за селезеночной артерией 3,0×2,3 см).
При ЭГДС в октябре 2006 г. в желудке в средней трети передней стенки при переходе на малую кривизну отмечается язвенный дефект 4×2 см с дном, покрытым некротическим налетом на фоне опухолевой инфильтрации. Дистальная граница опухолевой инфильтрации – на уровне границы нижней трети и антрального отдела желудка по большой кривизне, проксимальная граница – на уровне середины верхней трети желудка по малой кривизне и задней стенке. Складки большой кривизны инфильтрированы.
С октября 2006 г. в рамках протокола TPU-S1301 начата химиотерапия по схеме: ТГО 25 мг/м2 2 раза в сутки в течение 21 дня, цисплатин 75 мг/м2 – 144 мг, день 1-й. Интервал между курсами химиотерапии составил 4 недели.
После 2-го курса отмечена положительная динамика по данным КТ: уменьшение болевого синдрома, уменьшение размеров метастазов в печени до 1,7×1,5 в S7 и 0,8×0,6 в S4, (рис. 4). Общий эффект по критериям RECIST (Response Evaluation Criteria In Solid Tumors ) частичный.
В соответствии с протоколом проведено 6 курсов химиотерапии по схеме ТГО+цисплатин с дальнейшей терапией ТГО в монотерапии. С апреля 2007 г. продолжена монохимиотерапия ТГО 25 мг/м2 с 1-го по 21-й дни каждые 4 недели.
Всего проведено 111 циклов химиотерапии в рамках протокола. При контрольных обследованиях сохранялся частичный эффект.
После 100 циклов химиотерапии, по данным КТ (рис. 5) органов брюшной полости, метастазы в паренхиме печени не определяются, лимфоузлы справа от чревного ствола уменьшились до 0,9 см, за селезеночной артерией отчетливо не визуализировались.
По данным ЭГДС, все еще определялась первичная опухоль: В области угла желудка определялся неглубокий язвенный дефект с неровным дном, покрытым фибринозно-некротическим налетом. Края инфильтрированы, бугристы. Инфильтрат распространялся на нижнюю треть тела по малой кривизне и задней стенке. Стенка на этом участке была ригидной, слизистая оболочка плотная, бугристая. В остальных отделах стенки желудка эластичные, слизистая оболочка атрофичная с очаговой гиперемией. Заключение: инфильтративно-язвенный рак нижней трети тела желудка. Отмечалось уменьшение размеров опухоли, положительная динамика.
Переносимость лечения была очень хорошей. Лечение проводилось амбулаторно. За все время лечения отмечена гематологическая токсичность, в связи с которой проведение химиотерапии откладывалось на неделю (тромбоцитопения 2-й степени 4 раза), и негематологическая (периферическая сенсорная полиневропатия 1-й степени, появившаяся после цисплатина).
Впервые госпитализирован после 109-го цикла в связи с анемией и необходимостью гемотрансфузии. Вероятной причиной стало кровотечение из опухоли желудка на фоне приема ривароксабана, назначенного в связи с мерцательной аритмией.
Рост первичной опухоли без прогрессирования отдаленных метастазов отмечен после 110-го цикла в октябре 2015 г., в связи с чем лечение в рамках протокола TPU-3101 завершено.
Таким образом:
- Длительность лечения в режиме ТГО+цисплатин составила 108 месяцев, в 10 раз превысив медиану общей выживаемости при диссеминированном раке желудка.
- Хорошая переносимость ТГО в монотерапии позволила провести весь курс химиотерапии амбулаторно.
- Высокая эффективность химиотерапии позволила длительно проводить лечение метастатического рака желудка без удаления первичной опухоли.
- На фоне химиотерапии отмечен полный регресс метастазов в печени, лимфатических узлах и частичный регресс первичной опухоли.
- Частичный регресс первичной опухоли контролировался по ЭГДС с повторными биопсиями. Прогрес-сирование первичной опухоли отмечено только через 108 месяцев.
1. Globocan. Stomach cancer. Estimated incidence, mortlaity and prevalence worlwide https://globocan.iarc.fr/old/FactSheets/cancers/stomach-new.asp#INCIDENCE1.
2. Sanford M. S-1 (Teysuno): A Review of Its Use in Advanced Gastric Cancer In Non-Asian Populations. Drugs 2013;73(8):845–55.
3. Ajani J., Rodrieguez W., Bodoky G., Moiseyenko V., Lichinitser M., Gorbunova V., Vynnychenko I., Garin A., Lang I., Falcon S. Multicenter Phase III Comparison of Cisplatin/S-1 With Cisplatin/Infusional Fluorouracil in Advanced Gastric or Gastroesophageal Adenocarcinoma Study: The FLAGS Trial. J. Clin. Oncol. 2010;28(9):1547–53.
М.Е. Абрамов – к.м.н., ст. науч. сотр. отделения химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России, Москва
Новости онкологии
07.04.2016
 Тюляндин Сергей Алексеевич
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Имеет ли клиническое значение удаление первичной опухоли у больного с метастатическим процессом? Это не праздный вопрос. Нефрэктомия у больных раком почки с наличием отдаленных метастазов улучшает качество жизни больного, повышает эффективность последующего лекарственного лечения и достоверно увеличивает продолжительность жизни. А как насчет рака желудка? Сегодня показанием к выполнению гастрэктомии у больных метастатическим раком желудка является кровотечение из распадающейся опухоли или угроза его повторения, а также стеноз кардиоэзофагеального или пилорического отделов. Можно ли надеяться, что выполнение плановой гастрэктомии у больных с метастатическим процессом улучшит прогноз больного? Теоретически возможно. Гастрэктомия существенно уменьшит объем опухолевой массы и иммуносупрессию, элиминирует потенциальный источник новых метастазов и симптомы болезни, обусловленные первичной опухолью. Все это может способствовать повышению эффективности последующей химиотерапии. С другой стороны, выполнение гастрэктомии может сочетаться с послеоперационными осложнениями, откладывает начало и повышает токсичность лекарственной терапии, что негативно отразится на результатах лечения.
На этот вопрос попыталось ответить исследование REGATTA, выполненное в Японии и Корее. В это исследование включались больные с подтвержденным диагнозом рака желудка в возрасте 20-75 лет и наличием первичной опухоли Т1-3 и лишь одного проявления метастатического процесса по данным КТ и диагностической лапароскопии из следующих: H1 – наличие 2-4 метастазов в печени с размером >1 cм и <5 см; P1 – метастазы по диафрагме и брюшине выше поперечноободочной кишки без массивного асцита и кишечной обструкции; L1 – метастазы в забрюшинные параортальные лимфоузлы выше чревного ствола или ниже а. inferior mesenterica (16a1/b2). В исследование не разрешалось включать больных с клинически значимым плевритом или асцитом, инвазией пищевода 3 см и более, затрудненным питанием и признаками кровотечения из первичной опухоли, ранее проведенной химиотерапией или лучевой терапией. Больные были рандомизированы в группу гастрэктомии с последующим проведением химиотерапии или группу только химиотерапии. Стратификация осуществлялась по характеру N (N0-1 vsN2-3) и локализации метастатического процесса (H1 vs P1 vs L1). Всем больным в группе операции выполняли гастрэктомию с D1 лимфодиссекцией, после чего в течение 8 недель после ее выполнения начинали химиотерапию. Все больные в данном исследовании получали S-1 80 мг/м2 ежедневно в 1-21 дни и цисплатин 60 мг/м2 в день 8, лечение повторяли каждые 5 недель до признаков прогрессирования или непереносимой токсичности. Основным критерием эффективности была медиана продолжительности жизни, вторичными критериями – медиана времени до прогрессирования и токсичность.
За период 2008-2013 гг. в исследование было включено 175 больных: 86 – в группу химиотерапии и 89 – в группу операции и химиотерапии. Запланированное лечение не было проведено 12 и 13 больным соответственно, эти больные вошли в анализ продолжительности жизни, но у них не производилась оценка токсичности. Медиана возраста больных составила 60 лет, 30% из них были женщины, Т3 составляли 90% всех опухолей, а N2-3 – 53%, основной локализацией метастазов была P1 – 75%. Тотальная гастрэктомия была выполнена у 64%, дистальная и проксимальная – у 30%, пробная лапаротомия – у 2%.
Исследование было остановлено после промежуточного анализа, который показал равную эффективность лечения в обеих группах и низкий шанс того, что гастрэктомия улучшит результаты лечения, если в исследование будут включены запланированные 330 больных. При медиане наблюдения 14,5 месяца медиана продолжительности жизни в группе химиотерапии составила 16,6 мес. и 14,3 мес. в группе операции и химиотерапии (HR=1,09 p=0,7). При исключении 25 больных, не получивших запланированного лечения, результаты не изменились (HR=1,01). Показатель 2-летней общей выживаемости составил в группах 31,7% и 25,1%, а 2-летняя безрецидивная выживаемость – 8,4% и 13% соответственно. Подгрупповой анализ показал, что выполнение гастрэктомии достоверно ухудшает прогноз больных с локализацией первичной опухоли в верхней трети желудка и с N0-1. Число проведенных курсов химиотерапии составило 7 в группе химиотерапии и 4,5 в группе хирургического лечения и химиотерапии. Частота побочных эффектов, особенно лейкопении, анорексии, тошноты и гипермагниемии, была выше в группе операции и химиотерапии.
Таким образом, это исследование показывает, что выполнение гастрэктомии с последующей химиотерапией у больных раком желудка с ограниченным метастатическим процессом не приводит к улучшению прогноза по сравнению с проведением стандартной химиотерапии. Более того, у больных с локализацией опухоли в верхней трети желудка или N0-1 хирургическое лечение и химиотерапия приводят к ухудшению результатов лечения по сравнению с только химиотерапией. Проведение химиотерапии оперированным больным сопровождалось большей токсичностью и худшей переносимостью, что частично объясняет меньшее число проведенных курсов лечения по сравнению с группой химиотерапии. Таким образом, для больных с метастатическим процессом химиотерапевтическое лечение остается стандартным подходом. Гастрэктомия, даже у больных с ограниченным метастатическим поражением, не улучшает отдаленные результаты лекарственной терапии.
Ключевые слова: рак желудка, метастазы, оперативное лечение, гастрэктомия.
Литература:
- Fujitani K, Yang H-K, Misuzawa J, et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single-curable factor (REGATTA): a phase 3, randomized controlled trial. Lancet Oncol. 2016, 17: 309-18.
Узнать больше о лечении опухолей ЖКТ можно на
Большой конференции RUSSCO 14-15 апреля 2016 в Москве
![]()
![]()
![]()
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.